构建思维模型 解答电解质溶液中粒子浓度问题
2021-11-24寸待罗
寸待罗

溶液中粒子数目及浓度计算类题目是近几年高考的常考题型之一,电解质溶液中的粒子数目及浓度受众多因素影响,解答此类题目还需具备各种平衡知识。因此,溶液中粒子数目及浓度计算类题目难度大,综合性强,区分度明显。然而这类题目也有较固定的解题模式,学生若能构建相应的模型即可顺利攻克。
1.电解质溶液中粒子数目计算
1.1 模型方法
一看前提条件:必须知道溶液的浓度和体积。
二熟悉不会水解的离子:Cl—、NO3—、SO42—、ClO4—、Br—、I—、K+、Na+、Ca2+、Ba2+。
三掌握计算公式:N=c·v·n·NA 期中n表示化学式中离子的个数。
解题模式:①只有浓度没有体积的溶液离子数目无法计算;②会水解的离子的数目无法计算;③胶粒的数目无法计算。
1.2 真题演练
【例1】NA表示阿伏伽德罗常数的值,下列说法是否正确。
(1)0.1mol·L—1的KNO3溶液中含有NO3—和K+离子数的总和为2NA。
(2)1 L 0.1mol·L-1硫代硫酸钠溶液含有的S2O32-数目为0.1NA。
(3)常温下pH=2的盐酸,每升溶液中的HCl分子数目为0.01NA。
(4)常温下100g46﹪的乙醇水溶液中含有氧原子的数目为1NA。
(5)将含0.1molAlCl3的溶液制成胶体,生成的Al(OH)3胶粒的数目为0.1NA。
答案 (1)× (2)× (3)× (4)×(5) ×
陷阱突破:细审题、抓“四看”
一看是否指明溶液的体积;
二看是否有弱电解质或可水解的离子,只有不会电离或水解的粒子才能根据公式计算;
三看所给条件是否与电解质的组成有关;
四看是否忽略溶剂中的某些原子。
2.利用电解质溶液中三大守恒规律计算、比较粒子浓度
2.1 模型方法
一是熟悉三大守恒規律及其数学表达式:电荷守恒是指离子所带的正、负电荷总数相等;物料守恒是指原子数目比是固定不变的;质子守恒是指基准态粒子(包括水分子)得、失质子数相等。
二是会判断适用哪个守恒规律:只有阴、阳离子浓度的等式用电荷守恒;有离子和分子浓度,但无c(H+)和c(OH-)的等式用物料守恒;有c(H+)、 c(OH-) 和分子浓度的等式用质子守恒。
解题模式:①先看溶质种类,单一溶液主要考虑电离或水解,混合溶液先考虑是否会反应后考虑电离或水解;②浓度大小比较根据电离或水解程度判断,浓度等式用守恒规律判断;③利用守恒规律和溶液酸碱性写出相关的粒子浓度关系式。
2.2 真题演练
【例2】室温下,下列溶液中粒子浓度关系正确的是()
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.CH3COOK和BaCl2混合溶液:c(K+)+c(Ba2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
答案 B
易错警示:①电荷守恒等式不是各离子浓度的简单相加。②物料守恒等式,必须写离子浓度系数。③单一溶液的质子守恒等式用列表法得出,混合溶液的质子守恒式根据电荷守恒等式和物料守恒等式联立得出。
3.离子平衡图像问题
3.1模型方法
一看图找信息:明确横、纵坐标的物理量及其含义;找出曲线的变化趋势、起点、终点及拐点。
二找联系:根据图像中点线面的含义,结合粒子间的化学反应及粒子浓度与PH值、Ka、Kh、Kw、Ksp的联系做出判断。
三思考原理:物质的性质及反应、化学平衡理论、化学守恒规律。
解题模式:先总览全图再找点。①滴定曲线图找起点、恰好反应点、滴定终点、过量点;②分布系数曲线图找交叉点,交叉点的c(H+)一般为对应酸的Ka;③粒子浓度比值对数曲线图找对数值为0的点;④溶解度曲线图找Ksp点。
3.2真题演练
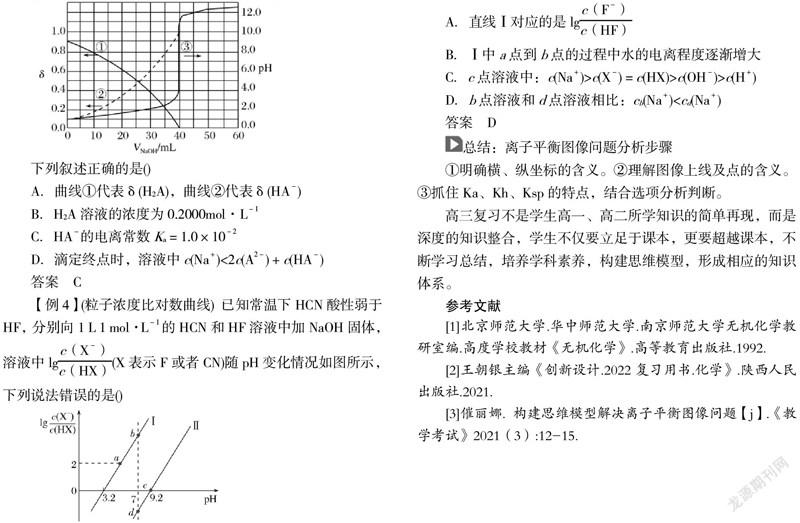
【例3】(滴定和分布系数综合曲线.2020.课标全国I,13)以酚酞为指示剂,用0.100 0mol·L-1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数:δ(A2-)=]
下列叙述正确的是()
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.2000mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
答案 C
【例4】(粒子浓度比对数曲线) 已知常温下HCN酸性弱于HF,分别向1 L 1 mol·L-1的HCN和HF溶液中加NaOH固体,溶液中lg(X表示F或者CN)随pH变化情况如图所示,下列说法错误的是()
A.直线Ⅰ对应的是lg
B.Ⅰ中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:c(Na+)>c(X-)=c(HX)>c(OH-)>c(H+)
D.b点溶液和d点溶液相比:cb(Na+) 答案 D 总结:离子平衡图像问题分析步骤 ①明确横、纵坐标的含义。②理解图像上线及点的含义。③抓住Ka、Kh、Ksp的特点,结合选项分析判断。 高三复习不是学生高一、高二所学知识的简单再现,而是深度的知识整合,学生不仅要立足于课本,更要超越课本,不断学习总结,培养学科素养,构建思维模型,形成相应的知识体系。 参考文献 [1]北京师范大学.华中师范大学.南京师范大学无机化学教研室编.高度学校教材《无机化学》.高等教育出版社.1992. [2]王朝银主编《创新设计.2022复习用书.化学》.陕西人民出版社.2021. [3]催丽娜. 构建思维模型解决离子平衡图像问题【j】.《教学考试》2021(3):12-15.
