病毒的锌指蛋白在病毒感染中的作用
2021-11-24邓学文汪铭书程安春
邓学文,汪铭书*,程安春
(1.四川农业大学动物医学院 禽病防治研究中心,成都 611130;2.四川农业大学动物医学院预防兽医研究所,成都 611130;3.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130)
锌指(zinc fingers, ZF)结构是一套广泛的蛋白结构元件,其通过结合Zn2+来稳定一种很短的可以自我折叠的蛋白结构[1],锌指蛋白(zinc-finger protein, ZNF)是迄今在真核生物基因组中分布最广的蛋白之一[2],可见ZF结构在真核生物生命进程中扮演着十分重要的角色。许多病毒也可以编码具有ZF结构的蛋白且该结构的改变会影响病毒的生物学特性,本文对常见的病毒ZF结构蛋白在病毒感染中所发挥作用的研究进展作一综述,以期为ZNF的研究提供参考。
1 锌指蛋白的结构与种类
锌指(zinc fingers, ZF)结构是一种通过肽链中的半胱氨酸或组氨酸与锌离子结合后自我折叠形成的指状空间结构[3],其定义为:在一段氨基酸序列中,有几个固定位置的半胱氨酸(cysteine,C)残基或组氨酸(histidine,H)残基,这些残基与Zn2+特异性结合后,肽链旋转折叠形成一种稳定的三维手指状结构,这一结构被称为ZF结构[4]。锌指蛋白(zinc-finger proteins,ZNFs)通常是指由一系列具有重复结构的ZF结构组成的蛋白质,可与DNA、RNA以及其他蛋白相结合并产生相互作用,从而对生物的生命过程起到调节作用,在真核生物中研究颇为广泛[5]。非洲爪蟾卵母细胞中的转录因子TF IIIa(transcription factor IIIa)是第一个被鉴定为含有ZF结构的蛋白[6-7],自此,研究人员开始对该领域展开研究。越来越多的研究表明,许多病毒也可以编码合成ZNF,且该蛋白结构的改变会影响病毒的生物学特性,可见ZNF在病毒生命周期中扮演着十分重要的角色[8]。目前,已知的ZF结构有很多种类,根据其保守结构域的不同以及半胱氨酸和组氨酸的数目和位置,可分为C2H2、C2HC、C3H、C4、C6、C4HC3、C3HC4、联合型等多种类型[9]。最为常见的是C2H2型ZF,该ZF含有两个半胱氨酸与两个组氨酸,分别与锌离子络合后通过1个α螺旋与2个反向β折叠形成一个手指状结构[10]。
2 病毒锌指蛋白在病毒感染中的作用
病毒感染是指病毒通过多种途径侵入机体,在易感宿主细胞中增殖并释放到细胞外再侵入邻近细胞的过程。目前,发现能编码ZNF的病毒包括:1型人类免疫缺陷病毒(HIV-1)、鼠白血病病毒(MuLV)、猴免疫缺陷病毒(SIV)、部分疱疹病毒(herpes virus)、冠状病毒(CoV)[11]、虾白斑综合征病毒(WSSV)[12]等。下文将对目前病毒的ZNF在病毒感染中所发挥作用的研究进展进行概述。
2.1 逆转录病毒锌指蛋白对病毒感染的影响
逆转录病毒侵入宿主后,在逆转录酶的作用下,以病毒基因组RNA为模板合成cDNA,之后再以该DNA为模板进行转录、翻译等一系列生命活动[13]。绝大部分逆转录病毒的核衣壳蛋白(nucleocapsid,NC)域包含1~2个ZF结构-C2HC(图1),ZF之间由基本序列29RAPRKKG35连接[14],该结构高度保守,对病毒基因组RNA组装期间的识别和包装具有重要作用,参与病毒的早期感染[15-16]。
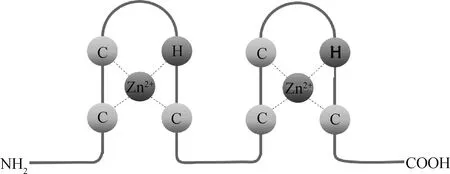
图1 NC区域ZF结构示意图[17]
研究证明,逆转录病毒的NC蛋白结构域可以与病毒编码的Tat蛋白产生互作,NC蛋白通过在胞质中堆积来阻碍Tat蛋白介导的病毒mRNA的转录以及翻译,从而调节病毒的复制[18]。NC蛋白还能与宿主蛋白Alix发生相互作用,Alix是一种内吞体分选转运复合体(endosomal sorting complex required for transport,ESCRT),介导内吞小泡出芽和多泡体(multivesicular bodies,MVBs)的形成[19],其拥有2个结构域:N端回形域Bro1和中心V型结构域,NC蛋白可以与Bro1相结合,参与病毒的释放[20]。
2.1.1 人类免疫缺陷病毒NC蛋白 人类免疫缺陷病毒(human immunodeficiency virus,HIV)的NC蛋白是HIV的Gag蛋白的前体多蛋白(pr55Gag)的N末端蛋白[21-22]。pr55Gag蛋白参与形成寡聚体支架,促进病毒基因组RNA的组装,形成新的感染颗粒[23-24],是病毒在反转录过程中的主要结构蛋白。病毒组装集中在病毒衣壳的主要结构蛋白——Gag蛋白上,该蛋白是一个55 ku的多聚蛋白[25],包含4个主要的子域,即基质(MA)、衣壳(CA)、核仁(NC)和p6。其中,NC在病毒粒子的组装、萌芽以及成熟阶段皆具有重要功能。首先,作为逆转录病毒的复制核心蛋白,NC在其内部稳定的ZF基序作用下可行使核酸伴侣功能,即与基因组RNA形成二聚体,并促进其反转录的发生[26-28]。其次,NC蛋白能募集大量宿主蛋白,包括肌动蛋白和肌动蛋白结合蛋白、亲环蛋白A、泛素以及赖氨酰-tRNA合成酶和许多RNA结合蛋白[29-30],其中,双链RNA结合蛋白Staufen1[31]是一种参与mRNA转运和翻译的宿主因子,NC蛋白与Staufen1相互作用调节病毒复制周期中的多个步骤,如Gag多聚化和基因组RNA衣壳化。Gag介导子代病毒颗粒衣壳的形成[32-33],NC蛋白通过激活PKR和破坏多囊泡来诱导病毒组装的发生,Staufen1通过结合和隔离NC蛋白并与RNA结合从而稳定多核糖体来破坏NC诱导的病毒粒子装配。研究表明,T细胞是HIV感染的靶细胞,通常在淋巴器官中呈极化形态,极化T细胞具有前缘区与尾足区两端,HIV的Gag会在其尾足区富集。受感染的T细胞通过富集有Gag蛋白的尾足与未感染T细胞接触,这个接触区域可能在病毒胞间传递中起着重要作用[34],被称为病毒突触(virological synapse,VS)。Llewellyn等[35]发现,NC蛋白能驱使Gag在极化的T细胞尾足区富集,促进VS的形成,为病毒的胞间感染传播提供平台,而NC蛋白的缺失将导致病毒胞间传递受阻。NC蛋白含有两个ZF结构域[36],Boutant等[37]通过对该区域进行两种突变,分别将核衣壳蛋白ZF域23位和44位的半胱氨酸替换为组氨酸,电镜下观察病毒的包装过程并未出现问题,但胞间感染能力却大大降低。相关研究证明,NC蛋白内源性逆转录(reverse transcription,ERT)是部分RNA病毒的一种逆转录方式[38],NC蛋白ZF结构的突变会导致病毒的蛋白酶失活,使病毒拷贝数明显下降[39],这说明HIV病毒的NC蛋白内源性逆转录与病毒感染性之间存在因果关系。
2.1.2 小鼠白血病病毒Ncp10蛋白 小鼠白血病病毒(murine leukemia virus,MuLV)是一种可引起小鼠白血病和神经系统疾病的逆转录病毒[40],其核衣壳蛋白Ncp10的ZF结构最早于1995年被Darlix等[41]发现并报道,Gorelick等[42]对该病毒核衣壳区域ZF结构进行了两种突变:CCCC和CCHH,两种突变病毒都可正常组装基因组,但是突变病毒的碱基出现缺失,DNA复制能力大幅降低,证明在MuLV感染宿主时,其NC蛋白中完整且严格保守的ZF结构是病毒复制所必需的。Gorelick等[43-44]还对MuLV的核衣壳蛋白中的一个C2HC ZF结构进行了两种点突变,使原39位的半胱氨酸突变为组氨酸以及使原来34位的组氨酸突变为半胱氨酸,结果证明,两种突变体病毒都可以表达出正常数量的Gag前体蛋白以及Env包膜蛋白,且突变株均包含了病毒的全长RNA,但是两株突变体无法合成cDNA,感染能力仅为亲本株的4×10-4倍,即几乎没有感染能力。除了对ZF结构的突变,Housset等[45]针对ZF侧碱性氨基酸也进行了突变,通过使用中性氨基酸将15到18位的ERRR残基以及40~42位的PKK残基进行多种替换和突变,发现当用1或2个中性氨基酸取代原来的碱性残基后并不会影响成熟病毒粒子的产生,但病毒的胞间传播能力皆减弱,当超过2个基本残基被中性氨基酸取代时,逆转录起始及基因组RNA二聚体包装发生严重缺陷,病毒胞间传播极度减弱。这些结果说明,NCp10 ZF区域的稳定是MuLV感染性病毒粒子增殖所必需的。
2.1.3 猴免疫缺陷病毒NC蛋白 Gorelick等[46]对猿猴免疫缺陷病毒(simian immunodeficiency virus,SIV)的核衣壳区域两个ZF结构进行了9种突变,所得到的突变病毒均可表达出正常的病毒蛋白,且表达量与亲本株没有显著差异,电镜观察所有突变病毒都具有与亲本株中未成熟病毒粒子相似的形态,然而,突变体的体外复制能力却明显下降,其感染性是野生型病毒的10-5~10-6倍。其中一个缺失了第2个ZF区域第33到第36位氨基酸的突变体病毒静脉注射到豚尾猕猴体内时,病毒丧失了感染能力。这说明SIV核衣壳蛋白ZF突变体病毒在体外和体内均存在复制缺陷。为了找出突变病毒失去感染性的原因,Akahata等[47]还进一步通过定量PCR检测了SIV感染细胞不同时间后突变病毒cDNA的合成量,证明了ZF结构突变体病毒感染能力减弱,部分原因是病毒cDNA合成减少以及基因组RNA的包装效率降低。Yovandich等[48]构建了6株在NC区域2个ZF中半胱氨酸残基被删减或替换的SIV突变病毒,这些突变体病毒均存在复制缺陷,通过电镜观察发现,点突变或缺失病毒的表型相似,与野生型病毒粒子相比,病毒粒子含有浓缩的核,核的电子密度更小;ZF远端的突变以及两种ZF中的点突变都可导致Gag蛋白的加工不完整,病毒粒子中的全长基因组RNA的转录水平降低约30%;同时,ZF中半胱氨酸残基以及它们之间的基本链接区域缺失的突变体病毒可以有效的完成Gag前体蛋白的加工,但其基因组RNA的包装仅仅为野生型病毒水平的10%,所产生的病毒粒子颗粒在大小和核心形态上也是异常的。这些结果表明,ZF结构基序的完整是Gag前体的正常加工和NC蛋白稳定表达的前提,也是影响病毒感染能力的重要因素。
2.2 疱疹病毒锌指蛋白对病毒感染的影响
2.2.1 疱疹病毒US10 蛋白 研究证明,HSV-1[49]、ILTV[50]、DPV[51-53]的US10蛋白均含有13个氨基酸构成的保守序列,经推测,该序列编码的氨基酸最终表达为C2H2型ZF结构蛋白。Ma等[54]通过细菌人工染色体[55](bacterial artificial chromosome,BAC)平台构建了鸭瘟病毒US10基因缺失毒株,在感染鸭胚细胞后发现,该重组病毒的滴度下降了10~100倍,但定量检测显示,缺失株与亲本株的基因组拷贝数无明显差异,推测US10蛋白的ZF结构主要影响疱疹病毒感染性病毒粒子的包装,对其基因组的复制无明显影响。
2.2.2 疱疹病毒UL52蛋白 单纯疱疹病毒1型(HSV-1)编码了一种由UL5、UL8和UL52编码蛋白组成的解旋酶/引物酶异源三聚体复合物。作为大型多蛋白分子复合物的一部分,解旋酶和引物酶在结构和功能上存在关联,并与其他几个复制体蛋白相互作用[56]。UL52蛋白C端含有保守的引发酶基序,其中包括一个ZF基序。然而,HSV-1和HSV-2 的UL52蛋白在986位置是一个亮氨酸残基,大多数其他疱疹病毒在这个位置是一个苯丙氨酸残基,Chen等[57]将该位置的亮氨酸替换为苯丙氨酸,发现突变体病毒引发酶的活性大幅降低(约为野生型的25%)。由于该突变位点位于UL52的ZF结构中,是否是该突变引起ZF结构和功能的改变,从而导致UL52功能变化有待考证,以及该ZF结构对引发酶的具体影响机制,还需做更深一步探究。
2.2.3 单纯疱疹病毒1型的ICP0蛋白 HSV-1的ICP0蛋白是病毒立即早期基因ICP0编码的一种重要的转录调控蛋白,可刺激潜伏状态病毒发生增殖性感染。该蛋白具有一段C3HC4ZF结构域,早期研究发现,定点突变该结构域中任何一个半胱氨酸或组氨酸都将导致病毒转录激活失败,并且ICP0的核内定位发生改变[58]。牛疱疹病毒1型(bovine herpesvirus 1,BoHV-1)属于疱疹病毒科疱疹病毒甲亚科成员,是一种α疱疹病毒病[59]。在BoHV-1ICP0基因中有一段ZF序列-C3HC4,该ZF被认为用于激活病毒胸苷激酶(TK)基因启动子从而激活病毒的增殖性感染,Inman等[60]首先报道该ZF结构对病毒的毒力具有重要作用,缺失了356~677位氨基酸的ZF结构突变将导致ICP0的亚细胞定位发生改变,无法激活TK启动子。Saira等[61]将该ZF结构中51位半胱氨酸突变为甘氨酸,发现相对于正常的BoHV-1,突变病毒表达了更多的ICP0蛋白,但检测到其在牛的细胞中的病毒滴度却有下降,并且其表达的突变蛋白无法反式激活病毒TK的启动子,表明ICP0高度保守的ZF结构对激活病毒转录和病毒裂解性感染至关重要。
2.3 其他病毒锌指蛋白对病毒感染的影响
尼多病毒(Nido viruses)目编码的一种非结构蛋白,在动脉病毒中被称为nsp10,在冠状病毒中被称为nsp14,包含一个解旋酶域和N端锌结合域(ZBD)[62]。研究证明,小动脉病毒的nsp10 ZBD突变体(Ser-59→Pro)的解旋酶活性受到显著破坏,导致基因组mRNA合成不足。在反向遗传学研究中,大多数这些ZBD突变使该病毒无法生存[63]。马动脉炎病毒(equine arteritis virus,EAV)的nsp10的ZBD对病毒复制也是必不可少的[64]。Seybert等[65]构建了38种nsp10 ZBD突变体,ZBD 突变体具有复制和转录能力,但不产生传染性子代病毒,且EAV ZBD突变体mRNA的转录水平降低到正常水平的1%以下,这说明EAV的ZF对于该病毒的感染性至关重要。严重急性呼吸系统综合征冠状病毒(SARS-CoV)的nsp14结构域包含5条β链组成的β折叠[66], 在β-折叠片的两边都存在ZF,外切核糖核酸酶(ExoN)的活性依赖于非结构蛋白nsp14中ZBD的存在[67-68],nsp14的ZBD位点突变破坏了nsp14 ZF结构,导致nsp14酶活性减弱,表明SARS-CoV的ZNF在催化病毒RNA合成中具有一定调节作用[69]。总的来说,病毒的ZF结构能够通过对病毒解旋酶活性的调控作用参与病毒的基因组复制或者转录过程,从而对病毒的生命周期起到调节作用,影响病毒感染的效率。
2.4 病毒锌指蛋白参与天然免疫调节
2.4.1 猪繁殖与呼吸综合征病毒nsp1α蛋白 猪繁殖与呼吸综合征是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的妊娠母猪繁殖障碍和仔猪呼吸道症状为特征的一种传染病[70]。NLRP3炎性体作为先天免疫的重要组成部分,在宿主抗病毒免疫中发挥着极其重要的作用[71-72]。研究表明,PRRSV可以激活NLRP3炎性小体,诱导促炎性细胞因子IL-1β分泌[73]。PRRSV的非结构蛋白1α(nsp1α)是病毒的重要免疫抑制蛋白,可抑制IFN-β转录和TNF-α的产生等[74-75],其N端有一个ZF结构域[76],王超等[77-78]通过删除或突变该ZF域氨基端,发现突变体未能阻止poly(I:C)诱导炎症小体启动子的激活并释放β干扰素。该研究首次表明,nsp1α有能力抑制NLRP3 炎症体所介导的β干扰素分泌,且ZF结构的高度保守对nsp1α抑制NLRP3介导的β干扰素释放至关重要。但是,该ZF结构在nsplα行使功能时所起到的具体作用机制还有待探究。
2.4.2 人巨细胞病毒US10蛋白 人巨细胞病毒(human cytomegalovirus,HCMV)入侵宿主后,可以干扰T细胞的识别功能以及自然杀伤细胞(nature kill,NK)的毒性作用,从而参与免疫逃避作用[79-80]。NK细胞的激活取决于表面受体HLA-G,HLA-G可抑制外周血NK细胞对Ⅰ型人类B细胞系721.221的杀伤作用[81-82]。Park等[83]研究发现,HCMV的US10蛋白定位于细胞内质网,可以干扰HLA-G在内质网的加工过程,降低HLA-G在膜表面的表达量,使NK细胞免疫作用紊乱,从而完成病毒免疫逃避。
2.4.3 冠状病毒 nsp14蛋白 冠状病毒(CoV)非结构蛋白 14(nsp14)是复制-转录复合物的一部分。SARS-CoV 的nsp14 结构中存在3个ZF[84],它是一种双功能酶,具有 3′ 到 5′外切核糖核酸酶(ExoN)和鸟嘌呤-N7-甲基转移酶(N7-MTase)活性[85-86]。nsp14 N7-MTase 活性对防止宿主免疫系统识别病毒 RNA 至关重要[87]。Case等[88]使用传染性胃肠炎病毒(TGEV)作为Alphacoronavirus模型,构建了一组nsp14点突变病毒,其中ZF 1(ZF-C)的特定突变体(rTGEV-ZF-C)与亲本病毒相比,rTGEV-ZF-C导致细胞病变效应和细胞凋亡水平降低,在感染后期dsRNA 积累水平降低,导致β干扰素(IFN-β)、肿瘤坏死因子(TNF)刺激基因拷贝数降低,都证实了该突变体引发的宿主抗病毒反应水平降低。总体而言,该研究揭示了ZF 在病毒抵抗天然免疫反应中的潜在作用。这为抗病毒策略提供了新的思路。
3 展 望
ZF特殊的空间结构使得它可以与特定的核酸或者蛋白相互作用,对病毒在感染宿主细胞中具有重要作用。目前,对ZNF的研究主要集中于抗病毒以及抗癌方面的研究[89-93],研究证明,某些Cys-Cys-Cys-His(CCCH)型ZNF,在免疫系统中起重要作用[94],对病毒ZF结构和功能的深入研究,有利于人们理解病毒在宿主体内的感染机制,也有利于抗病毒药物的研发。靶向ZF基序的化合物可废除逆转录病毒(如HIV-1和MuLV)的感染性,但是单纯靶向于ZF的药物无法鉴别宿主与病毒的ZF,毒性较大具有明显副作用,这也是目前没有研发出高安全性的商品化药物的原因之一。相信未来研究人员会攻克这一难题。
