原发性肾平滑肌肉瘤1例*
2021-11-24李庆文代昌远李文永张晓乐
邓 硕 薛 胜 李庆文 李 建 代昌远 李文永 张晓乐 陶 润 李 俊
(蚌埠医学院第一附属医院泌尿外科,蚌埠 233003)
原发性肾肉瘤极为罕见,占肾脏恶性肿瘤0.8%~2.7%。平滑肌肉瘤是肾肉瘤最常见的组织学类型,占肾肉瘤50%~60%[1]。目前,尚无诊断和治疗指南可循,多以国内外病例报告为依据。2020年10月我院收治1例原发性肾平滑肌肉瘤,疗效满意,报道如下。
1 临床资料
女,62岁,因左腰部疼痛2个月入院。既往体健。体格检查:左脊肋区叩痛阳性(+)。胸片提示肺纹理增多,余无异常。腹部CT平扫+增强示左肾体积增大,内见不规则软组织影,约10 cm×9 cm大小,增强扫描见延迟强化(图1)。血小板偏高356×109/L,尿、生化常规正常,凝血、免疫功能正常。术前诊断为左肾恶性肿瘤。全麻下行腹腔镜左肾癌根治性切除术。术中见左肾上极肿瘤周围粘连,与脾脏及膈肌粘连致密无法分离,遂行脾脏切除联合膈肌缺损修补术。手术时间110 min,术中出血量60 ml。术后第1天白细胞18.37×109/L,中性粒细胞占比90.4%,给予注射用哌拉西林舒巴坦钠2.5 mg+盐水100 ml Bid静滴,3 d后复查血常规各项指标恢复正常。术后6 d出院。术后病理:梭形细胞纵横交错分布,细胞胞浆丰富,细胞核两端钝圆;细胞异型明显,可见核多形性以及病理性核分裂像;大体标本肿瘤9.5 cm×8.0 cm×7.0 cm大小,伴出血、坏死;(左)输尿管切缘及脉管手术切缘均阴性,肾周脂肪囊手术切缘阴性,(左)肾上腺被膜见肿瘤成份(图2)。免疫组化标记(IHC2020-4521):瘤细胞VIM(+)、SMA(+)、CK(灶性+)、Des(-)、EMA(-)、S-100蛋白(-)、H-caldesmon(-)、S0X10(-)、MelanA(-)、HMB45(-)、LCA(-)、Ki-67(+,10%),见图3。术后6周复查腹部CT:胰腺后方及脾区不规则软组织肿块影,不均匀中度强化,最大截面83 mm×54 mm(图4)。考虑局部肿瘤复发,多学科讨论行血液基因检测,未发现靶向治疗相关基因突变及致病性遗传基因变异。行表柔比星60 mg d1~d2,异环磷酰胺2.0 g d1~d4联合化疗7个疗程。术后6个月复查胸腹部CT:左肾脾切除术后,左膈肌增厚(图5);胸部CT未见异常。随访8个月,未见局部肿瘤复发和远处转移。
2 讨论
2.1 临床特点
原发性肾平滑肌肉瘤起源于肾被膜、肾盂、肾盏和血管的平滑肌,是最常见的肾肉瘤,发病可见于各个年龄段。该病性别无明显差异,多见40~60岁,进绝经期的女性患病风险明显增加[2]。原发性肾平滑肌肉瘤的临床症状和其余肾癌鉴别极具挑战性,常见症状为腰腹部疼痛和镜下或肉眼血尿,其余有发热、消瘦、内分泌紊乱等全身表现。本例主要以腰腹部疼痛为主,其他症状并不明显。CT提示左肾有占位性病变,诊断左肾恶性肿瘤,术后病理诊断为原发性肾平滑肌肉瘤。原发性肾平滑肌肉瘤从临床表现上与其他肾肿瘤难以区分,其来源于软组织平滑肌,具有很高的恶性度和转移潜能,肿瘤生长速度快,有自发性破裂风险[3]。
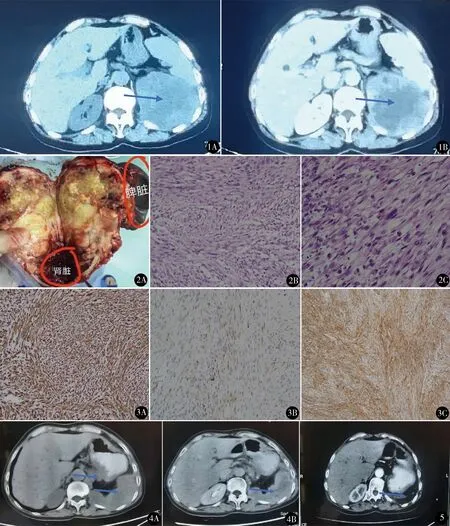
图1 术前双肾CT A.左肾体积增大,内见不规则软组织影;B.增强CT见延迟强化 图2 术后病理 A.左肾根治切除+脾脏切除标本(肿块巨大,侵犯大部分肾脏,与脾脏粘连致密);B.梭形细胞纵横交错分布,细胞胞浆丰富,细胞核两端钝圆(HE染色 ×200);C.细胞异型明显,可见核多形性以及病理性核分裂像(HE染色 ×400) 图3 免疫组化 A.肿瘤细胞阳性表达VIM,胞质染色(×200);B.肿瘤细胞阳性表达CK,胞质染色(×200);C.肿瘤细胞阳性表达SMA,胞质染色(×200) 图4 术后6周腹部CT平扫+增强 A.胰腺后方及脾区不规则软组织肿块影;B.肿瘤不均匀中度强化,最大截面83 mm×54 mm图5 术后6个月双肾CT增强:左肾脾切除术后,左膈肌增厚
2.2 影像学特点
原发性肾平滑肌肉瘤的临床症状与其他肾肿瘤无显著区别,影像学也有相似之处,仅凭临床症状和放射学检查难以辨别清楚。B超表现和其他肾癌相似,肾脏内可见一低回声肿块,边界不清,有不均匀的光斑。CT显示等致密或轻度高密度肿瘤,出血或囊性坏死,多数突破外包膜,向外生长,形成静脉性肿瘤血栓[4]。肿瘤增长速度快,发现时一般直径>5 cm。当肾脏CT显示大肿块、密度不均、大斑片状坏死囊肿,CT增强扫描显示延迟强化时考虑平滑肌肉瘤的可能性[5]。李晶英等[6]对11例平滑肌肉瘤CT进行分析,增强扫描肿瘤实质均呈延迟强化,坏死囊肿的部分未见显著强化。吴凌峰等[7]认为增强扫描时,在较大的肾脏肿瘤呈现延迟强化时多为肾平滑肌肉瘤。原发性肾平滑肌肉瘤表现为膨胀性、不均匀增强和边界清楚的实性肿块,通常从肾脏外生性突出[8]。MRI示肿瘤的纤维间质导致T1和T2低信号,静脉注射造影剂后显示延迟增强[9]。大的原发性肾平滑肌肉瘤可表现为多房囊性肿块,周边强化。
2.3 病理学特点和免疫组化
组织病理学和免疫组织化学是诊断这些肉瘤的唯一标准,肿瘤直径一般>5 cm,肉眼观呈灰白色或灰黄色鱼肉状,较大的肿瘤部分可见出血性坏死、液化灶和囊性变性。大斑片状坏死是原发性肾平滑肌肉瘤的特征之一[10]。平滑肌细胞镜下可见嗜酸性细胞交织排列,细胞核居于正中,末端钝,局部可见核多形性、核异型性、有丝分裂象和细胞坏死。免疫组化常显示SMA、Vimentin和 Des阳性。本例瘤细胞VIM(+)、SMA(+)。随着经皮活检技术经验的增加,可以对肾脏中的任何病变进行安全采样。经皮穿刺通道种植是肾恶性肿瘤活检过程中相对常见的并发症,然而研究[11, 12]显示经皮穿刺活检可以安全进行,无显著通道种植的风险。
2.4 治疗及预后
原发性肾平滑肌肉瘤临床上十分少见,文献多是以个案报告为主。肾肉瘤比其他泌尿系统部位肉瘤致死率更高,表现为侵袭性行为和不良的预后,肾根治术作为首选治疗。Demir等[13]报道直径<4 cm且无转移的患者可行肾部分切除术,5年生存率与根治性手术无差别。瘤体较大采用经腹腔入路更有优势,操作空间更大,对于合并周围脏器侵犯,可行联合脏器切除。此病血性转移较早,肝脏、肺部和骨骼是常见的转移部位,病情进展快,发现时往往已处于中晚期,一些患者已经出现部分浸润和转移灶。原发性肾平滑肌肉瘤具有很高的恶性度和转移潜能,预后很差,5年生存率29%~36%[14]。Kendal等[15]报道112例肾平滑肌肉瘤中位生存时间25个月,5年总体生存率为25%。祖力皮卡尔·赛都拉等[16]报道17例肾平滑肌肉瘤5年生存率为18.2%。由于该病较为罕见,缺乏大样本报道,目前对原发性肾平滑肌肉瘤的总体生存率仍不能做出准确的评价。van der Graaf等[17]主张侵袭性肾平滑肌肉瘤可手术联合放化疗综合治疗。2019版中国临床肿瘤学会《软组织肉瘤诊疗指南》指出,平滑肌肉瘤属于化疗中度敏感性肉瘤,对于晚期非特指型软组织肉瘤患者的姑息化疗,一线治疗方案仍以蒽环类±异环磷酰胺为主[18]。原发性肾平滑肌肉瘤术前新辅助化疗+根治手术+以多柔比星为基础的术后化疗可使局部控制率、总体生存率、无病复发率明显提高[19]。本例术后有局部肿瘤复发表现,行表柔比星联合异环磷酰胺(表柔比星60 mg d1~d2+异环磷酰胺2.0 g d1~d4)化疗7个疗程,术后8个月随访,局部肿瘤复发消失,无远处转移,效果满意。
总之,原发性肾平滑肌肉瘤临床少见,恶性度高,生长快,预后差。临床和影像学表现与其他肾肿瘤无明显差异,术后病理和免疫是确诊的金标准。肾根治性切除术仍是主要的治疗手段。本例术后6个月与术后6周CT相比,局部复发肿瘤消失,提示化疗方案对该病效果较好,但由于是个案报告,也可能与个体特异性有关,期待进一步研究。通过融合基因组测序、生物信息与大数据等的交叉应用,可能对该病的分子靶向治疗提供新的理论基础,提高对原发性肾平滑肌肉瘤的认识,对其诊断和治疗具有重要意义。
