探析实验探究命题特点及突破策略
2021-11-24李爱军
李爱军
(山东省滨州市沾化区下洼镇第一中学 256803)
以“重视基础、关注探究、联系实际,促进发展”为的命题原则下,实验探究题成为中考的必考题.以理论和实际相结合,以社会生活和社会热点为背景组织命题,主要考查学生的阅读理解能力、猜想能力,获取与处理信息能力,实验方案的设计与评价能力,对实验现象、数据的分析与对比能力及分类比较、抽象、概括等科学法的运用能力等,试题以中等或中等偏上难度为主,有较好的区分度.
一、探究物质的成分
例1某校甲、乙兴趣小组同学在学习酸、碱、盐、金属的化学性质后,分别做了A、B、C三组实验:

甲、乙小组同学都观察到C组实验的现象为____.
实验结束后,甲、乙小组同学分别同时将三组实验反应后的物质各倒入一个洁净的烧杯中,都观察到有气泡产生,甲、乙小组同学分别对气体成分及充分反应后烧杯中溶液的溶质成分进行探究.
【查阅资料】



【实验探究】见表1.
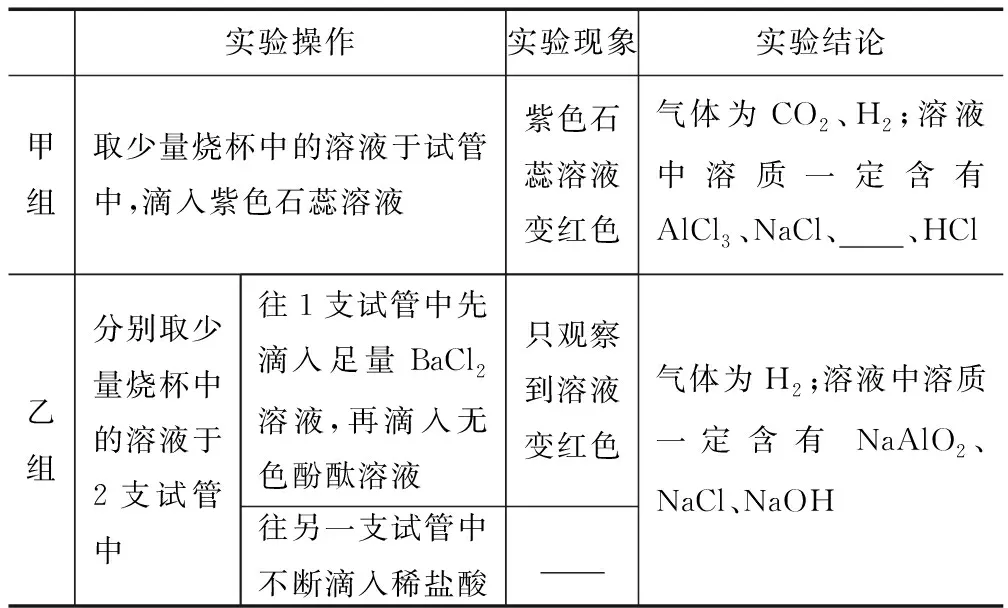
表1
【交流与反思】(1)乙小组同学讨论后认为,甲组同学得出气体成分的结论不严谨,其理由是____.(2)甲、乙小组同学所做实验相同,得出的实验结论却不同,原因是____.
【拓展与应用】只用一条化学方程式表示AlCl3与过量NaOH在溶液中的反应:____.
解析这是一道典型的信息与探究相结合的试题,不但能较好地考查实验分析及灵活运用信息解答具体问题能力,而且还较好地考查酸碱盐之间的复分解反应及有关反应先后等知识,突出了命题基础与能力并重的命题思想.因碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,故观察到白色沉淀.

【交流与反思】(1)由紫色石蕊试液变红,证明溶液中含有盐酸,又因碳酸钙与稀盐酸能反应生成二氧化碳,故仅凭有气泡产生是无法得出有氢气产生;(2)甲、乙小组同学所做实验相同,但由于所用试剂的量不同,导致发生的反应不同.


【突破策略】解答时,首先读题,明确实验目的,并找出实验中涉及的物质,写出有关反应的化学方程式.其次对物质成分提出猜想,如本题中溶质成分的猜想:①可溶性的生成物,②过量的反应物(不包含固体),③生成物与过量反应物.再次,根据猜想中物质的性质设计实验.最后根据实验现象得出实验结论.
注意:(1)对于含杂质的混合物与另一种物质反应,若杂质是不反应的不溶物,则反应后过滤的滤渣中一定存在该物质,若杂质是不反应的可溶物,则过滤后的滤液溶质中一定存在该物质.(2)若发生多个反应,还要考虑生成物与其他反应中可能过剩的反应物继续反应,再结合上述步骤综合判断,避免漏掉可能的猜想.
二、探究物质性质及其影响因素
例2丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量.小组同学实验探究其性质和防霉的效果.
1.探究丙酸钙的性质
进行实验用下图裝置(夹持仪器已略去)完成实验,记录结果见表2.

表2
解释与结论(1)②中现象说明有CO2产生.CO2与石灰水反应的化学方程式为____.
(2)查阅资料得知丙酸钙与盐酸反应无气体生成.由实验②可得出的结论是____.
2.探究丙酸钙防霉的效果
进行实验分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录结果见表3.
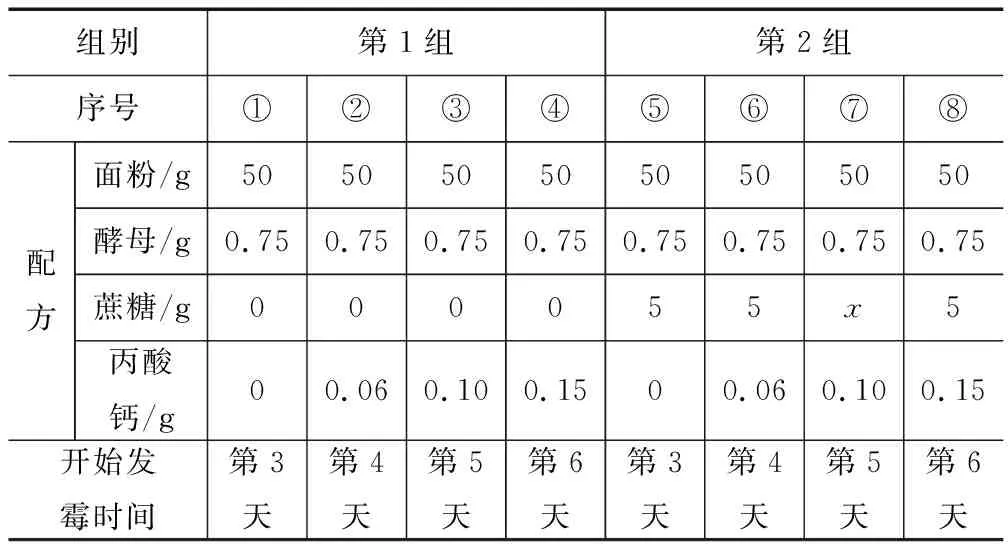
表3
解释与结论(3)设计第1组实验的目的是____.
(4)第2组,⑦中x为____.
(5)对比第1组、第2组实验可得到的结论是____.
反思与评价(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:____.
解析这是属于控制变量思想下的物质性质探究题.丙酸钙从类别上看属于含氧酸盐,因而从盐的通性及稳定性角度去思考,所以实验从其稳定性及分解产物角度设计的.
(1)二氧化碳与氢氧化钙反应为:

(2)根据信息“丙酸钙与盐酸反应无气体生成”及步骤②现象知,丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳.
(3)对比第1组实验配方可知,只有丙酸钙的质量不同,故该实验目的是探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响.
(4)对比第2组与第1组数据知,第2组加入蔗糖的质量应相同,故x=5.
(5)由表中数据可知,在只有蔗糖有无其它条件相同下,开始发霉的时间相同,故说明蔗糖对丙酸钙防霉效果无影响.
(6)由题干信息“国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量”,说明过量使用可能有害.

突破策略物质性质探究题,一般先从物质类别、稳定性等角度做出大致猜测,以利于快速理解题意,然后再结合实验过程、实验现象及问题要求去推理与解答.至于性质的影响因素则需要从控制变量角度去设计,即只允许一个变量可变其它条件相同,如本题中探究丙酸钙的量对发酵的影响.
三、对化学反应或现象的探究
例3欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去).
【实验1】配制溶液
(1)用NaOH固体配制20g20%NaOH溶液,无需用到的玻璃仪器有____(填标号).
A.胶头滴管 B.酒精灯
C.量筒 D.烧杯 E. 玻璃棒
【实验2】按如图1所示装置进行实验.
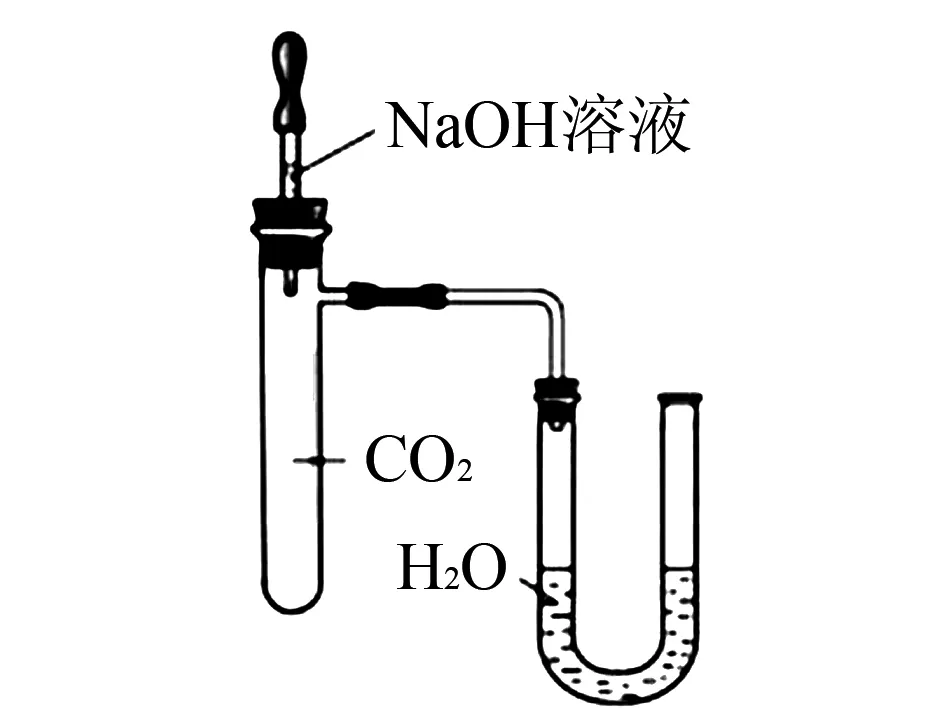
图1
实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面左高右低.据此,甲同学得出“CO2与NaOH发生了化学反应”的结论.
(2)U型管中液面高度发生变化的原因是____.
(3)上述结论的证据不充足,理由是____.
【实验3】按如图2所示装置进行实验.

图2
查阅资料:CaCl2溶液呈中性;

实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中.
(4)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是____.
(5)步骤④中,若观察到____(填现象),证明CO2与NaOH发生了化学反应.CO2与NaOH反应的化学方程式为____.
解析实验1是配制一定质量分数的氢氧化钠溶液,因而根据实验步骤称量(托盘天平);量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒),故不需要的是酒精灯.实验2是描述实验现象,即氢氧化钠与二氧化碳反应导致装置内压强减小,故U型管中右边液面下降;(3)二氧化碳能溶于水,且能与水反应,也能使装置内压强减小,也会使U型管中右边液面下降;(4)钙离子能与氢氧根离子结合生成的氢氧化钙微溶于水,也可能有沉淀产生,故步骤③“产生沉淀”的现象仍不足以证明氢氧化钠和二氧化碳发生了反应;(5)步骤④中,稀盐酸被吸入A中,故若观察到有气泡产生,说明二氧化碳与氢氧化钠发生了反应.

突破策略实验现象探究题的解答过程,一般是对常见物质性质熟悉的基础上,然后根据反应前后物质种类及成分变化提出假设,进而设计实验与分析实验现象,从而解答问题.
综上所述,探究性实验就是提出假设、设计实验、分析现象、得出结论的过程,因而需要对常见物质单质、氧化物、酸、碱、盐之间的转化关系要理解掌握,同时还需要对常见离子或物质的颜色、特性要记忆,进而顺利解答具体问题.
