PINK1通过磷酸化HDAC3对弥漫大B细胞淋巴瘤CD20表达的影响*
2021-11-24宋晶晶常韬李颖张诗彤
宋晶晶 常韬 李颖 张诗彤
(承德医学院第二附属医院,河北 承德 067000)
弥漫大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)属于非霍奇金淋巴瘤病理类型之一,若未进行及时有效地干预,患者病情进展迅速,其中位生存时间不超过12个月[1]。目前临床通常采用CHOP化疗手段对DLBCL患者进行干预,然而不同类型的患者5年生存率亦具有显著差异[2]。故深入探究DLBCL分型、分子机制及病因对研发新型靶向药物及改善患者预后具有重要意义。PTEN诱导激酶(PTEN-induced putative kinase 1,PINK1)在癌症及帕金森病中经常出现突变,其广泛表达于中枢神经系统、心脏、骨骼肌等器官组织,除此之外,亦可表达于细胞核[3-4]。既往研究显示,PINK1具有提高细胞生存率、抗凋亡及保护作用,这些生物学活性主要是通过线粒体及细胞质中的PINK1发挥作用[5]。组蛋白去乙酰化酶3(Histone deacetylase 3,HDAC3)主要表达于细胞核,其可在细胞核中发挥乙酰化功能并阻断DNA转录[6-7]。CD20可在大部分B细胞恶性肿瘤患者体内检测到,然而在不同类型患者体内差异明显[8],临床报道表明,CD20阴性DLBCL患者临床预后不良[9]。关于PINK1、HDAC3、CD20在弥漫大B细胞淋巴瘤中的研究报道较少,因此本次研究旨在探究PINK1通过磷酸化HDAC3对弥漫大B细胞淋巴瘤CD20表达的影响,现报告如下。
1 材料与方法
1.1 实验材料 DLBCL细胞系OCI-Ly7购于武汉维克赛思科技有限公司,将细胞系置于IMDM培养基(10%胎牛血清、1%请链霉素)中孵育然后放入恒温培养箱中,待其生长至一定密度,将其转移至新培养基进行传代。
1.2 试剂与仪器 试剂:IMDM培养基购于武汉益普生物科技有限公司;胎牛血清购于兰州荣晔生物科技有限责任公司;细胞裂解液购于北京伊塔生物科技有限公司;PVDF膜购于北京百奥莱博科技有限公司;ECL化学发光购于沈阳万类生物科技有限公司;抗PINK1、HDAC3、CD20抗体购于北京义翘神州科技股份有限公司。仪器:超净工作台购于上海辅泽商贸有限公司;细胞培养箱购于上海信裕生物科技有限公司;荧光显微镜购于广州科适特科学仪器有限公司;-80℃冰箱购于南京贝登医疗股份有限公司;酶标仪购于北京安麦格贸易有限公司;离心机购于德祥科技有限公司;制冰机购于上海净信实业发展有限公司。
1.3 方法 ①取部分OCI-Ly7细胞系随机分为对照组,sh-PINK1组、sh-Con组,对照组细胞不作任何处理,sh-PINK1组细胞予以PINK1敲低处理,sh-Con组作抑制对照。②提取细胞RNA及总蛋白,采用实时荧光定量PCR法检测各组细胞PINK1、CD20 mRNA蛋白表达水平。将RNA放入试剂盒内并置于冰上,取提前准备好的新EP管,做好标记后注入0.9mL Trizol,轻轻晃动使其混匀,然后放入离心机中以1500r/min速度离心20分钟,并转移至新EPP管中;将异丙醇注入EP管病震荡15秒,静置10分钟后再次转移至离心机中以1500r/min速度离心20分钟,弃上清液,然后将EPP管放于超净工作台,静置20分钟后进行琼脂糖凝胶电泳或置于超低温冰箱中保存。③采用western blot 检测各组细胞PINK1、CD20、HDAC3、p-HDAC3 Ser424蛋白表达水平。提取细胞总蛋白,采用BCA蛋白检测试剂盒对其浓度进行检测,并放入-20℃环境下保存。将蛋白取出置于冰上复温,复温后先进行30分钟电泳,然后进行90V恒牙电泳120分钟,经转至PVDF膜后置于摇床,并采用封闭液进行封闭,2小时后加一抗并于4℃环境下孵育过夜,次日取出经TBST洗膜后3次,每次5分钟,加二抗置于自然室温下孵育2小时,取出经TBST洗膜后3次,每次5分钟,然后进行显色及条带分析。分离sh-PINK1组、sh-Con组细胞质及细胞核,采用western blot 检测两组细胞质及细胞核中PINK1、p-HDAC3 Ser424、CD20蛋白表达水平。④取余下OCI-Ly7细胞系随机分为DMSO组、RGFP966组、Con组,Con组细胞不作处理,而RGFP966组细胞采用10μM HDAC3特异性抑制剂RGFP966处理24小时,DMSO组细胞作抑制剂对照。采用western blot 检测各组细胞CD20蛋白表达水平。
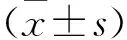
2 结果
2.1 PINK1对OCI-Ly7细胞CD20 mRNA及蛋白表达水平的影响 Sh-PINK1组细胞PINK1mRNA及蛋白表达水平显著低于对照组,CD20mRNA及蛋白表达水平显著高于对照组(P<0.05)。Sh-Con组细胞PINK1、CD20mRNA及蛋白表达水平与对照组相比差异无显著性(P>0.05),见表1、图1。
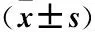
表1 各组OCI-Ly7细胞PINK1、CD20 mRNA表达水平比较

图1 各组OCI-Ly7细胞PINK1、CD20蛋白表达水平比较
2.2 PINK1对OCI-Ly7细胞HDAC3蛋白磷酸化的影响 Sh-PINK1组细胞p-HDAC3 Ser424蛋白表达水平显著低于对照组(P<0.05)。Sh-Con组细胞p-HDAC3 Ser424蛋白表达水平与对照组相比差异无显著性(P>0.05),见图2。

图2 各组OCI-Ly7细胞HDAC3、p-HDAC3 Ser424蛋白表达水平比较
2.3 PINK1低表达对PINK1、p-HDAC3 Ser424、CD20蛋白表达水平的影响 在细胞核中,sh-PINK1组PINK1、p-HDAC3 Ser424蛋白表达水平均低于对照组(P<0.05)。在细胞质中,sh-PINK1组CD20蛋白表达水平高于对照组(P<0.05),见图3。

图3 各组OCI-Ly7细胞质、细胞核中PINK1、p-HDAC3 Ser424、CD20蛋白表达水平比较
2.4 HDAC3特异性抑制剂对OCI-Ly7细胞CD20蛋白表达的影响 RGFP966组OCI-Ly7细胞CD20蛋白表达水平显著高于Con组(P<0.05)。Con组OCI-Ly7细胞CD20蛋白表达水平与DMSO组相比差异无显著性(P>0.05),见图4。
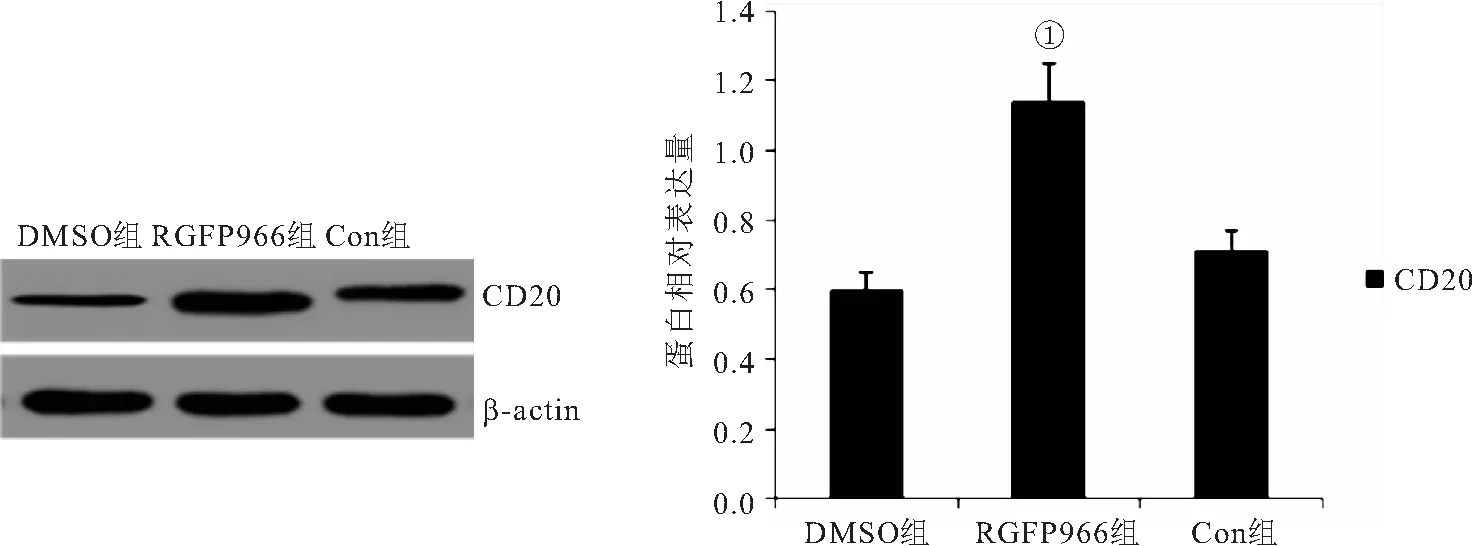
图4 各组OCI-Ly7细胞CD20蛋白表达水平比较
3 讨论
临床研究证实,导致DLBCL患者预后不同的原因与其肿瘤分期、病理类型等因素相关。此外,癌基因发生突变、蛋白功能或信号途径发生变化等亦可对其产生一定影响[10-11]。故探究诱发DLBCL起病及进展的关键基因极为重要。
有研究证实,PINK1具有识别及降解受损线粒体的能力,可发挥线粒体质量控制的作用[12]。但在神经退行性疾病及癌症中PINK1通常处于失调状态。CD20是目前临床治疗B细胞恶性肿瘤的靶向药物之一,临床实践显示,利妥昔单抗是一种人/鼠嵌合型抗CD20单克隆抗体,经其干预后大部分DLBCL患者临床预后极差[13]。临床研究显示,PINK1及CD20 mRNA在DLBCL中的表达呈显著负相关[14]。故我们推测,PINK1可能参与调控CD20在DLBCL细胞中的转录。本次研究我们首先对各组细胞系中PINK1及CD20 mRNA及蛋白表达水平进行检测,结果显示,Sh-PINK1组细胞PINK1mRNA及蛋白表达水平显著低于对照组,CD20mRNA及蛋白表达水平显著高于对照组。本研究结果证实,在DLBCL细胞系中,PINK1可通过参与调节CD20 mRNA转录进而达到调控CD20表达的目的。有报道显示,HDAC抑制剂具有促进CD20表达,其主要是通过CD20转录实现的。另有文献报道,在HDAC家族中,只有HDAC3可与PINK1相互作用,PINK1可促进HDAC3的Ser424位点活化及功能;此外,HDAC3通常在细胞核内发挥去乙酰化作用,最终达到阻断DNA转录的目的[15-16]。在本次研究中我们发现,Sh-PINK1组细胞p-HDAC3 Ser424蛋白表达水平显著低于对照组。我们将DLBCL细胞系质核分离,并对其中PINK1、p-HDAC3 Ser424蛋白表达水平进行检测,结果发现,在细胞核中,sh-PINK1组PINK1、p-HDAC3 Ser424蛋白表达水平均显著低于对照组;在细胞质中,sh-PINK1组CD20蛋白表达水平显著高于对照组。说明PINK1具有磷酸化细胞核内HDAC3 Ser424位点的作用,然而HDAC3通常表达于细胞核,故增强HDAC3磷酸化的可能是细胞核内的PINK1。HDAC抑制剂可阻断HDAC去乙酰化功能,其在加速CD20启动子核心组蛋白乙酰化的同时亦可提高转录因子Sp1结合的能力,进而加速CD20转录及蛋白表达[17-19]。临床报道显示,HDAC具有调节CD20转录的能力[20-22]。然而目前关于PINK3通过磷酸化HDAC3是否具有调控DLCL细胞CD20的能力还有待进一步研究。因此本研究采用HDAC3特异性抑制剂对DCBCL细胞进行干预,同时设置DMSO抑制剂对照组,并收集其蛋白对其中CD20蛋白表达水平进行检测,结果显示,RGFP966组OCI-Ly7细胞CD20蛋白表达水平显著高于Con组。说明HDAC3可作为调节CD20表达水平的关键蛋白。
4 结论
在弥漫大B细胞淋巴瘤中,细胞核PINK1可磷酸化HDAC3的Ser424位点进而激活HDAC3,最终达到转录抑制CD20表达的作用,而敲低PINK1表达或阻断HDAC3表达可显著促进CD20表达。
