氧糖剥夺对小鼠小胶质细胞NKG2D受体及其配体表达的影响*
2021-11-24刘琳李晶莹曹丽丽杜俊蓉
刘琳 李晶莹 曹丽丽 杜俊蓉
(1.四川大学华西药学院,四川 成都 610041;2.成都大学基础医学院,四川 成都 610106)
小胶质细胞是大脑神经系统的固有免疫细胞。在脑缺血发生后,小胶质细胞迅速向损伤部位迁移,通过释放炎性介质加重神经炎症,进一步加重缺血后的脑损伤[1-2]。大量研究表明,小胶质细胞的过度激活在脑缺血炎症反应中发挥关键作用[3-4]。但是,目前基于神经炎症的干预策略均未能实现临床转化。自然杀伤细胞活化受体(Natural killer group 2 member D,NKG2D)是C型凝集素样受体NKG2家族的重要成员,主要表达于NK 细胞、NKT 细胞、CD8+αβT 及部分γδ T等多种免疫细胞[5-6]。NKG2D可识别多种配体,这些配体属于主要组织相容性复合体I类分子相关蛋白(MHC-Ⅰ)以及另一类MHC-I类相关分子ULBP[7-8]。研究表明,NKG2D配体是参与各种炎症反应的应激诱导分子[9]。感染或炎症刺激上调NKG2D配体表达,与NKG2D结合后,通过接头蛋白DAP10传递活化信号,激活下游PI3K和GRB2进而引发免疫炎症反应[10-11]。但是,目前尚未见NKG2D与脑缺血后小胶质细胞炎症反应的相关性报道。氧葡萄糖剥夺(Oxygen-glucose deprivation,OGD)是体外诱导缺血性损伤的常用模型[12]。本实验通过建立小鼠海马HT22 神经元细胞OGD模型,进一步检测HT22-OGD上清刺激小鼠BV2小胶质细胞后NKG2D信号通路的变化和炎症反应,以探究NKG2D在脑缺血后小胶质细胞炎症反应中的潜在作用。
1 材料与方法
1.1 主要材料和仪器 小鼠海马神经元HT22细胞系、BV2小胶质细胞系(广州吉妮欧生物科技有限公司),DMEM培养基、Cell Counting Kit-8试剂(Wako),TNF-α小鼠ELISA 试剂盒(达科为生物技术有限公司)。iMark 酶标仪(Bio-Rad),BDS200 倒置生物显微镜(重庆奥特光学仪器有限责任公司),Micro Drop 超微量分光光度计(BIO-DL),LightCycler®96实时荧光定量PCR仪(Roche)。
1.2 方法
1.2.1 细胞OGD模型建立 HT22、BV2细胞常规培养于DMEM完全培养基,培养条件为5%CO2、37℃。HT22细胞弃原培养加入无糖DMEM培养基,95%N2 和 5%CO2、37℃条件培养19小时,复氧复糖24小时后收集HT22上清(OGD conditioned medium, OGD CM),正常条件下培养上清(Normal CM)作为对照组。将BV2细胞分为Model组和Control组,分别用 OGD CM和Normal CM进行刺激。HT22、BV2细胞分别接种于96孔板,经造模处理后,每孔加入10 μL CCK8 溶液,继续培养1小时后于450 nm波长处测定吸光度(OD)值,按公式计算细胞存活率:OD sample/OD control mean×100%。
1.2.2 ELISA法测定促炎因子含量 分别收集HT22神经元细胞的Normal CM和OGD CM刺激BV2细胞后的培养基上清,3500r/min 离心15分钟后收集上清,按照ELISA试剂盒说明书,检测TNF-α含量。
1.2.3 qPCR测定NKG2D受体信号通路及炎症产物的mRNA水平 采用Trizol试剂提取BV2细胞RNA,逆转录为cDNA后用于qPCR测定NKG2D、H60、MULT1、RAE-1、DAP10及炎症产物TNF-α的mRNA水平表达量,并归一化为GAPDH,使用 2-ΔΔCT方法来分析目的基因的 mRNA 相对表达水平。参照文献设计PCR引物序列[13-17],见表1。
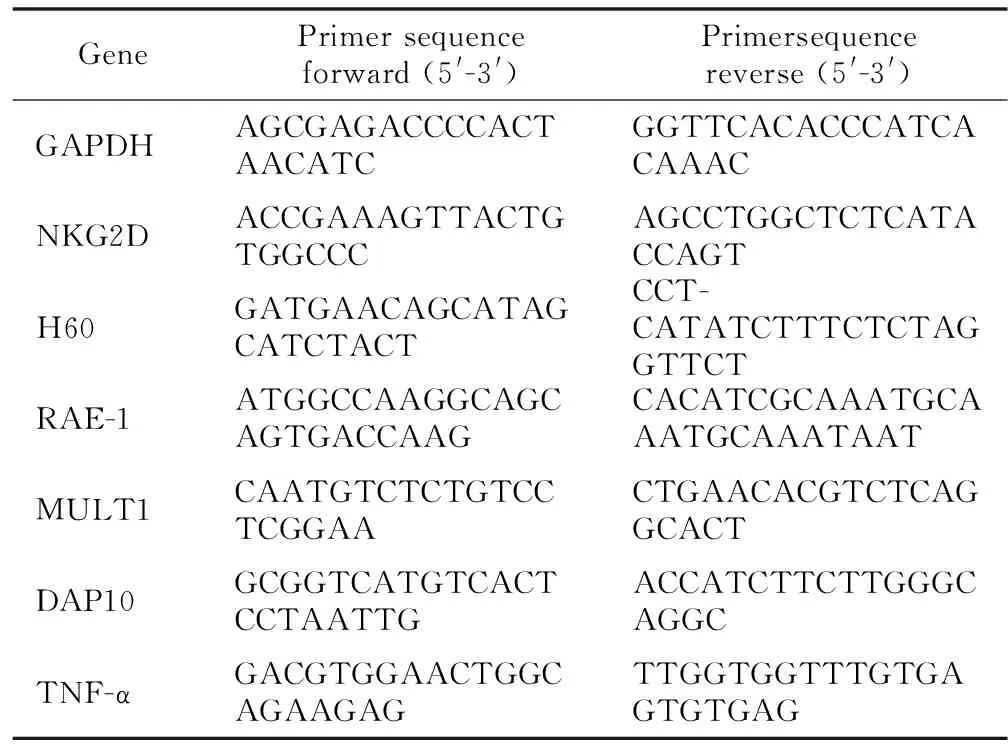
表1 定量PCR引物序列
2 结果
2.1 OGD对HT22以及OGD CM对BV2细胞活力的影响 与HT22-Control组相比,OGD 19小时后HT22-Model组细胞活力明显降低(P<0.01),表明氧糖剥夺对神经元细胞造成明显的损伤。与BV2-Control组相比,BV2-Model组细胞活力无明显变化(P>0.05),表明HT22 OGD CM不会对BV2小胶质细胞的活性造成影响,见图1。
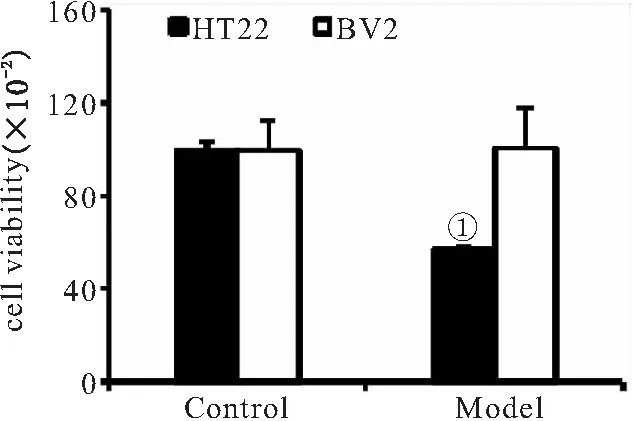
图1 OGD对HT22细胞以及OGD CM对BV2细胞活力的影响(n=6)
2.2 OGD CM诱导BV2细胞NKG2D受体信号通路表达 qPCR法检测OGD CM刺激BV2细胞后NKG2D信号通路的表达,相比BV2-Control组,BV2-Model组细胞NKG2D受体、配体H60以及接头蛋白DAP10 mRNA表达量明显上调(P<0.01);而配体MULT1和RAE-1的表达量无明显变化(P>0.05),见图2。
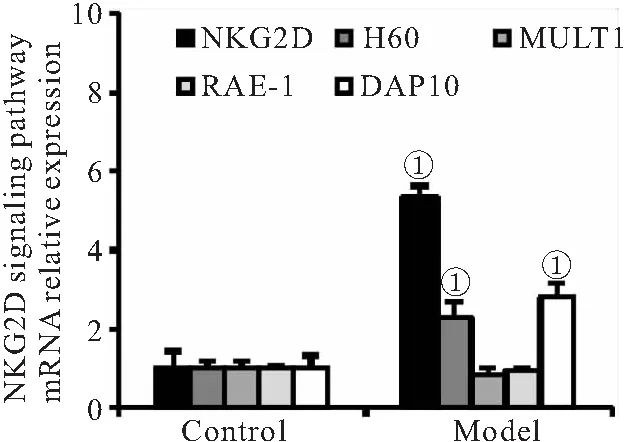
图2 OGD CM对BV2细胞NKG2D信号通路的影响(n=6)
2.3 OGD CM诱导BV2细胞炎症因子的生成 qPCR法检测OGD CM刺激BV2细胞后炎症因子的表达,相比BV2-Control组,BV2-Model组TNF-α的mRNA表达水平明显上调(P<0.01),见图3。
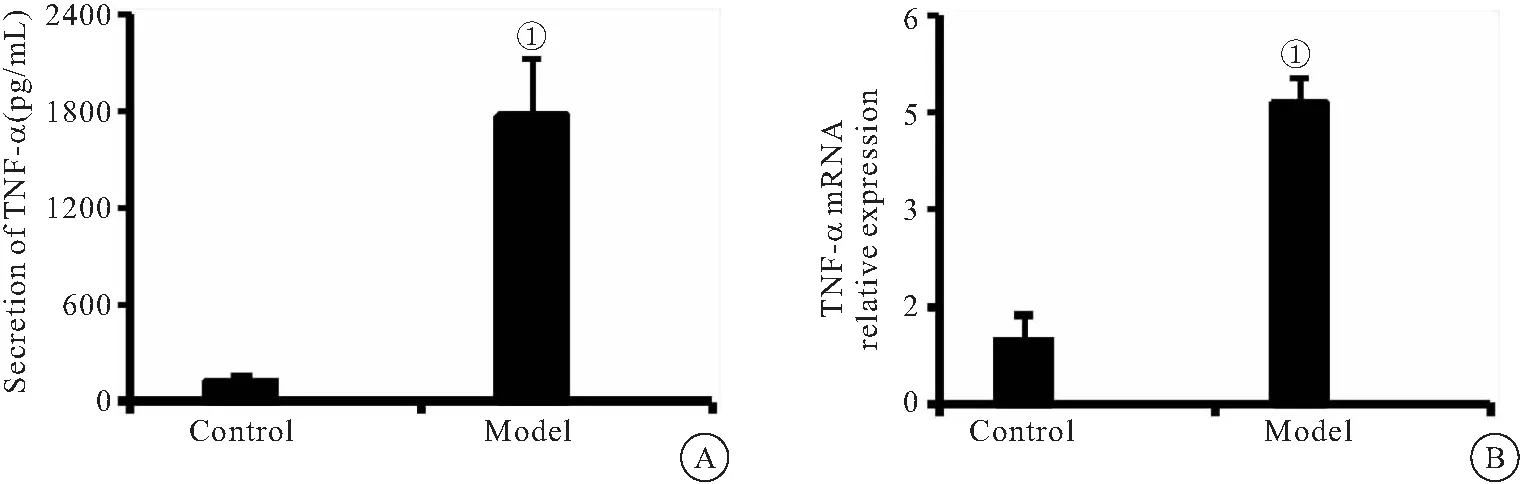
图3 OGD CM对BV2细胞炎症因子表达的影响(n=6)
3 讨论
脑卒中是世界范围内致死/致残的疾病之一,其中缺血性脑卒中占绝大部分。缺血性脑卒中病理机制复杂,其中神经炎症在缺血性脑卒中的发生发展过程中发挥重要作用。在缺血性脑卒中初期,脑中常驻的小胶质细胞被激活、外周免疫细胞向缺血脑组织浸润以及多种细胞因子(IL-6、TNF-α等)产生,从而引发神经炎症反应[18-20]。研究表明,抑制脑缺血后神经炎症的发生,不仅能有效减轻脑缺血损伤,还能改善其预后[21]。
本实验建立小鼠海马HT22神经元细胞OGD模型,收集HT22上清刺激BV2小胶质细胞,模拟体内脑缺血后小胶质细胞和神经元细胞的相互作用状态。结果显示,与HT22-Control组比较,HT22-Model组细胞活性显著降低,提示OGD造模成功。
NKG2D是一种免疫细胞表面的活性受体,可识别多种配体,研究发现小鼠NKG2D配体包括RAE-1、H60和MULT1[22]。NKG2D与其配体的相互作用是调节先天性免疫反应和适应性免疫反应的关键。在小鼠体内NKG2D主要通过PI3K/STAT5和Syk/ZAP70两条信号通路发挥效应[10,23]。当配体被识别时,含有NKG2D的NK细胞和T细胞被激活,从而导致靶细胞的裂解或是触发细胞因子和趋化因子(如干扰素-γ)的产生,以调节免疫炎症反应[24]。有研究报道,NKG2D可在多种器官缺血性损伤炎症反应中发挥重要作用。Calabrese等[26]发现激活NK细胞表面NKG2D可加重肺缺血再灌注损伤,而阻断NKG2D受体则可发挥保护作用。Feng等[26]报道,小鼠肾脏缺血再灌注可诱导NKG2D的配体RAE-1表达,从而激活NK细胞和CD8+T细胞、加重肾损伤。本实验通过建立体外OGD模型探究BV2细胞中NKG2D信号通路的表达,结果表明BV2-Model组细胞NKG2D受体、配体H60、下游接头蛋白DAP10的mRNA水平显著增加。脑缺血发生后,炎性细胞因子的表达显著增加。因此我们检测了BV2-Model组细胞培养上清中TNF-α的mRNA水平和蛋白水平,结果表明,TNF-α的mRNA水平和蛋白水平显著上调。
4 结论
氧糖剥夺能促进小胶质细胞H60/NKG2D/DAP10信号通路上调及炎症因子产生,提示NKG2D信号通路可能在氧糖剥夺的小胶质细胞炎症反应中发挥重要作用,但具体的机制有待进一步研究。
