夏秋茶大曲与传统中温大曲中微生物群落及多样性研究
2021-11-24潘天全陈兴杰杨金玉杜先锋
张 杰,程 伟,李 娜,潘天全,陈兴杰,杨金玉,杜先锋
(1.安徽金种子酒业股份有限公司,安徽阜阳236048; 2.安徽农业大学,安徽合肥238009)
中国白酒是世界上最古老的蒸馏酒之一,根据风味不同,白酒主要分为十二大类:浓香型、清香型和酱香型等[1-2]。其中浓香型白酒占白酒总量的70%,它是以高粱等谷物为原料,以酒曲为糖化发酵剂,经蒸煮、发酵、蒸馏等工艺制作而成[3]。在传统固态白酒的酿造过程中,微生物群落的多样性对白酒不同风格、产量及品质起到关键性作用[4]。大曲是一种富含酿酒所需要的菌系、酶系、物系的复合载体,具有“糖化、发酵、生香”等功能,是传统固态酿酒发酵的动力[5]。大曲中含有以霉菌和酵母菌为主的真菌以及较小的细菌,这些微生物菌落便是酒体风味品质形成的关键因素[6]。因此探究浓香型大曲培养过程中微生物群落组成和功能有助于解析大曲的风味信息,在大曲培养过程中调整培养条件,对提高大曲及浓香型白酒质量有深远意义[7]。
传统大曲微生物研究主要以各种微生物类型培养皿筛选,通过微生物群落形状特征、理化特征及菌落数目进行相关研究。大曲的研究多趋向于单一的风味或者微生物[8],近年来随着生物化学和分子生物技术的不断发展,研究者可以借助高通量测序技术,进一步分析大曲中微生物群落的多样性[9]。茶是世界上公认的健康饮料,夏秋茶在夏秋季节光照强、温度高的条件下生长速率快,导致其持嫩性差,茶叶易老化,其碳代谢程度较高,氮代谢程度相对较低,从而使得茶叶中多酚类物质较高,而芳香物质、维生素、氨基酸等含量低,质量明显低于春茶[10-11]。在大曲制作过程中,夏秋茶经粉碎后与曲料混合制成茶曲,多酚含量高的夏秋茶对曲块中的微生物具有选择性的影响,并产生特征性的生物化学反应,导致曲块微生物种类、生物酶类有显著特点[12]。
本研究通过高通量测序技术,分别对同一时间入房培养的传统中温大曲、茶曲以及它们在培养阶段的微生物群落结构多样性变化进行研究,得出两种大曲主要微生物群落构成,结合培养阶段环境条件记录,根据所需大曲要求更好地调控大曲培养条件,以期为白酒提质、增加健康因子提供理论依据。
1 材料与方法
1.1 材料、仪器
大曲取样:对安徽金种子生态酿酒基地培曲车间同一天入房传统中温大曲(以下简称中温大曲)、夏秋茶大曲茶曲(以下简称茶曲)进行取样,两种大曲培养时间均为27 d,分别取入房第1天、第3天、第5天、第7天、第12天、第17天、第22天、第27天曲样,所对应的样品名称分别为CHU1、CHU2、CHU3、CHU4、CHU5、CHU6、CHU7、CHU8(中温大曲),CHA1、CHA2、CHA3、CHA4、CHA5、CHA6、CHA7、CHA8(茶曲)。每次取样从固定的3个点(内、中、外)周边取并暂存于无菌塑封袋,带回微生物实验室并在无菌环境中进行粉碎,采用四分浓缩法留样保存于无菌袋中,存于-80℃冰箱中备用。
仪器设备:SW-CJ-2D型超净工作台,深圳市瑞鑫达化玻仪器有限公司;小型多功能粉碎机,永康市久品工贸有限公司;医用低温保存箱,安徽中科都菱商用电器股份有限公司。
1.2 试验方法
1.2.1 大曲微生物DNA提取及PCR扩增定量
采用CTAB或SDS方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。
以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物(Phusion®High-Fidelity PCR Master Mix with GC Buffer:New England Biolabs)和高效高保真酶进行PCR,确保扩增效率和准确性。
引物对应区域:16S V4区引物(515F和806R):鉴定细菌多样性。
ITS1区引物(ITS5-1737F和ITS2-2043R):鉴定真菌多样性。
1.2.2 PCR产物的混样和纯化
PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;对检测合格的PCR产物进行磁珠纯化,采用酶标定量,根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。
1.2.3 文库构建和上机测试
使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用Nova-Seq6000进行上机测序。
2 结果与分析
2.1 中温大曲、茶曲微生物聚类
2.1.1 花瓣图分析
根据聚类得到OTUs结果,分析不同样本之间共有、特有的OTUs,当样本数大于5时,绘制成花瓣图如图1。中温大曲在8个时间点所取样品共获得细菌OTU数目为220个,其中共有的细菌OTU为98个,茶曲共获得细菌OTU数目为303个,其中共有的细菌OTU为92个;中温大曲在8个时间点所取样品共获得真菌OTU数目为345个,其中共有的真菌OTU为32个,茶曲共获得真菌OTU数目为310个,其中共有的真菌OTU为23个。

图1 OTU分布花瓣图
2.1.2 物种分布情况分析
根据分类学分析结果,可以得知不同组样品在各类水平(界、门、纲、目、科、属、种)上的群落结构组成情况。根据群落柱形图,可以直观呈现两方面信息:(1)各样本在某一分类学水平上主要包括的微生物;(2)样本中各微生物的相对丰度(所占比重)[13]。如图2、图3分别为中温大曲、茶曲中细菌及真菌在属水平上各物种的丰度组成结构。

图2 中温大曲、茶曲在属水平上细菌物种丰度组成
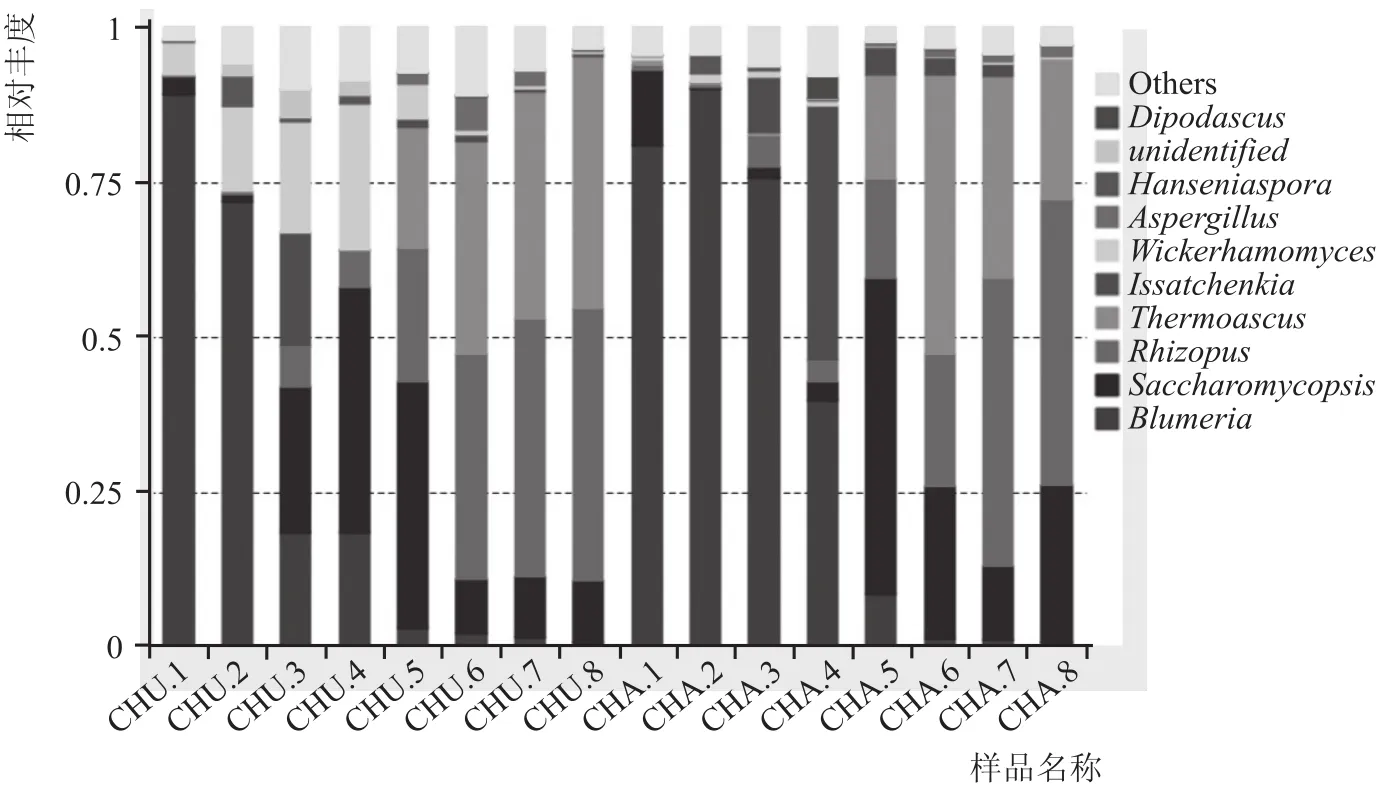
图3 中温大曲、茶曲在属水平上真菌物种丰度组成
本研究中,利用高通量测序方法从中温大曲、茶曲中共检测出266个菌属。从图2可以看出,从曲块入房刚开始就网罗了环境中的微生物资源,随着曲块培育时间的增加,曲块中微生物菌属也发生着一些变化。主要细菌属有Lactobacillus(乳杆菌属)、Pseudomonas(假单孢菌属)、Acetobacter(醋菌属)、Staphylococcus(葡萄球菌属)、Pantoea(泛菌属)、Kocuria(考克氏菌属)、Leuconostoc(明串珠菌属)、Brevibacterium(短杆菌属),其中Kocuria(考克氏菌属)在茶曲中属于主要菌属但在中温大曲中非主要菌属。在整个培曲过程中,Lactobacillus属于优势菌种,其含量一直大于10%;Pseudomonas在刚入房前2天属于优势菌种,且仅处于中温大曲时含量高于10%,但后期含量下降明显;Acetobacter随着曲块培养时间增加呈现出先增加后降低的趋势,中期8~10 d时含量最高,但在中温大曲中不属于优势菌种,在茶曲中含量大于10%属于优势菌种。由此可见,原料使用不同对大曲中细菌多样性存在影响,在不同的培曲时间下大曲中的优势菌种发生变化,但乳杆菌属一直属于优势菌属。陈申习等[14]采用传统分离方法和现代分子技术对清香型小曲白酒机械化生产中微生物动态变化进行了研究,发现酒醅微生物的细菌主要为乳杆菌属和芽孢杆菌属。
从图3可以看出,中温大曲、茶曲从入房到培养结束有8个真菌属相对丰度大于1%,分别为Blumeria(布氏白粉菌属)、Saccharomycopsis(扣囊复膜孢酵母属)、Rhizopus(根霉菌属)、Thermoascus(热子囊菌属)、Issatchenkia(伊萨酵母属)、Wickerhamomyces(异常威克汉姆酵母)、Aspergillus(曲霉菌属)、Hanseniaspora(西方有孢汉逊酵母),其中Blumeria、Saccharomycopsis、Rhizopus、Thermoascus、Issatchenkia、Wickerhamomyces相对丰度均大于10%,属于培曲过程中的优势菌种。研究表明,Blumeria在中温大曲及茶曲培养前期0~8 d含量最高,但随后下降明显且最终含量低于1%;Saccharomycopsis、Wickerhamomyces在中温大曲及茶曲培养阶段呈现出先上升后下降的趋势;Issatchenkia在中温大曲及茶曲中初始含量均为零,在中期6~8 d时含量增加到10%以上,但后期含量明显降低且低于1%;Rhizopus、Thermoascus在中温大曲及茶曲培养过程中呈现出逐渐增加的趋势,且最终成为主导菌种。值得一提的是,Saccharomycopsis在中温大曲中最终含量为12.12%,茶曲中最终含量为25.31%,差异明显。由此可见,大曲中茶叶的添加对真菌优势菌种的分布有一定的影响,在不同的培曲时间下中温大曲及茶曲中的优势菌种变化明显。雷振河[15]应用高通量测序技术对清香型白酒酿造用大曲和酒醅中微生物构成进行了分析,发现大曲中优势真核微生物主要包括曲霉菌属、热子囊菌属、根霉菌属、嗜热真菌属、假丝酵母属,其中本研究中曲霉菌属、热子囊菌属、根霉菌属与其结果相似,存在差异可能是环境、原料、工艺等因素造成的[16]。
2.2 Alpha多样性分析
2.2.1 微生物多样性指数分析
使用Illumian MiSeq高通量测序技术分别对8个中温大曲、8个茶曲样品中微生物多样性进行分析,其细菌16S rRNA测序结果及多样性见表1,真菌ITS测序结果及多样性见表2。Observed_species:直观观测到的物种数目(也即是OTUs数目)。Shannon:样品中的分类总数及其占比。群落多样性越高,物种分布越均匀,Shannon指数越大。Simpson:表征群落内物种分布的多样性和均匀度。Chao1:估计群落样品中包含的物种总数。ACE:估计群落中OTU数目。Goods_coverage:测序深度指数。PD_whole_tree:群落内物种的亲缘关系。
如表1所示,中温大曲中CHU7细菌丰富度最高,茶曲中CHA8细菌丰富度最高,中温大曲中CHU8细菌多样性最高,茶曲中CHA7细菌多样性最高。如表2所示,中温大曲中CHU6真菌丰富度最高,茶曲中CHA1真菌丰富度最高,中温大曲中CHU3真菌多样性最高,茶曲中CHA4真菌多样性最高。

表1 中温大曲、茶曲细菌多样性指数
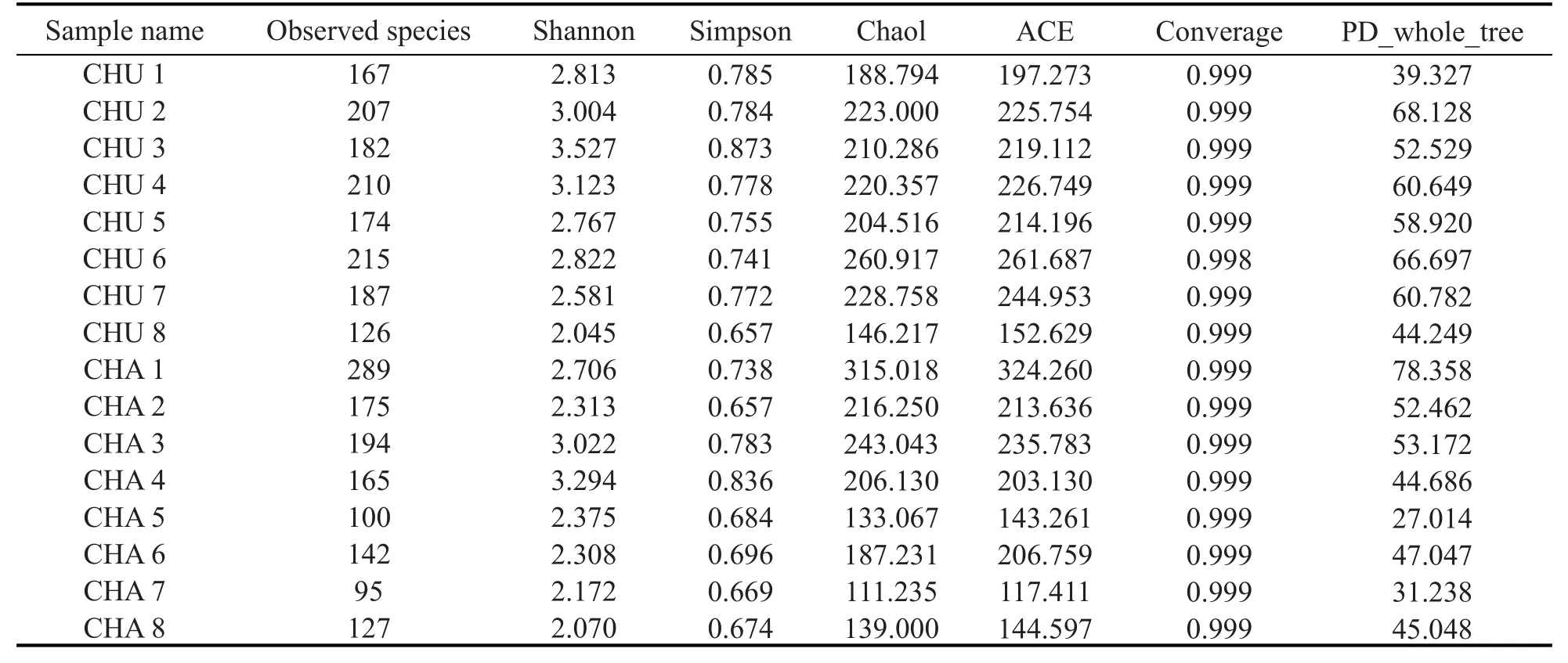
表2 中温大曲、茶曲真菌多样性指数
2.2.2 稀疏曲线和等级聚类曲线分析
稀释曲线是从样本中随机抽取一定测序量的数据,统计它们所代表物种数目(即OTUs数目),以抽取的测序数据量与对应的物种数来构建曲线。稀释曲线可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度,当曲线趋向平坦时,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种(OTUs)。如图4所示,中温大曲、茶曲的细菌和真菌稀释曲线都随测序深度的增加呈现先增加后平缓的趋势,这表明细菌、真菌的测序量合理,能够反映出样品中的微生物信息。
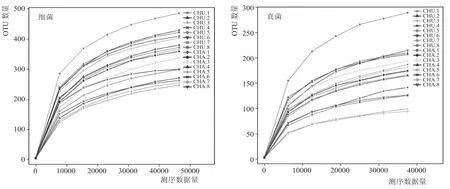
图4 细菌、真菌稀释曲线分析图
等级聚类曲线是将样本中的OTUs按相对丰度(或者包含的序列数目)由大到小排序得到对应的排序编号,再以OTUs的排序编号为横坐标,OTUs中的相对丰度(也可用该等级OTU中序列数的相对百分含量)为纵坐标,将这些点用折线连接,即绘制得到Rank Abundance曲线,它可直观的反映样本中物种的丰富度和均匀度。在水平方向上,物种的丰富度由曲线的宽度来反映,物种的丰富度越高,曲线在横轴上的跨度越大;在垂直方向上,曲线的平滑程度,反映了样本中物种的均匀程度,曲线越平缓,物种分布越均匀[17]。如图5所示,各样品细菌、真菌等级聚类曲线均趋向平缓,说明各样品细菌、真菌的测序数据物种组成的均匀度高,细菌微生物多样性丰度及均匀度高于真菌。

图5 细菌、真菌等级聚类曲线分析图
2.3 Beta多样性
2.3.1 NMDS分析
无度量多维标定法(NMDS,Non-Metric Multi-Dimensional Scaling)[18]统计是一种适用于生态学研究的排序方法。NMDS是基于Bray-Curtis距离来进行分析的非线性模型,根据样本中包含的物种信息,以点的形式反映在二维平面上,克服了线性模型(包括PCA、PCoA)的缺点,更好地反映生态学数据的非线性结构[19]。应用NMDS分析,根据样本中包含的物种信息,以点的形式反映在多维空间上,而对不同样本间的差异程度,则是通过点与点间的距离体现,能够反映样本的组间和组内差异等。
在NMDS分析中stress值大小体现了分析结果的优劣性,如图6所示stress值<0.001,NMDS分析图可被认为一个好结果的差异性排序。其中CHU1、CHU2、CHU3、CHU4、CHU5 聚 为 一 类 ,CHA1、CHA2、CHA3、CHA4、CHA5聚为一类,可以看出中温大曲与茶曲在培养前期细菌多样性区别明显,这与细菌前中期多样性分布分析结果相似,说明在大曲中添加茶叶对曲块培养前中期的细菌多样性影响明显,可能是前中期茶叶的添加影响了曲块水分含量、水分散失速度、pH值等,使茶曲升温较慢,因此对细菌微生物菌落差异影响较大。CHU6、CHU7、CHU8、CHA7、CHA8聚为一类,可以看出传统大曲与茶曲在培养后期细菌多样性区别较小,曲块各项理化指标也基本相同,对细菌的生长代谢影响小,因此后期中温大曲与茶曲细菌生态结构之间不存在明显差异。CHA6单独聚为一类,推测可能与翻曲过程中工艺操作差异性有关,需进一步研究分析。
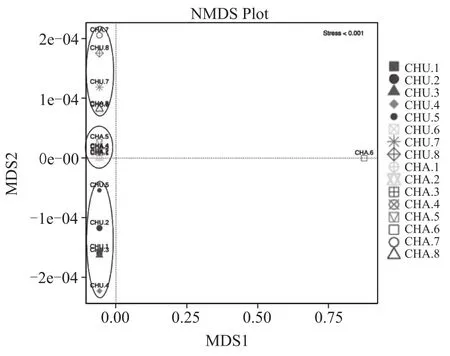
图6 中温大曲、茶曲细菌生态结构中属水平上的NMDS分析
如图7所示,在属类水平上stress值为0.149,而当stress<0.2时,可用NMDS二维点图表示,其图形更能说明分析数据所体现出的意义。其中CHU1、CHU2、CHU3、CHU4 聚为一类,CHA1、CHA2、HCA3、HCA4、CHA5 聚为一类 ,CHU5、CHU6、CHU7 聚为一类,CHA6、CHA7、CHA8、CHU8聚为一类,可以看出中温大曲、茶曲在培养过程中真菌差异性明显,说明原料不同对曲块前中期真菌微生物多样性影响较大,可能是茶叶的添加影响了曲块中水分含量、曲块透气性、pH值等理化因素,从而使曲块在培养前中期升温差异较大,因而影响曲块中真菌微生物多样性。其中CHU8与茶曲聚为一类,推测可能与环境因素有关,需进一步研究分析。
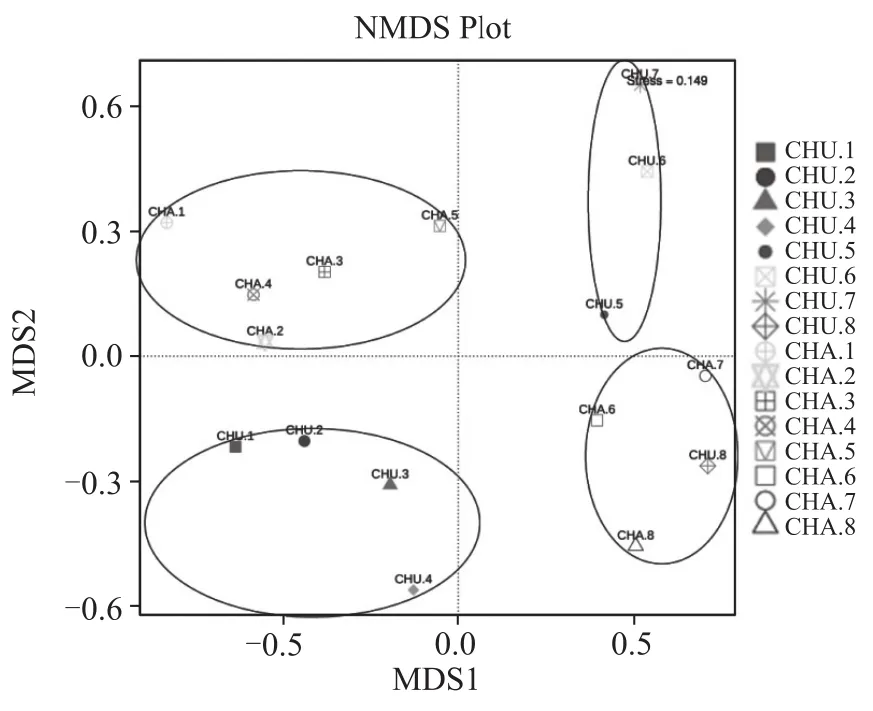
图7 中温大曲、茶曲真菌生态结构中属水平上的NMDS分析
2.3.2 聚类树分析
对中温大曲、茶曲样品中微生物OTUs信息进行加权聚类分析[20-21],结果见图8、图9。由图8可知,中温大曲及茶曲中细菌优质序列中可以归类为9个门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、类杆菌门(Bacteroidota)、蓝藻门(Cyanobacteria)、绿弯菌门(Chloroflexi)、脱硫菌门(Desulfobacterota)、弯曲杆菌门(Campilobacterota)、脱铁杆菌门(Deferribacteres)。其中厚壁菌门、变形菌门、类杆菌门和放线菌门占比较大,分别为40.44%、20.94%、14.50%、12.13%,另外,4种菌门中,中温大曲中的厚壁菌门占比较多,茶曲中变形菌门、类杆菌门和放线菌占比较多。厚壁菌门为大曲中的优势微生物,可能是优势细菌属属于该门,且厚壁菌门主要由芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)等微生物组成[22],具有很强的环境适应性,能够在相对极端的条件下保持生长代谢;放线菌广泛分布于土壤环境、海洋环境、植物体及其他极端自然生态环境中,与厚壁菌门相似,也具有极强的耐受性[23]。

图8 中温大曲、茶曲细菌生态结构中门水平上的聚类树分析
由图9可知,中温大曲及茶曲中真菌优质序列中可以归类为10个门,分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)、油壶菌门(Olpidiomycota)、无孢子菌门(Aphelidiomycota)、捕虫霉门(Zoopagomycota)。其中子囊菌门、毛霉门、担子菌门占比比较大,分别为66.44%、5.19%、4.19%,3种菌门中,中温大曲中担子菌门占比较多,茶曲中子囊菌门、毛霉门占比丰富。子囊菌门是曲皮和曲心中的唯一优势菌门,也是中温大曲中的优势真菌菌门。
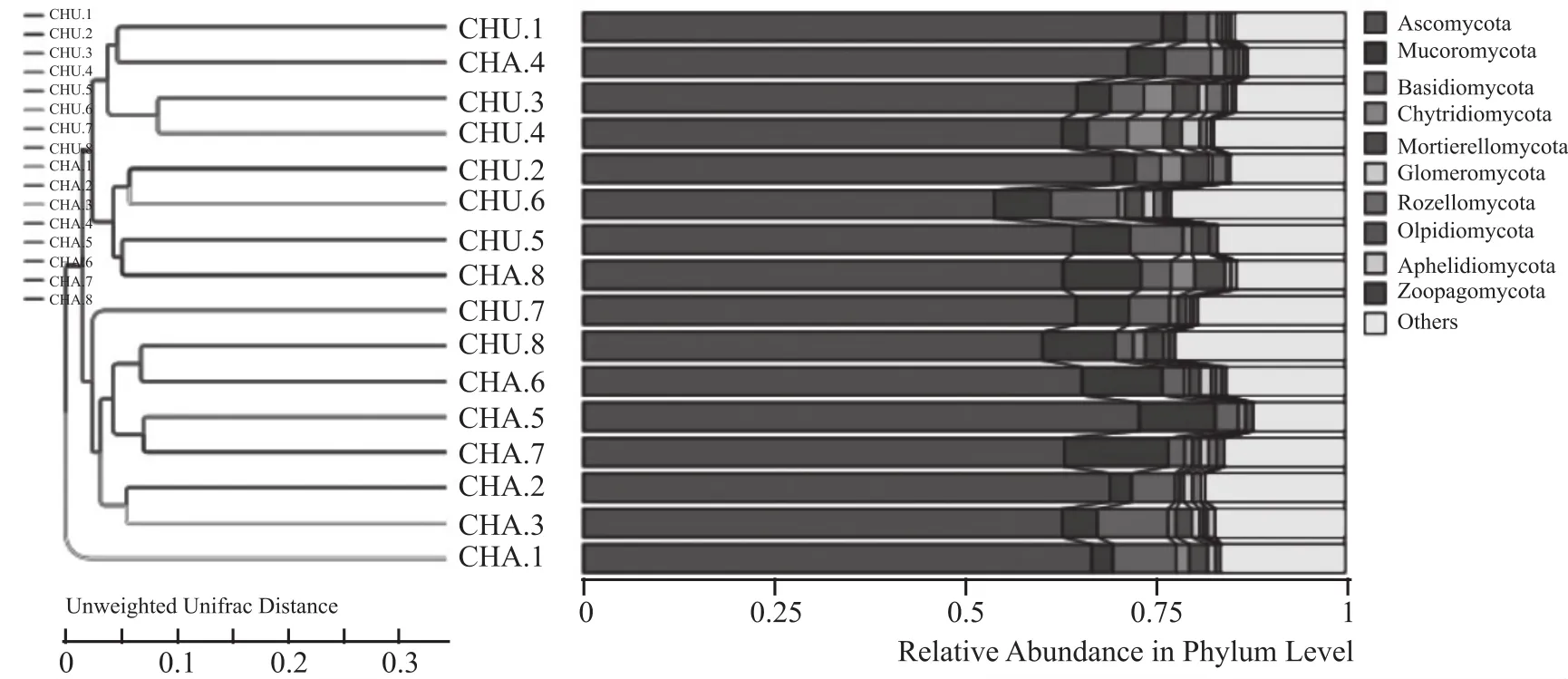
图9 中温大曲、茶曲真菌生态结构中门水平上的聚类树分析
3 结论
大曲是白酒酿造过程中微生物的主要来源,大曲微生物的群落结构的组成往往影响着白酒的品质。本研究利用高通量测序技术,分别对同一时间入房培养的中温大曲、茶曲以及它们在培养阶段的微生物群落结构多样性变化进行研究,得出两种大曲主要微生物群落构成。结果表明:(1)中温大曲细菌OTU数目为220个,茶曲细菌OTU数目为303个;中温大曲真菌OTU数目为345个,茶曲真菌OTU数目为310个,中温大曲中真菌OTU数目占优势,茶曲中细菌OTU数目占优势;(2)大曲中优势细菌菌属分别为乳杆菌属、假单孢菌属、醋菌属、葡萄球菌属、泛菌属、考克氏菌属、明串珠菌属、短杆菌属,其中考克氏菌属仅在茶曲中属于主要菌属;大曲中优势真菌菌属分别为布氏白粉菌属、扣囊复膜孢酵母属、根霉菌属、热子囊菌属、伊萨酵母属、异常威克汉姆酵母、曲霉菌属、西方有孢汉逊酵母,各菌属在中温大曲、茶曲中含量差异较大;由此可见,原料中添加茶叶对曲块细菌、真菌多样性影响明显;(3)在培曲过程中,随着培育时间的增加,中温大曲与茶曲中的乳杆菌属(Lactobacillus)在整个培曲过程中都属于优势菌属,而其他菌属受环境因素影响明显;(4)NMDS多样性分析结果表明,曲块中添加茶叶对细菌前期多样性影响明显,但对后期多样性影响较小,对于真菌而言,前后期多样性影响均明显。
从曲块原料配制到曲块入房培养的过程都是微生物选择、富集的过程,因此对大曲微生物群落的构成,不同原料对大曲微生物多样性影响,培养过程中微生物多样性变化等研究,将有助于从生物学角度为制曲工艺的调整、优化提供科学依据。
