miR-122a对肝癌细胞HepG2化疗药物敏感性的影响及其机制研究*
2021-11-24郝晓娜朱茂信闵思敏薛晓宇张英杰
郝晓娜,朱茂信,刘 微,闵思敏,薛晓宇,张英杰
(蚌埠医学院检验医学院,安徽蚌埠 233030)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的威胁人类健康的恶性肿瘤,我国是受其危害最严重的国家之一,发病率和死亡率约占全球的50.0 %[1]。肝癌以手术治疗为主,放射治疗和化学药物治疗为辅。但对于术后、晚期肝癌和复发患者,化疗仍是肝癌治疗的重要手段之一。目前,临床上常用的药物有顺铂、5-氟尿嘧啶、丝裂霉素等,但有部分患者在治疗中会出现耐药现象。如何降低肝癌细胞对化疗药物的耐药、提高化疗疗效是我们目前亟待解决的问题。miRNA是一类内源性的非编码单链RNA,长度约19~25个核苷酸。随着对miRNA研究的深入,发现miR-122具有肝脏特异性,成年个体肝脏中总miRNA的70.0 %是miR-122[2]。研究发现,miR-122在肝癌的发生、发展中起者重要作用,其在肝细胞癌组织中表达显著下调[3-5]。因此,本研究旨在观察过表达miR-122的肝癌细胞株HepG2对化疗药物的敏感性,并阐明部分机制,为肝癌的发病机制研究和治疗方法提供新思路和实验基础。
1 材料与方法
1.1实验材料 细胞株为人肝癌细胞系HepG2,由蚌埠医学院检验医学院实验中心保存备用。主要试剂包括DMEM培养液(Invitrogen 公司),10.0 %胎牛血清(杭州四季青),胰蛋白酶(宝泰克生物技术有限公司),PBS缓冲液(自制),过表达miR-122和绿色荧光蛋白(GFP)基因的慢病毒(human miR-122a Virus)及空载病毒(LV3-NC Virus),由上海吉玛基因化学技术有限公司合成,逆转录PCR试剂盒、real-time PCR试剂盒购于大连TaKaRa公司,Annexin V-PE/7-AAD凋亡流式试剂盒(Solarbio)、Bcl-2和p53单抗(Bioworld Technology)。
1.2方法
1.2.1LV3-human miRNA-122a mimics慢病毒过表达载体的制备 根据Pubmed提供的人miR-122a基因序列筛选和构建LV3-human miRNA-122a质粒,所得质粒用EcoRI进行单酶切鉴定并进行测序,证实miR-122a慢病毒过表达载体过表达成功后进行慢病毒大规模包装与滴定,从而成功制备绿色荧光蛋白(GFP)基因和过表达miR-122a的慢病毒(human miR-122a Virus)及空载病毒(LV3-NC Virus)。
1.2.2过表达miR-122a-HepG2体系的建立 按照吉玛基因重组慢病毒操作手册,选取不同的病毒感染复数(MOI值)1、20、50、100进行感染预实验,荧光显微镜下观察感染效率,最终MOI值为20。将一定数量的状态良好的HepG2接种于24孔板,37 ℃培养箱中过夜后按照产品说明书进行感染操作:加入慢病毒或空病毒感染细胞,37 ℃培养箱中培养;24 h后吸去病毒稀释液,换入500 μL新鲜培养基,37 ℃培养箱中培养;48 h后通过荧光显微镜观察慢病毒转染情况。
1.2.3实验分组 本实验分3个组:肿瘤细胞组(HepG2细胞)、空载病毒组(空载病毒转染HepG2细胞)、miR-122a肿瘤细胞组(过表达miR-122a的HepG2细胞)。
1.2.4HepG2中miR-122a表达水平的检测 HepG2细胞提取总RNA,按RT-PCR试剂盒说明书操作反转录成cDNA,从miRNA库中查找miR-122a的序列,设计并合成引物(表1),在PCR反应板中按说明书加入各试剂进行Real-time PCR反应。所得结果利用2-ΔΔCT方法计算mRNA的相对表达量。

表1 引物序列表
1.2.5细胞存活率的检测 (1)不同浓度的顺铂对HepG2细胞存活率影响:HepG2细胞接种于96孔板(5 000个/孔),分别加入不同浓度顺铂,使终浓度为1.5 μg/mL、3 μg/mL、5 μg/mL、10 μg/mL,24 h后细胞增殖-毒性实验(CCK-8实验),测定每孔的吸光度,并计数HepG2细胞的存活率,细胞的存活率=(药物组A值/对照组A值)×100 %,并选取合适的浓度做后续实验。(2)miR-122a上调对HepG2细胞存活率的影响:肿瘤细胞组和miR-122a肿瘤细胞组的细胞接种于96孔板(5 000个/孔),加入终浓度为1.5 μg/mL和3 μg/mL的顺铂,24 h后细胞增殖-毒性实验(CCK-8实验),测定每孔的吸光度,并计数HepG2细胞的存活率。
1.2.6miR-122a上调对HepG2细胞凋亡率的影响 肿瘤细胞组和miR-122a肿瘤细胞组的细胞接种于6孔板中,加入终浓度为1.5 μg/mL和3 μg/mL的顺铂,24 h后Annexin V-PE/7-AAD双染法分别检查两组细胞的凋亡率,并进行比较,并挑选本实验最佳药物浓度。
1.2.7Western blot法检测Bcl-2和P53蛋白 收集3 μg/mL的顺铂作用前后的肿瘤细胞组和miR-122a肿瘤细胞组的细胞,加入150 μL蛋白裂解液裂解30 min,再经4 ℃、12 000 r/min离心10 min,取上清,BCA法蛋白定量。加入上样缓冲液,重组15 min。每孔加入20 μL总蛋白上样,进行SDS-PAGE(8.0 %分离胶,5.0 %浓缩胶)电泳,电压90 V,待溴酚蓝电泳达凝胶底部时将凝胶中的蛋白质湿转至硝酸纤维素膜(PVDF)上。采用丽春红S染膜、考马斯亮蓝染胶,通过与蛋白Marker比较,确定目的条带位置。再将PVDF膜置于含5.0 %脱脂奶粉的TBST中,室温下摇床轻摇2 h进行封闭。加入大鼠抗bcl-2(1∶500)和P53(1∶500)单抗,4 ℃孵育过夜,继以相匹配的辣根过氧化物酶结合的二抗(1∶1 000)室温孵育1 h,TBST充分洗膜。ECL显色,暗室曝光,凝胶成像系统扫描成像。进行组间比较,探究miR-122a上调对提高HepG2细胞对顺铂敏感性的分子机制。

2 结果
2.1POP慢病毒过表达载体的构建及慢病毒包装 筛选和构建慢病毒miR-122a过表达质粒,所得质粒用EcoRI进行单酶切鉴定,酶切结果表明,被EcoRI切开的可能是阳性克隆(图1A)。将克隆进行测序鉴定、测序验证(图1B)后,进行慢病毒包装与滴定。
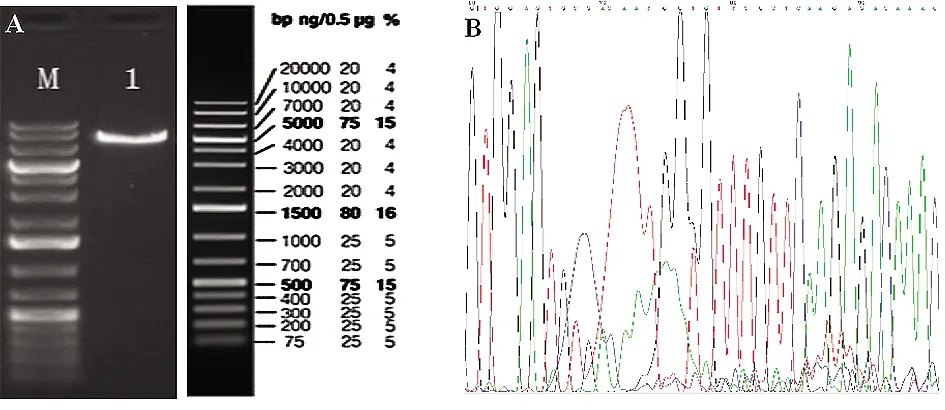
图1 miR-122a过表达载体鉴定
2.2过表达miR-122a-HepG2体系的建立 转染24 h后荧光显微镜可观察到过表达miR-122a慢病毒组和空载病毒体组的HepG2中有GFP表达,48 h后表达量最高(图2),之后随着细胞凋亡增加表达率降低。

图2 过表达miR-122a慢病毒转染HepG2情况(×100)
2.3RT-PCR检测转染后目的基因表达 转染48 h后,荧光显微镜下观察慢病毒转染情况,确定带有荧光后,各组的HepG2,提取总RNA,RT-PCR检测miR-122a表达情况显示,如图3所示:转染miR-122a mimic后可增加肝癌HepG2细胞内miR-122a的表达水平为正常HepG2组和空病毒组的15~16倍(P<0.0001)。

图3 各组HepG2细胞miR-122a相对表达量
2.4不同浓度的顺铂对HepG2细胞存活率的影响 我们选取了5个浓度梯度的顺铂,采用细胞增殖-毒性实验(CCK-8实验)明确顺铂对HepG2细胞增殖抑制的情况。结果显示,当顺铂浓度大于3 μg/mL时(存活率79.21±1.87 %),HepG2细胞增殖开始明显下降,与1.5 μg/mL顺铂组(存活率97.32±1.45 %)和5 μg/mL顺铂组(存活率51.54±3.46 %)比较差异有统计学意义(P<0.05),图4。为了明确过表达miR-122是否可提高HepG2对化疗药物的敏感性,我们选择低浓度顺铂即1.5 μg/mL和3 μg/mL进行后续实验。

图4 不同浓度的顺铂HepG2细胞存活率
2.5miR-122a上调对HepG2细胞存活率的影响 CCK-8实验所示:相同浓度的顺铂1.5 μg/mL和3 μg/mL,miR-122a肿瘤细胞组细胞的存活率[(95.31±2.02)%和(71.56±3.44)%]低于肿瘤细胞组细胞的存活率[(97.32±1.45)%和(79.21±1.87)%](P<0.05),提示过表达miR-122a可提高HepG2对化疗药物的敏感性。见图5。

图5 相同浓度的顺铂miR-122a过表达对HepG2细胞存活率的影响
2.6miR-122a上调对HepG2细胞凋亡率的影响 流式细胞术检测细胞凋亡实验发现:当顺铂1.5 μg/mL时,肿瘤细胞组24 h细胞的凋亡率为(4.86±0.34)%(图6A),miR-122a肿瘤细胞组24 h凋亡率(8.02±0.24)%(图6B);当顺铂3 μg/mL时,肿瘤细胞组24 h细胞的凋亡率为(34.23±3.56)%(图6C),miR-122a肿瘤细胞组24 h凋亡率(41.98±4.21)%(图6D)。提示过表达miR-122a后能明显提高HepG2在顺铂溶液中的凋亡率(P<0.05),且顺铂浓度3 μg/mL更明显。
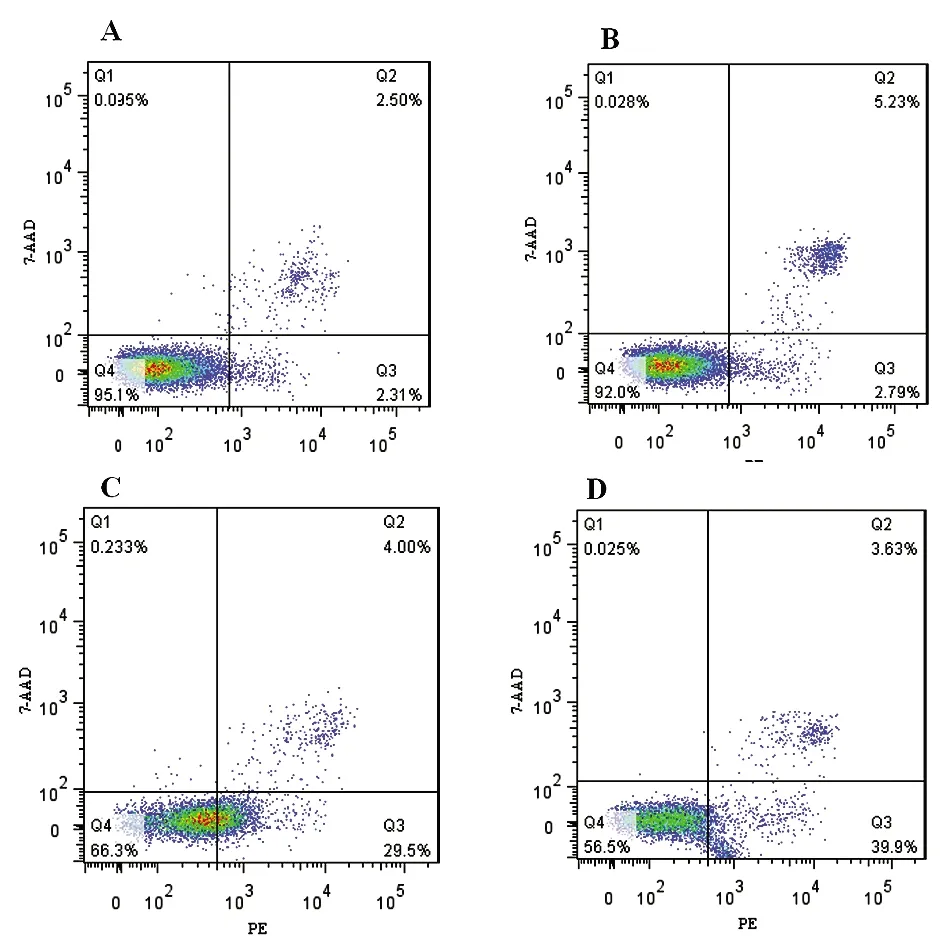
图6 流式细胞术检测细胞凋亡率
2.7Western blot法检测Bcl-2和P53蛋白 肿瘤细胞组和miR-122a肿瘤细胞组的细胞,置于顺铂浓度3 μg/mL的培养环境中,培24 h后,Western blot分析各组细胞bcl-2和p53蛋白的表达情况(图7A和图7B)。miR-122a肿瘤细胞组bcl-2吸光度比值为(0.324±0.043),与肿瘤细胞组bcl-2吸光度比值(0.762±0.132)比较差异有统计学意义(P<0.05);miR-122a肿瘤细胞组P53吸光度比值为(0.892±0.153),与肿瘤细胞组p53吸光度比值(0.82±0.085)比较差异有统计学意义(P<0.05)。
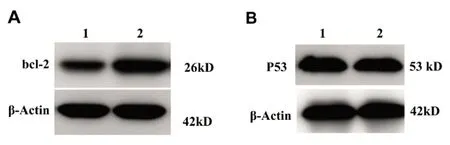
图7A 各组细胞bcl-2蛋白的表达 图7B 各组细胞P53蛋白的表达
3 讨论
肝癌是严重威胁我国人民健康的恶性肺瘤之一,其发病率及死亡率呈现逐年上升的趋势。尽管肝癌手术切除的技巧及方法不断进步,不断有肝癌靶向治疗药物问世,但肝癌的总体疗效仍难以令人满意。
近年来研究发现,人类有超过60.0 %的蛋白编码基因受miRNA的选择性调控[6]。miRNAs与肿瘤相关性的研究已成为近年来肿瘤研究领域中的一个热点,大约50.0 %得到注解的miRNAs在基因组上定位于与肿瘤相关的脆性位点(fragile site)。这说明miRNAs在肿瘤发生过程中起至关重要的作用,这些miRNAs所起的作用类似于抑癌基因和癌基因的功能,具有特异性的肿瘤组织表达谱。随着对miRNA研究的深入,发现许多miRNA在HCC的形成和发展过程中发挥重要的作用,并找到多个治疗靶点[7-9]。多项研究表明,miR-122与HCC的发生发展关系密切[10],它具有肝脏特异性,在每个正常肝细胞中有约66 000个拷贝,是肝脏中最丰富的miRNA,占肝脏miRNA总量的70.0 %,其在肝细胞癌组织中表达下调[11],并证实miR-122在肝癌的发生发展过程中有重要作用[12-13]。
因此,本实验通过慢病毒构建miR-122a过表达HepG2细胞系,并将其置于低浓度顺铂培养体系中,来观察细胞的增殖是否被抑制,细胞是否更易凋亡,探讨是否过表达miR-122a能够提高HepG2细胞对化疗药物的敏感性。CCK-8实验结果显示,顺铂浓度1.5 μg/mL和3 μg/mL时,miR-122a肿瘤细胞组细胞的存活率低于肿瘤细胞组细胞的存活率,提示过表达miR-122a能明显提高低药物浓度时HepG2细胞对化疗药物的敏感性。Annexin V-PE/7-AAD检查细胞的凋亡显示,miR-122a转染后凋亡率的升高,说明miR-122a能有效的促进细胞的凋亡。这提示miR-122a在肝癌中可能发挥着抑癌基因的作用。
为了进步探究miR-122a促进细胞的凋亡的分子机制,我们首先选择了bcl-2基因。bcl-2是迄今为止研究最明确的细胞凋亡拮抗基因,多项研究证实其高表达可抑制多种细胞凋亡从而参与多种肿瘤的发生,本实验的结果显现,在低浓度顺铂溶液中,miR-122a肿瘤细胞组bcl-2表达量低于肿瘤细胞组,提示过表达miR-122a可促进HepG2细胞凋亡,提高其对化疗药物顺铂的敏感性。我们又选择了p53基因,p53是最重要的肿瘤抑制因子之一,其表达的降低与功能的缺失在肝癌的形成及发展中都有十分重要的作用,化疗药物治疗肿瘤的机理之一就是通过p53依赖途径而诱导细胞凋亡实现的。若p53基因失活或缺失,则其诱导的凋亡途径不能进行,化疗药物依赖p53诱导的细胞凋亡也不能进行,肿瘤细胞则会对化疗药物不再敏感[14]。本实验研究结果显示,miR-122a肿瘤细胞组P53表达量高于肿瘤细胞组,提示过表达miR-122a可通过提高p53表达,抑制肿瘤细胞耐药。
综上所述,过表达miR-122a可提高HepG2细胞对化疗药物顺铂的敏感性,为肝癌患者提供基因治疗和降低肿瘤细胞耐药提供了理论和实验基础。但增强化疗药物敏感性的机制有待进一步探讨,且在临床实践中的疗效及安全性需进一步证实。
