苦豆子总碱对小鼠急性酒精性肝损伤的保护作用*
2021-11-24邬国栋董佳妮谢华祎康松松冯智翱
邬国栋,董佳妮,谢华祎,康松松,冯智翱,高 冰,张 东
(1.内蒙古科技大学包头医学院药学院,内蒙古包头 014040;2.基础医学与法医学院;3.公共卫生学院)
随着人民生活水平的不断提高,饮酒人群和酒的消费量逐渐增加,相应酒精性肝病也逐渐增多。内蒙古作为高饮酒量地区,酒精性肝病的预防及治疗是迫切需要解决的问题。苦豆子(Sophora alopecuroides L.)系豆科(Leguminosae)槐属植物,药用部位可以是全草,也可以是根及种子,是一种常用的中蒙药材,主要成分有生物碱、黄酮和挥发油等,其中生物碱[苦豆子总碱(total alkaloids of sophora alopecuroides,TASA)]是其重要活性成分[1]。TASA具有抗炎、抗癌、抗菌和免疫调节等作用[2-4]。黄华等[5]研究发现,TASA对化学性肝损伤模型(如四氯化碳和D半乳糖胺所引起)和免疫性肝损伤模型(卡介苗加脂多糖引起)具有保护作用,可使谷丙转氨酶(ALT)和谷草转氨酶(AST)水平下降。本实验拟应用50 %乙醇制备急性肝损伤模型,通过测定血清中各项指标及肝组织HE染色研究TASA对小鼠急性肝损伤是否具有保护作用及其可能的作用机制。
1 材料与方法
1.1主要材料与试剂 昆明种小鼠48只,雌雄各半,体重(22±2)g,购于斯贝福(北京)生物技术有限公司,合格证号:SCXK(京)2016-0002。苦豆子总碱(西安立森生物科技有限公司,含量为80 %);无水乙醇(天津市凯通化学试剂有限公司);联苯双酯(万邦德制药集团股份有限公司,生产批号:A02J181109);ALT(生产批号:20191106)试剂盒、AST(生产批号:20191105)试剂盒、丙二醛(MDA,生产批号:20191108)试剂盒、超氧化物歧化酶(SOD,生产批号:20191108)试剂盒,均购自南京建成生物生物工程研究所。
1.2主要仪器与设备 AU640全自动生化分析仪(日本奥林巴斯公司),酶标仪(赛默飞世尔科技有限责任公司),Sartorius BSA224S-CW电子天平(北京赛多利斯科学仪器有限公司),TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司)。
1.3方法
1.3.1给药方案与模型制备 将小鼠随机分为空白对照组、模型组、联苯双酯阳性对照组、TASA低、中、高剂量组,8只/组,根据查阅文献与人鼠用药比例折算[6-7],TASA低、中、高剂量组分别按20 mg/kg、40 mg/kg、80 mg/kg灌胃,阳性对照组按3.4 mg/kg灌胃,模型与空白对照组给予相同体积生理盐水,连续灌胃7 d,1次/d,末次给药30 min后,除空白对照组外,各组按10 mL/kg给予50 % 乙醇[8]制备酒精性急性肝损伤模型,术前12 h禁食、不禁水。
1.3.2样品采集与处理 小鼠摘除眼球取血,3 500 r/min离心,取上层血清于1.5 mL离心管中,-80 ℃保存,用于生化测定。分离肝脏组织,称重,保存于10 %甲醛固定液中用于形态学检查。
1.3.3肝脏系数测定 于规定时间颈椎脱臼处死小鼠并称重,取肝脏称重,计算肝脏指数[9]。肝脏指数(%)=[肝脏质量(g)/体重(g)]×100 %。
1.3.4血清生化指标测定 根据试剂盒说明书测定ALT、AST和SOD活性及MDA含量。
1.3.5组织病理学检查 将肝脏浸泡于10 %甲醛固定液中,常规石蜡包埋,HE染色,于光学显微镜下观察肝脏组织的病理学改变。

2 结果
2.1TASA对酒精所致肝损伤模型小鼠肝脏指数和血清ALT、AST含量的影响 与空白对照组相比,模型组肝脏指数升高(P<0.05),ALT和AST含量也增加(P<0.05)。与模型组相比,TASA高剂量组肝脏指数降低(P<0.05),TASA高、中剂量组ALT和AST含量降低(P<0.05)。见表1。

表1 TASA对小鼠肝脏指数和血清ALT、AST含量的影响
2.2TASA对酒精所致肝损伤模型小鼠血清MDA水平和SOD活性的影响 与空白对照组相比,模型组小鼠血清中MDA含量升高(P<0.05),SOD活性降低(P<0.05)。与模型组相比,TASA高剂量组MDA含量降低(P<0.05),中、低剂量组有降低趋势,但无统计学差异(P>0.05);TASA高、中、低剂量组SOD活性升高(P<0.05)。见表2。
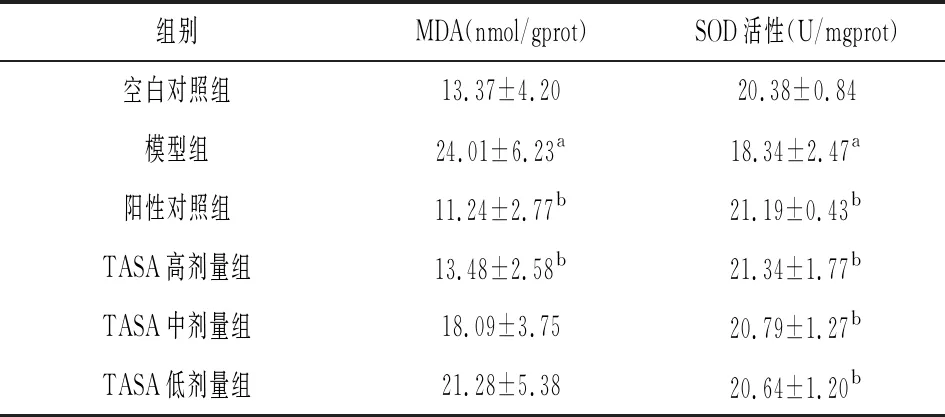
表2 TASA对小鼠血清MDA水平和SOD活性的影响
2.3TASA对酒精性肝损伤模型小鼠肝组织病理学形态的影响 空白对照组小鼠肝组织结构正常,肝细胞排列整齐、有序,无细胞肿胀、脂肪变性、炎症细胞浸润等现象。酒精模型组肝细胞索排列紊乱,肝细胞肿胀、炎症细胞浸润且呈现大小不一的空泡,且细胞中着色深浅不一。与酒精模型组相比,TASA高、中、低剂量组肝组织病理学形态有较大改善,肝细胞排列较为整齐,细胞肿胀、坏死、炎症细胞浸润等现象减轻,脂质空泡减少。见图1。
3 讨论
临床上判断肝功能是否受损及受损的程度通常以ALT及AST水平的变化作为主要指标,而酒精性肝损伤患者的肝功能水平也会发生变化,ALT及AST水平会升高[10]。ALT和AST在正常血清中含量非常少,AST主要存在于肝细胞胞浆和线粒体内,ALT主要存在于肝细胞胞浆。当肝细胞受到损伤后,ALT与AST被释放出来,所以可检测到血清中ALT和AST含量,而血清中ALT和AST含量增加表明肝脏受到损伤[11]。本研究结果显示,应用TASA组的小鼠肝脏指数减小,ALT和AST含量低于模型组,说明TASA对小鼠酒精性肝损伤具有一定的保护作用。
已有研究表明,酒精性肝损伤病理学改变主要为肝组织脂肪变性,显微镜下可观察到脂滴,肝细胞索排列紊乱且肝细胞肿胀、增生、坏死、炎性细胞浸润等现象,所以可通过HE染色分析肝脏的病变及病变的程度[12]。本实验中TASA各剂量组肝组织病理学形态有较大改善,肝细胞排列较为整齐,细胞肿胀、坏死、炎症细胞浸润等现象减轻,脂质空泡减少。HE染色结果也说明TASA对酒精性肝损伤具有保护作用。
关于酒精性肝损伤的发病机制较多,其中氧化应激是导致酒精性肝损伤非常重要的发病机制之一,体内的氧化应激反应可通过酒精激活,从而使肝组织遭到破坏[13]。氧化应激导致的肝损伤最终会产生大量的脂质过氧化产物MDA,可用MDA反映组织过氧化损伤的程度,同时MDA还可造成细胞代谢和功能障碍;酒精及其代谢产物乙醛都可以引起肝细胞膜脂质过氧化,进而产生MDA[14]。SOD是体内的抗氧化酶,可以清除细胞内自由基,保护细胞免受氧化损伤,SOD水平的高低是衡量机体抗氧化能力大小非常重要的指标[15]。由本实验研究结果可知,TASA可降低酒精性肝损伤小鼠血清MDA含量,升高SOD活性,说明TASA可以降低酒精性肝损伤的氧化应激作用,降低酒精对肝细胞的损伤,这可能是TASA发挥肝脏保护作用的原因之一。
综上所述,TASA对急性酒精性肝损伤具有一定的保护作用,其机制可能与减轻氧化应激作用有关。
