小口径血管的生物打印进展
2021-11-23曹霞SushilaMaharjanRamlaAshfaqJaneShinYuShrikeZhang
曹霞 ,Sushila Maharjan ,Ramla Ashfaq,Jane Shin,Yu Shrike Zhang *
Division of Engineering in Medicine, Department of Medicine, Brigham and Women’s Hospital, Harvard Medical School, Cambridge, MA 02139, USA
1. 引言
血管是把氧气和营养物质输送到组织中并从中携带二氧化碳和其他代谢废物的通道,主要包括三种类型:动脉、毛细血管和静脉,它们在结构组成、尺寸和生理功能上都不同[1]。根据血管内径(inner diameter, ID),可将其分为微血管(ID < 1 mm)、小血管(ID = 1~6 mm)和大血管(ID > 6 mm)[2,3]。
主动脉是人体内最大的血管,它将含氧血液从心脏输送到身体的不同部位。主动脉分支成动脉,动脉进一步分支成更小的血管,称为小动脉。小动脉最终分支成细小的毛细血管,它们是最小的血管。毛细血管可允许氧气、营养素、二氧化碳和其他代谢废物在血液和局部组织之间扩散[4,5]。毛细血管在小动脉和小静脉之间形成一个网络,其中小静脉是非常小的静脉,负责从毛细血管中收集脱氧血液,并将其输送到逐渐增大的静脉中,最后回流进入心脏[6]。
尽管动脉和静脉具有不同的功能,但它们的血管壁都是由不同细胞和细胞外基质(extracellular matrix, ECM)组成。这些细胞和ECM主要分为三个层:内层内膜、中层中膜和外层外膜[图1(a)] [7,8]。毛细血管(ID < 10 µm)由单层内皮细胞(endothelial cells, EC)组成,形成血管的内层(内膜),并被基膜和周细胞包围[图1(b)] [9,10]。小动脉和小静脉(ID = 10~100 µm)由内皮细胞内层(内膜)和周围的平滑肌细胞(smooth muscle cells, SMC)层(中膜)组成[图1(b)]。动脉和静脉(ID > 100 µm)由内皮细胞内层(内膜)、中间的平滑肌细胞层(中膜)及成纤维细胞和ECM成分外层(外膜)组成[图1(b)] [10,11]。血管的不同层及其细胞组成、直径、ECM成分和功能见表1 [12,13]。
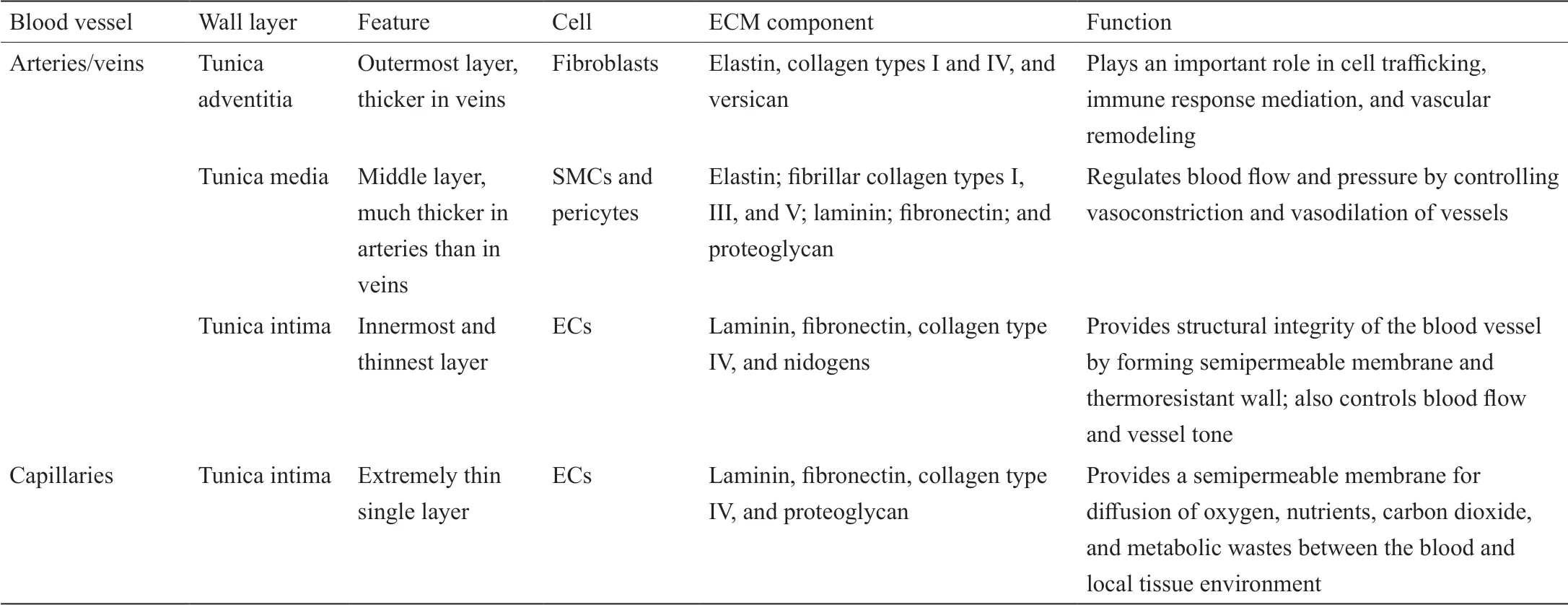
表1 血管的一般结构和功能[12,13]
内皮细胞和血管平滑肌细胞是组成动脉和静脉的关键细胞类型。这些细胞类型的相互作用不仅在血管系统的发育中起着关键作用,而且在维持血管内稳态方面也起着关键作用[14]。血管的内皮细胞内层在表型和功能上具有显著的异质性,这是由于它们在血流过程中经历了不同的微环境以及不同水平的压力和剪切应力[15]。内膜中的内皮细胞内层起到了严密调节动态屏障的作用,可防止血液泄漏到周围组织和间质中。它们也在一些生理过程中发挥关键作用,包括调节血流和通透性、炎症部位循环免疫细胞的跨内皮迁移、维持血管张力和止血作用[16,17]。血管中内皮细胞沿纵向排列,平滑肌细胞沿圆周方向排列,并由弹性纤维隔开。平滑肌细胞具有收缩表型,通过主动收缩和舒张维持血管内稳态。此外,平滑肌细胞还具有分泌表型,负责ECM的合成和修复,从而调节血管壁的结构[18]。
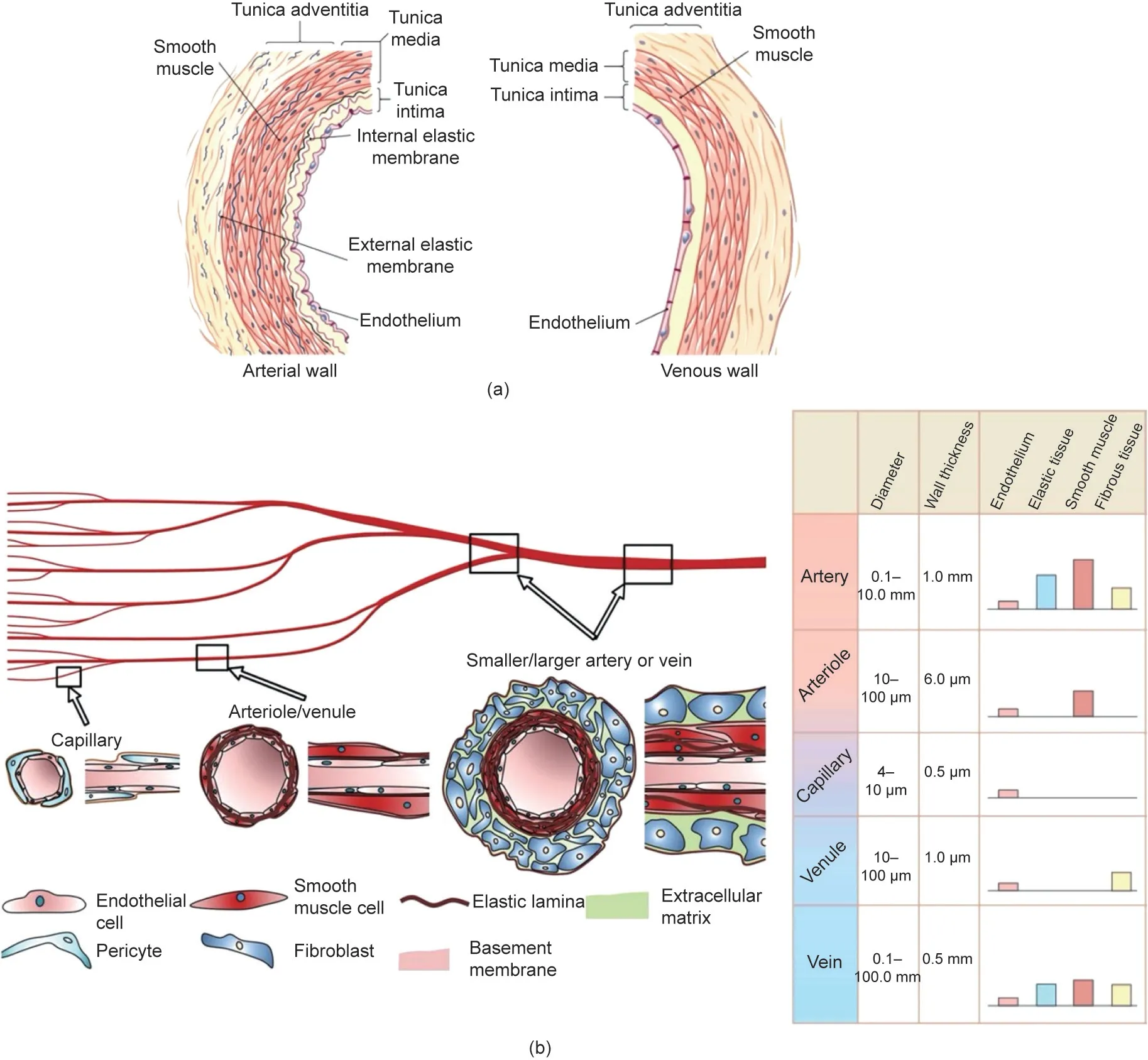
图1. 血管的一般结构和类型。(a)组成动脉壁和静脉壁的各个层的结构示意图。经Mary Hammes许可,转载自参考文献[8],©2015。(b)不同类型血管的细胞组成、直径和厚度。表中的条状图形代表血管中各个层所占的比例。毛细血管包括被周细胞包围的内皮细胞内层;小动脉/小静脉由一层薄薄的平滑肌细胞层所包围的内皮细胞内层构成;动脉/静脉由内皮细胞内层和成纤维细胞外层组成,内皮细胞形成的内层周围有致密的平滑肌细胞层。经Nature许可,转载自参考文献[10],©2018,以及经American Physiological Society, Inc.许可,转载自参考文献[11],©1954。
冠心病和外周动脉疾病导致全球死亡率和发病率逐年增加,预计到2030年,年死亡率将增至2330万[19]。目前常用的血管重建方法包括:血管成形术、支架植入术和外科旁路移植术[20]。对于旁路移植来说,治疗冠状动脉和周围血管疾病等的金标准仍然是使用自体动脉或静脉(主要是胸内动脉或隐静脉)[20]。然而,健康的自体血管并不容易获取,需要进行侵入性采集,并且长期通畅率也很低[21,22]。采用合成血管移植物替代自体血管,可成功替换中型和大型血管。合成血管主要由聚对苯二甲酸乙二酯或聚四氟乙烯制成[23,24]。尽管这些合成移植物已被证明对中型和大型血管具有有效的长期通畅性,但由于仍存在生物力学特性不匹配、生物相容性差、血栓形成、微生物污染和通畅率差等特点而受到限制[25-27]。考虑目前血管类导管的局限性,以及包括冠状动脉和外周动脉在内的小口径血管的病理事件,医疗领域一直存在对具有降低小口径血管疾病发病率潜力的生物工程血管的临床需求 [28]。
随着血管生物工程的发展,三维(3D)生物打印技术已成为有潜力的血管生成方法,生成的血管具有在体内生长、重塑、修复血管疾病的能力。在过去的几年里,不同的3D生物打印技术和策略被报道用以制造仿生血管,并不断得到完善和改进[29-32]。本文综述了应用于血管工程的各种生物打印技术,包括挤出生物打印、喷墨生物打印、激光辅助生物打印、光固化生物打印等,以及它们的优点和局限性。我们还讨论了不同的生物材料及其生物相容性、可打印性、力学性能等,以及在制备合适的生物墨水以满足小口径血管3D生物打印的关键要求方面所面临的挑战。最后,我们探讨了未来可能的发展方向。
2. 三维生物打印
3D生物打印技术在血管组织工程领域取得了重大进展。要实现与天然血管的整合,具有长期通畅性的工程血管的基本要求包括:适当的力学性能、高顺应性、重塑能力和抗血栓形成能力[33]。理想生物工程血管特别是小口径血管的要求见表2 [25]。3D生物打印可以将生物材料和活细胞(统称为生物墨水)精确沉积在指定位置,形成与天然血管非常相似的结构[34]。生物打印可通过各种方式、策略以及来源广泛的生物墨水成功制备血管组织[24]。最常用的生物打印方式包括:喷墨打印[35]、挤出打印[36,37]、激光辅助打印[38]和光固化生物打印[39,40]。喷墨打印是一种非接触生物打印技术,生物墨水液滴从墨盒中以预设尺寸进行沉积,生成伪3D或3D结构[图2(a)] [31,41]。挤出生物打印是最常用的生物打印方法,其中生物墨水通过由打印头形成长丝的形式进行连续分配[图2(b)] [31,42]。与喷墨打印和挤出打印相比,激光辅助生物打印不太常见,该方法使用激光脉冲将生物墨水从供体载玻片沉积到受体基板上[图2(c)] [31,43,44]。基于光固化的生物打印,通常采用立体光刻或数字光处理的形式,通过精确控制的光掩模在垂直移动的平台上逐层聚合光敏聚合物,以创建具有所需的3D结构[图2(d)] [45,46]。

表2 理想的生物工程小口径血管需满足的要求[25]
每种模式都有其优缺点,并且在一些参数(如生物墨水和基质的选择、结构的复杂性和制造的数量)上有所不同[47]。喷墨生物打印具有生物墨水沉积速度快和分辨率高等优点;然而,由于分配层的不稳定性,其容量通常有限[48,49]。挤出生物打印是一种成本效益高且易于控制的方法。但这种方法打印速度相对缓慢,且分辨率较低[50]。激光辅助生物打印具有制造速度快、分辨率高和生物相容性良好的特点,但仪器成本较高[51]。基于光固化的生物打印也具备分辨率高和快速制造的特点,但仪器比较复杂[52]。根据血管的不同形状和大小,不同的3D生物打印模式已被应用于体外制造具有不同功能的血管系统[图2(e)] [5]。
3. 生物墨水的设计
为了实现生物工程血管系统的功能,其结构和完整性必须与天然血管相似(两者都高度依赖于周围ECM的力学性能和化学信号)[53]。ECM是各种细胞因子及生长因子的贮存器和调节剂,其在血管形成过程中为内皮细胞的组织和稳定提供结构支持[54]。因此,ECM特性,如密度、异质性和硬度在调节血管形态发生、毛细血管网络形成和屏障完整性方面发挥着关键作用[55,56]。
组成不同血管层的主要ECM成分如表1 [12,13]所示。内皮细胞排列在血管腔内层,血管腔位于基底膜上,基底膜主要由胶原、层黏连蛋白、纤维连接蛋白、巢蛋白、硫酸肝素蛋白多糖和其他大分子组成[54,57]。中膜是平滑肌细胞的中间层,由含有纤维胶原I、III、V的胶原质ECM,层黏连蛋白,弹性蛋白,纤维连接蛋白,透明质酸和核心蛋白聚糖组成[58-60]。内膜和中膜被内弹性膜分开。外膜层是结缔组织和成纤维细胞的最外层,包括弹性蛋白、I型和IV型胶原以及蛋白聚糖[57,59-61]。
因此要想成功地在体外制造血管,特别是直径较小的血管,需要更高分辨率的生物打印方法与适当的生物墨水配方之间的协同作用。生物墨水可以提供结构和机械支持,以维持细胞活力,同时促进移植或血管新生[62]。生物墨水是由生物材料、细胞、营养素、生长因子组成,应该模拟组织的最佳ECM环境[63]。生物墨水的设计应考虑主要的ECM组成,这对于血管的3D生物打印至关重要,因为它不仅决定了生物打印的分辨率,还决定了血管的完整性和其他关键的生物特性[64-66]。
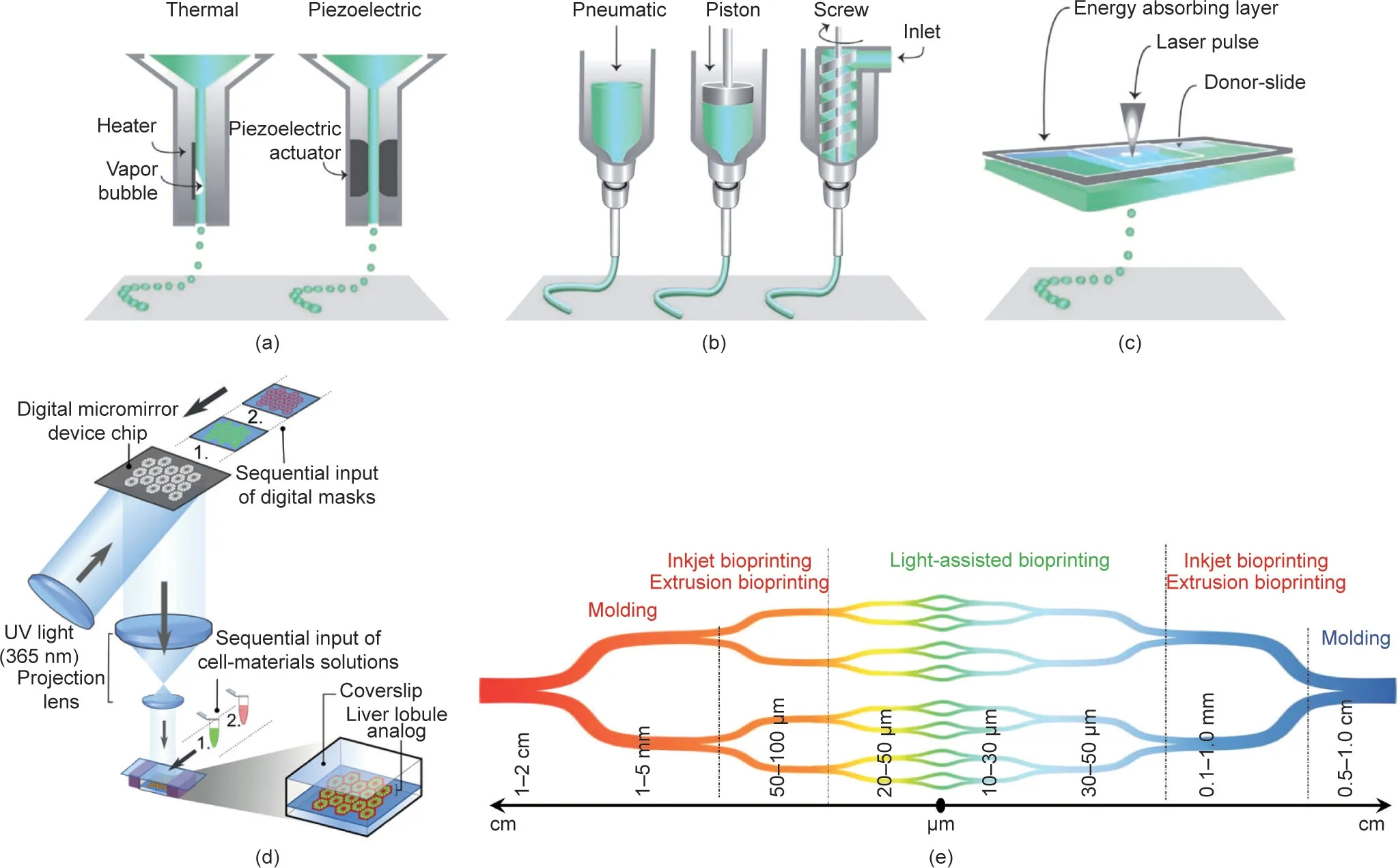
图2. 具有代表性的3D生物打印方法。(a)喷墨生物打印法示意图;(b)挤出生物打印法原理图;(c)激光辅助生物打印法原理图。经Wiley许可,转载自参考文献[44],©2013。(d)光固化生物打印法示意图[46]。经Xuanyi Ma等许可,转载自参考文献[46]。(e)血管的层次结构和当前的生物打印技术示意图,这些技术已被用于制造各种不同的血管。经Elsevier许可,转载自参考文献[5],©2019。
用于血管3D生物打印的生物墨水最常用的配方是基于水凝胶前体的配方,原因是这些配方具有优异的生物相容性、可调节的硬度和孔隙率、模拟天然ECM的能力以及与不同生物打印模式相兼容的特性[67]。已有研究对几种天然和合成生物材料进行了单独或组合使用,设计出类似于ECM理化性质的生物墨水。广泛用于体外血管组织工程的天然生物材料,包括明胶[68-71]、胶原[72-77]、弹性蛋白[78-81]、纤维蛋白[82-85]、透明质酸[68,86,87]、琼脂糖[49,88]、海藻酸[89,90]和基质胶[91-93]等。基于天然生物材料的水凝胶为细胞黏附、生长和增殖提供了适宜的微环境;最重要的是,它通常不会对宿主造成慢性炎症或毒性[74]。然而,天然水凝胶的弱机械强度无法承受生理压力,因而限制了其在血管组织工程中的应用[94]。因此,已有研究将各种合成聚合物与天然生物材料相结合,原因是合成聚合物具有精确控制的力学性能、孔隙率、再现性、结构多样性、刚度和生物降解性[95]。常用的合成聚合物包括聚乙二醇(PEG)[96,97]、聚甲基丙烯酸羟乙基酯[98]和聚乙烯醇(PVA)[99,100]。这些复合材料可以提供良好的机械支撑,提高打印结构的机械强度。然而,由于缺乏生物相容性、细胞黏附性差、释放有毒副产物以及降解过程导致力学性能下降,合成聚合物的应用受到限制[47]。
为了克服这些限制并获得具有理想性能的生物墨水,人们采用了基于化学、机械、物理和生物改性的不同方法来探索功能化。最常用的功能化方法之一是将甲基丙烯酰基引入聚合物,如明胶[101-105]、胶原[106,107]和透明质酸[108,109]。这种方法产生的光聚合物可以按要求形成力学性能稳定的结构。这些聚合物的机械强度很大程度上取决于甲基丙烯酰改性程度和光照暴露程度。甲基丙烯酰改性程度越高,光照时间越长,结构的强度就越高,降解率就越低[110]。应用两种或两种以上交联机制有助于显著提高结构完整性和机械强度[110,111]。例如,当使用维生素B2(核黄素)[112]共价交联脱细胞ECM (decellularized ECM, dECM)生物墨水,然后通过胶原纤维形成热触发物理交联时[113],能获得更好的力学性能。与单独交联的结构物相比,这种两步交联机制表现出更高的储能模量,表明每种交联机制都有助于提高结构物的整体力学性能[113]。另一方面,混合生物墨水材料也可以达到同样的效果。例如,在明胶甲基丙烯酸(gelatin methacryloyl, GelMA)中添加明胶提高了交联度,从而改善了力学性能[114]。此外,当其他聚合物,如甲基纤维素[115]、四臂聚乙二醇丙烯酸酯(4-arm PEG-tetra-acrylate, PEGTA)[110]、具有三季戊四醇核的八臂聚乙二醇丙烯酸酯(8-arm PEG-acrylate with a tripentaerythritol core, PEGOA)[116]、透明质酸[117]、PVA [118]和羟基磷灰石[119]加入时,它们可以增强剪切变稀行为和(或)提高生物打印后的形状保真度。
此外,将各种生物活性物质,如纤维蛋白(或纤维蛋白原和凝血酶)和聚赖氨酸添加到生物墨水中,可以诱导或增强其生物活性。纤维蛋白是一种纤维蛋白原的聚合物,在凝血酶存在下形成纤维状、黏弹性和多孔水凝胶。纤维蛋白已被证明可以提高生物墨水的生物黏附性和生物活性[120]。带正电荷的聚赖氨酸也被用于通过增加与带负电荷的细胞膜的静电相互作用来增强细胞黏附性[121]。
同样,非黏附性水凝胶的生化性能也可通过黏附肽配体的修饰得到改善。精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid, RGD)肽是最常用的肽配体,在细胞黏附、扩散和迁移中起着关键作用[122]。例如,与未经RGD修饰的水凝胶相比,与RGD肽共轭的聚乙二醇二丙烯酸酯(PEG-diacrylate, PEGDA)水凝胶增强了细胞的黏附性[123]。进一步说明,植入的PEGDA水凝胶中含有的RGD肽可调节体内细胞黏附性、炎症反应、纤维包封和血管形成[123]。RGD肽也被引入其他各种水凝胶形成聚合物中,如透明质酸[123]、海藻酸[124]、壳聚糖[125]和PEG [126]水凝胶,用来改善细胞行为。
多种生长因子,如成纤维细胞生长因子(fibroblast growth factor, FGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)以及转化生长因子-α(transforming growth factor-α, TGF-α)和TGF-β已被确定是血管生成的诱导因子。例如,FGF-2 [127]和VEGF [128]用于刺激内皮细胞的增殖、运动和分化,是血管形成的关键介质[129]。在体内和体外研究中,VEGF被物理地包封在PEG水凝胶中,以释放响应细胞分泌的蛋白酶,从而增强血管形成[130]。此外,在ECM蛋白质中发现了一些生长因子结合位点,如纤维连接蛋白[131]、纤维蛋白原[132]、细胞黏合素C [133]和玻璃体蛋白[134]。已有研究表明与这些ECM蛋白结合的VEGF可促进糖尿病患者的伤口和骨缺损的愈合[135]。虽然其中一些策略可能尚未与血管生物打印中所使用的生物墨水相结合,但它们在血管生物打印中的应用似乎显而易见。
最近,一些研究表明改变基质黏弹性对细胞行为产生影响,包括通过改变聚合物的共价交联和(或)浓度来降低丙烯酰胺水凝胶的模量[136,137],通过改变亲和力不同的共价交联剂来调节PEG水凝胶中的应力松弛[138],或使用海藻酸水凝胶的共价和(或)物理交联[139]。这些研究表明,在二维(2D)培养中,改良的耗能模量和基质可缓慢增强间充质干细胞(mesenchymal stem cell, MSC)的细胞铺展和成骨分化[136,137],增强的基质应力松弛改善了2D培养细胞的扩散和增殖[139],并使细胞适应相关的3D培养形态[138]。同样,研究表明,细胞在弹性和黏弹性水凝胶中表现不同,生物材料的弛豫行为随着细胞的相互作用而改变,细胞行为改变包括扩散、增殖和分化[140]。MSC分化依赖于3D水凝胶的初始弹性模量,而在弹性水凝胶中,MSC分化对水凝胶的刚度缺乏敏感性,表明细胞应力松弛对ECM中的力学性能具有重要意义[141]。这些见解可能有助于血管生物墨水的设计,以改善细胞行为和血管功能。
4. 小口径血管生物打印的研究进展
小口径血管包括小动脉和小静脉。小动脉腔调节毛细血管中的血流,小静脉是从毛细血管接收血液的最小静脉,在血液和组织之间的氧气和营养物质交换中起着重要作用[4]。通常很难用人工方法构建小口径血管。然而,利用生物打印技术的优势,可以获得更复杂的和生理相关的小口径血管结构[46,142]。
4.1. 挤出生物打印
挤出生物打印是一种经济高效且常用的生物打印方法,该方法以一种逐层同步打印头空间运动的方式从打印头分配生物墨水[47,143,144]。挤出生物打印机通过打印头以气动或机械方式连续分配生物墨水,可与多种高黏度生物墨水兼容[145]。海藻酸已广泛用于血管组织结构的挤出生物打印。例如,海藻酸可以与中心同时打印的氯化钙(CaCl2)溶液物理交联,以确保生物打印空心结构的保真度[89,146]。采用外层针(ID = 540 µm)和内层针(ID = 250 µm)制备同轴打印头,利用该打印头,将海藻酸钠溶液(浓度分别为3%、4%和5%)包封的原代人脐静脉平滑肌细胞(human umbilical vein SMC, HUVSMC)生物打印成可灌注血管[147]。利用海藻酸钠溶液(浓度为5%)打印的血管的管腔平均直径分别为(1449 ± 27)µm和(990 ± 16)µm。同样,采用同轴打印头辅助挤出生物打印方法,利用包封在海藻酸钠(浓度为2%~5%)和CaCl2(浓度为2%~5%)溶液的L929小鼠成纤维细胞,可实现直径均匀、机械强度高、结构完整性好的中空海藻酸钙纤维的3D生物打印[148]。同轴打印头由外层针(ID = 1600 µm)和三个不同内层针(ID分别为510 µm、410 µm、330 µm)组成。生物打印空心血管的大小取决于内层针的大小以及海藻酸钠和CaCl2的流速和浓度。当使用海藻酸钠溶液(流速为1 mL·min−1、浓度为2%)和CaCl2(流速为2 mL·min−1、浓度为4%)时,生物打印海藻酸钠空心血管的平均ID和外径(outer diameter, OD)分别为892 µm和1192 µm。
在另一项研究中,使用带有同心针的多层同轴打印头与包封人脐静脉内皮细胞(human umbilical vein EC, HUVEC)和人间充质干细胞(human MSC, hMSC)的生物墨水来制造可阅读的血管组织结构[110]。该研究中的生物墨水由海藻酸钠(浓度为2%或3%)、PEGTA(浓度为2%或3%)和GelMA(浓度为5%或7%)预聚物溶液组成。PEGTA的加入增强了生物打印血管组织结构的力学性能。根据所使用的内层针(ID = 0.159~0.210 mm)和外层针(ID = 0.153~0.838 mm)的大小,优化混合生物墨水(浓度为3%的海藻酸、2%的PEGTA和7%的GelMA),生物打印不同尺寸的空心管。生物打印空心管的平均OD为500~1500 µm、ID为400~1000 µm、壁厚为60~280 µm。混合的生物墨水经证明可支持生物打印的血管结构中包封的HUVEC和hMSC的扩散和增殖,从而形成生理相关的血管组织结构[图3(a)] [110]。最近,利用多通道同轴挤出系统可进一步制备多层中空血管组织。该系统由同轴打印头(由三个同心针组成的芯部针,ID = 0.210 mm)、中层针(ID= 0686 mm)和外层针(ID = 1.600 mm)组成;生物墨水由GelMA(浓度为5%或7%)、海藻酸钠(浓度为2%或3%)和PEGOA(浓度为1%或2%)组成;HUVEC打印在中间层;平滑肌细胞打印在外层[117]。当使用具有最佳打印性能的混合生物墨水(7%的GelMA、2%的海藻酸钠和2%的PEGOA)时,测量内腔的平均直径为(663 ± 52)µm、外腔为(977 ± 63)µm、内外壁厚度分别为(62 ± 10)µm和(94 ± 10)µm [图3(b)] [116]。生物打印的血管组织表现出不同层次和不同表型的细胞异质性,表明血管样组织的形成。
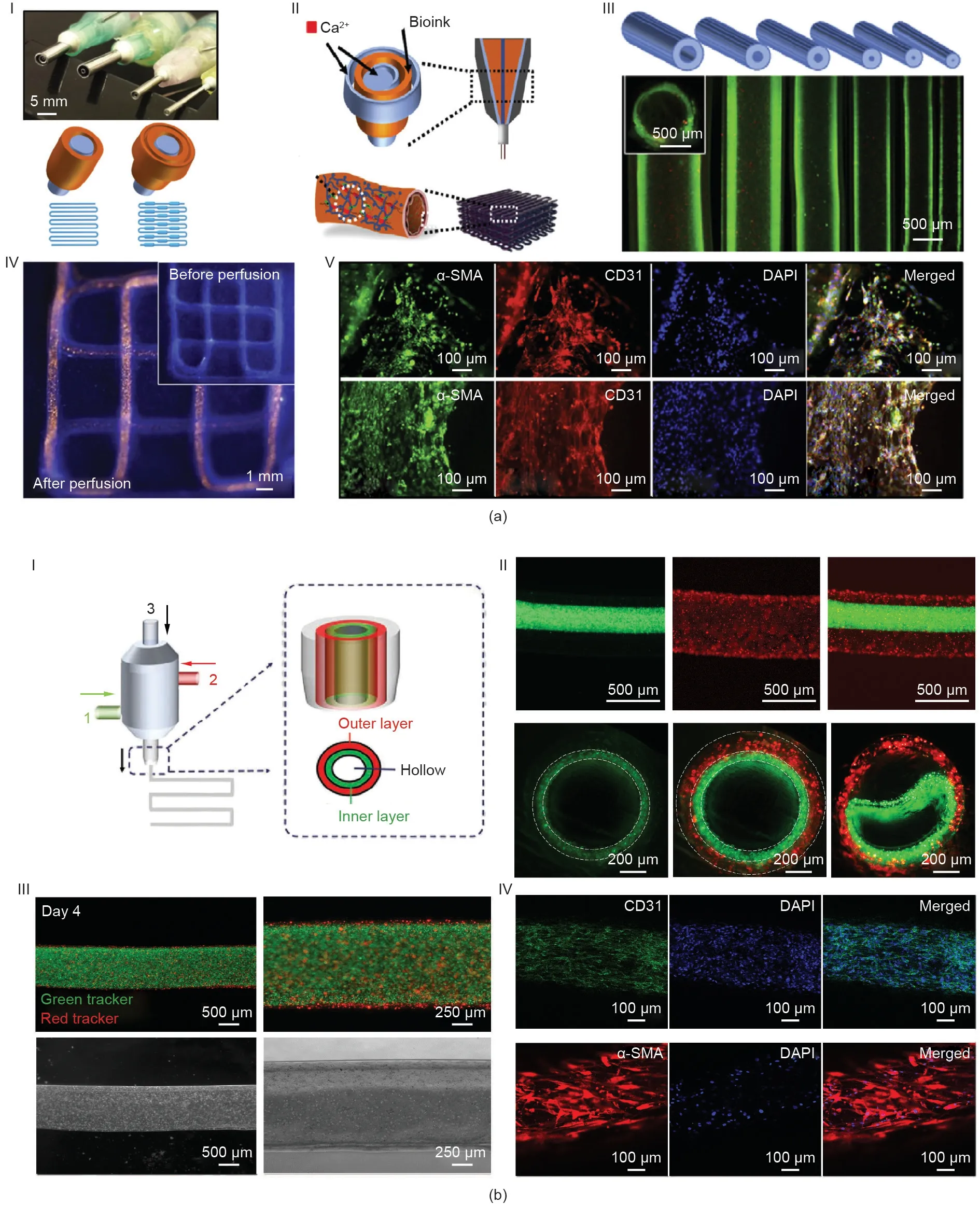
图3.(a)小口径血管的同轴生物打印:(I)多层同轴打印头和各种空心血管制造示意图;(II)血管床的生物打印工艺和制作示意图;(III)示意图和荧光显微照片显示不同直径的生物打印血管;(IV)注射红色荧光微球前后的生物打印血管的荧光照片;(V)血管管状结构的共聚焦图像显示,在培养14 d(上排)和21 d(下排)后,MSC表达平滑肌α-肌动蛋白(α-SMA),HUVEC表达分化簇31(CD31)。细胞核用4′,6-二氨基-2-苯基吲哚(DAPI)染色。经Elsevier许可,转载自参考文献[110],©2016。(b)多层空心血管生物打印用多通道同轴挤出系统示意图(I);双层空心血管(上排)的代表性荧光显微照片以及单层和双层空心血管的横截面图(下排)(II);第4天,由用绿色荧光标记的人膀胱内上皮细胞和用红色荧光标记的人膀胱外平滑肌细胞组成的生物打印血管的荧光显微照片(III);(IV)免疫染色血管的共聚焦显微照片,其中内皮细胞和血管内皮细胞表达CD31(绿色),平滑肌细胞表达α-SMA(红色)。经Wiley许可,转载自参考文献[116],©2018。
在最近的一项研究中,研究人员利用三层同轴打印头(ID分别为2.159 mm、2.906 mm、3.810 mm),通过挤出生物打印技术制备了包含内皮细胞层和肌肉细胞层的小口径血管结构,其中将包封在来源于血管组织的ECM(vascular tissue-derived ECM, VdECM,浓度为3%)/ 海藻酸(浓度为2%)水凝胶中的HUVEC和人主动脉平滑肌细胞(human aortic SMC, HAoSMC)作为生物墨水[149]。所得到的血管ID约为2 mm,由一层薄的HUVEC层(约50 µm厚)组成,外面包封一层较厚的平滑肌细胞层(800~1000 µm厚)。将血管植入大鼠腹主动脉21 d。血管移植物可重塑平滑肌层并与宿主组织融合,而且其血管通畅、内皮完整。类似地,使用3D打印的微流控共挤装置,可制备内径分别为(265 ± 11)µm、(360 ± 11)µm、(448 ± 12)µm的长期可灌注海藻酸钙血管,随后将共包封在基质凝胶(体积分数为35%)中的HUVEC和血管平滑肌细胞接种在海藻酸钙血管上[150]。所得到的血管具有正确的管腔结构,且具有内皮细胞内层和平滑肌细胞的外鞘。这些血管表现出血管的功能特性,包括静止性、可灌注性和对血管收缩剂的收缩性。另一项研究展示了同轴挤出打印小口径血管,其中人冠状动脉平滑肌细胞(human coronary artery SMC, HCASMC)被包封在儿茶酚功能化的GelMA(GelMA/C,质量分数为20%)生物墨水中[151]。含有HCASMC的GelMA/C生物墨水通过较大的外层针(直径为840 µm)挤出,而Pluronic F127(质量分数为30%)和高碘酸钠(23.4 nmol·L-1)中的HUVEC通过较小的内层针(直径为406 µm)挤出。根据使用的同轴打印头,生物打印血管的ID为500~1500 µm,壁厚为100~300 µm。将生物打印的血管进一步植入非肥胖型糖尿病严重联合免疫缺陷(nonobese diabetic-severe combined immunodeficiency, NOD-SCID)白细胞介素-2(interleukin-2, IL-2)受体γ-null(NSG)的小鼠体内,结果表明其在体内可自主整合和形成功能性血管。
4.2. 喷墨生物打印
喷墨生物打印是一种将生物墨水液滴沉积在基板上预定位置的制造方法。液滴的形成可能是由热力或压电力引起的[48,152]。以海藻酸为基础的3D管状组织结构是随着海藻酸小珠在CaCl2溶液中的快速凝胶化而形成的,并最终形成微凝胶液滴作为构建块[153]。具体来说,海藻酸钠溶液(浓度为0.8%)通过喷墨打印头喷射到CaCl2溶液(浓度为2%)中,形成直径约为40 μm的圆形微凝胶珠。海藻酸管(直径为200 µm)是通过移动喷墨打印头形成圆形结构来制造的,其中海藻酸凝胶的液滴被生物打印在CaCl2溶液中。
将以海藻酸钠(浓度为1%)包封的NIH/3T3成纤维细胞用作生物墨水,采用3D喷墨生物打印系统,通过逐层沉积的方式成功制备直径约3 mm的具有悬垂结构的3D直线形和锯齿形管状结构[154]。生物墨水液滴通过压电打印头(ID = 120 µm)喷到CaCl2(浓度为2%)溶液中,形成凝胶细胞海藻酸钙层。该制备方法有可能被应用于具有复杂几何形状和结构的血管的生物打印。类似地,通过基于液体支撑的喷墨生物打印方法可生成具有分叉的血管样结构。使用压电喷墨打印头(ID = 120 µm)喷射生物墨水液滴,该液滴由海藻酸钠溶液(浓度为1%)和NIH/3T3成纤维细胞组成,交联剂为CaCl2溶液(浓度为2%)。以水平方式[图4(a-I)、(a-II)、(b-I)和(b-II)]或垂直方式[图4(a-III)、(a-IV)、(b-III)和(b-IV)]在CaCl2溶液(浓度为2%)中对血管结构进行生物打印。分叉结构的血管的平均直径为3 mm,壁厚约为1 mm [35]。在另一个实例中,将凝血酶(50 U·mL-1)和CaCl2(80 mmol·L-1)的生物墨水与人微血管内皮细胞(human microvascular EC, HMVEC)混合,并沉积到纤维蛋白原基质(60 mg·mL-1,所谓的“生物纸”)中,形成直径小于100 µm的纤维蛋白通道,以模拟微血管结构。生物打印的细胞排列在纤维蛋白通道内并可增殖,而且生物打印微血管的通道结构在21 d内都能保持稳定[155]。
4.3. 光辅助生物打印和光固化生物打印
激光辅助生物打印是一种无打印头的生物打印方法,该方法利用激光脉冲将生物墨水从供体载玻片沉积到接收器上[156]。一项研究证明了激光辅助生物打印技术在利用含有小鼠成纤维细胞的海藻酸(浓度为8%或2%)作为生物墨水制造直线形和Y形管状结构方面的潜力。当采用优化参数(激光注量:1445 mJ·cm−2;重复频率:10 Hz;基质速度:80 mm·min−1;向下运动步长:25 μm)时,构建单元平均直径为5 mm [38]。利用激光辅助生物打印技术,采用HUVEC和HUVSMC构建了可模拟天然组织血管网络的简单结构。当每个激光脉冲的能量为0.5~1.5 µJ时,直径约为50 μm的生物打印液滴按照50~150 μm的间距进行沉积[157]。
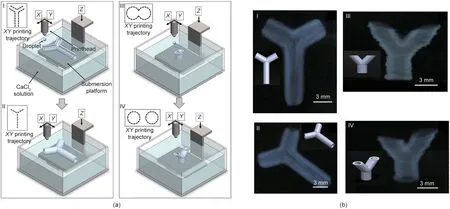
图4. 小口径血管的喷墨生物打印。(a)图示为水平(I、II)和垂直(III、IV)分叉管状结构的喷墨生物打印,其中有/无细胞的海藻酸钠液滴(浓度1%),沉积在平台上,然后与CaCl2溶液交联;(b)水平打印产生的海藻酸分叉管的顶视图(I)和全局视图(II),以及垂直打印产生的海藻酸分叉管的正视图(III)和全局视图(IV)。经Wiley许可,转载自参考文献[35],©2015。
基于动态数字微镜器件(DMD)的光固化生物打印是另一种高分辨率制作方法[158]。这项技术使得制造具有微米级分辨率的高度复杂的组织结构成为可能。利用水凝胶包封相关细胞,制备具有嵌入式血管系统的体积组织结构[159]。例如,采用基于DMD的立体光刻生物打印方法制造3D血管化肝脏模型,其中肝小叶由包封在GelMA(浓度为5%)中的人诱导多能干细胞(induced pluripotent stem cell, hiPSC)诱导产生的肝细胞获得,随后,使用HUVEC和包封在甲基丙烯酸缩水甘油酯透明质酸(浓度为1%)和GelMA(浓度为2.5%)中的脂肪源性干细胞来构建血管系统[46]。这些3D生物打印的肝脏结构,尺寸为3 mm × 3 mm,厚度约为200 µm,由六角排列的hiPSC诱导的肝细胞小叶及其周围的HUVEC层和脂肪衍生的干细胞组成。这种血管化肝脏模型为病理生理学和药物筛选研究提供了一个平台[46]。在另一项研究中,采用同样的方法建立了预血管化组织结构;使用三个数字掩模来制造带图案的组织结构,以均匀的(图5)[43]或梯度血管通道形成血管网络[142]。血管通道的大小为50~250 µm。血管化组织的基底层由六边形区域组成,六边形区域由包封在GelMA(浓度为5%)中的HepG2细胞,通过具有六边形图案的数字掩模制成。血管通道区域由包封在水凝胶(浓度为2.5% GelMA+浓度为1%的甲基丙烯酸缩水甘油酯透明质酸)中的HUVEC和10T1/2小鼠胚胎成纤维细胞,使用血管通道掩膜制成。最后,使用平板掩模在血管网络的顶部覆盖GelMA(浓度为5%),生成大小为4 mm × 5 mm的血管化组织结构,厚度为600 µm。生物打印组织中的HUVEC在体外构建自发形成的管腔样结构。此外,将生物打印的预血管化和非预血管化(无细胞)组织植入严重联合免疫缺陷小鼠背部皮肤下14 d,并证明预血管化组织结构可内皮化[142]。
4.4. 其他生物打印策略
除了上述用于制造血管结构的生物打印方法外,牺牲生物打印是一种经典的间接(生物)打印方法。血管化组织的牺牲生物打印,利用在生物打印完成后、通常通过物理提取或温度改变去除的易溶的生物墨水,留下可灌注通道[62]。使用琼脂糖作为牺牲模板,通过挤出生物打印方法,将圆柱形琼脂糖纤维生物打印在含有细胞的GelMA水凝胶中[88,160]。然后去除琼脂糖纤维,在GelMA内形成可灌注血管。这些血管的ID为800 µm~2 mm,壁厚为50~100 µm。这些可灌注血管可增加黏稠水凝胶的质量运输能力,并支持单层内皮细胞的形成。使用Pluronic F127,在GelMA水凝胶中使用类似的生物打印方法生成空心血管。将HUVEC灌流至中空通道形成单层内皮细胞层[161]。

图5. 基于光固化的微血管化组织生物打印。(a)显示预血管化组织结构制作的示意图;(b)荧光显微照片显示生物打印组织结构,包括通道中的HUVEC(红色)和周围水凝胶基质中的HepG2细胞(绿色);(c)3D共聚焦重建显微照片显示微通道中的内皮细胞,用红色荧光标记,并用绿色对CD31进行染色。经Elsevier许可,转载自参考文献[43],©2013。
另外,采用碳水化合物玻璃配方(50 mL反渗透水与25 g葡萄糖、53 g蔗糖、10g葡聚糖混合),利用钢制打印头(ID = 1.2 mm或0.84 mm),在110 ℃下打印开放互联的牺牲碳水化合物玻璃晶格[162]。在50 ℃下玻璃化后,将打印的碳水化合物玻璃晶格浸入聚(d-丙交酯-共-乙交酯)溶液中作用5 min,可防止糖类溶解引起的包膜细胞渗透性损伤。负载各种细胞的水凝胶,包括负载人胚肾(HEK)293细胞的PEG水凝胶[包含PEG-二丙烯酸酯(质量分数为5%、10%或20%)、1 mmol·L−1丙烯酸酯-PEG-精氨酸-甘氨酸-天冬氨酸-丝氨酸(RGDS)和Irgacure 2959(浓度为0.05%)]、负载10T1/2细胞的纤维蛋白凝胶(10 mg·mL−1,包含纤维蛋白原和凝血酶)、负载10T1/2细胞的海藻酸凝胶(浓度为2%)、负载原代大鼠肝细胞和基质成纤维细胞的琼脂糖凝胶(浓度为2%)以及负载10T1/2细胞的基质凝胶,用于包封3D打印玻璃晶格。ECM交联后,将整个结构浸入介质中,除去牺牲的碳水化合物玻璃,留下ECM水凝胶内的开放通道。这些血管通道中排列着HUVEC,在高压脉冲流下向其灌注血液。结果表明,在3D生物打印组织中,这些血管通道能够支持原代大鼠肝细胞的代谢功能。按照相同的方法,使用100 g异麦芽和10 g右旋糖酐,通过钢制打印头(ID = 0.84 mm),在60 mL反渗透水中打印牺牲碳水化合物玻璃纤维丝,并将其包封在纤维蛋白凝胶(10 mg·mL−1)中[163]。用磷酸盐缓冲盐水冲洗,然后将HUVEC注射到中空通道中,去除牺牲的碳水化合物纤维。将这些3D生物打印的血管化组织植入小鼠后肢缺血模型中,显示出增强的血管生成和工程血管与宿主血管系统的整合,最终实现远端缺血组织的灌注。同样,当将这些生物打印的血管化组织应用于心肌梗死的小鼠模型时,其被证明能挽救部分心脏功能,而且射血分数和心输出量与健康对照组的相似。
在另一项研究中,研究人员使用明胶(浓度为10%)作为牺牲材料,在3D I型胶原基质(3 mg·mL-1)内构建两个流体血管通道;先在流动腔上生物打印胶原前体,然后再生物打印两种明胶纤维[164]。将HUVEC和正常人肺成纤维细胞包封在两个明胶纤维之间的纤维蛋白凝胶中,打印后,在其顶部生物打印出几层胶原覆盖整个结构。去除牺牲的明胶,将HUVEC注射到通道中,然后让通道与培养基一起流动。这项研究表明,通过将HUVEC和成纤维细胞包封在两条血管通道之间的纤维蛋白凝胶中,可以形成微血管网络。
最近有研究报道了使用一个有三个打印头的生物打印机,通过按需喷射式生物打印方法构建血管结构[10,11]。明胶(浓度为5%)或含有HUVEC的明胶(浓度为3%)作为牺牲打印的中间核心,用直径为150 μm的打印头进行打印。另外两个直径为0.3 mm的打印头用于制作肌肉层,其中一个打印头打印含有凝血酶、谷氨酰胺转胺酶和氯化钙的交联剂溶液液滴,而另一个打印头打印纤维蛋白原(浓度为2.5%)-人脐动脉平滑肌细胞悬浮液滴。最后,在生物打印过程完成后,通过将纤维蛋白原(浓度为1.25%)-胶原(体积分数为0.18%)混合物包封在肌肉层周围形成血管外层。因此,产生的可灌注血管通道,直径为1 mm,壁厚为425 µm,包含内皮细胞、平滑肌细胞层、成纤维细胞和周围的ECM。
5. 未来展望
生物打印技术的进步促进了生物工程化制备可灌注血管结构以及不同形状、大小和功能的血管化组织结构(表3)[110,116,148-151,153]。然而,大多数生物打印血管组织仍然缺乏天然血管的关键结构成分、力学性能、生理特性。每种生物打印方式都有其优缺点。理想的打印模式应最大程度地提高其分辨率和生物打印速度等能力,并具有能广泛运用于优化血管生成潜能的生物墨水。此外,以往的研究多是以HUVEC为模型细胞类型。然而,为了实现临床相关血管组织的形成,生物打印血管应该能够通过相关细胞来源进行重塑和功能转变。因此,进一步探索改进的生物打印工艺,开发先进的生物墨水,用于制备具有适当的力学行为和良好生物学性能的功能性小口径血管移植物以及血管化的组织移植物。其中一些生物学性能可以通过加入灌注生物反应器等动态培养条件进一步提高,以促进成熟。最后,对血管生物学的持续了解,如不同血管层,包括内皮细胞、平滑肌细胞和周围支持细胞以及ECM之间的相互作用,将为改进生物工程设计提供更好的见解。
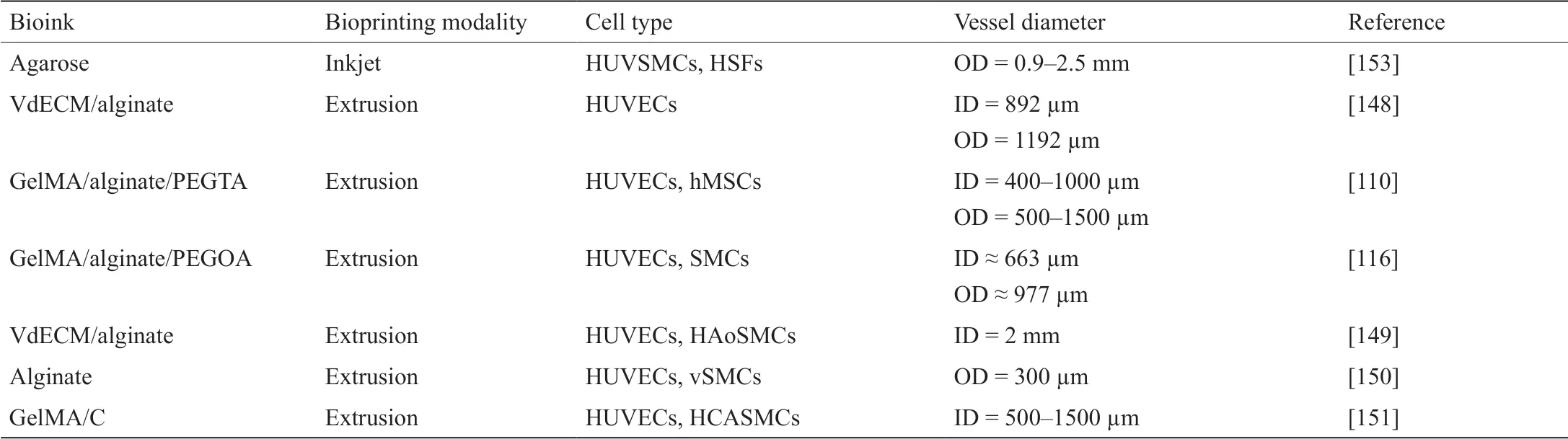
表3 生物打印小口径血管的代表性参数和特性
Acknowledgements
This work was supported by funding from the US National Institutes of Health (R00CA201603, R21EB025270, R21EB026175, and R01EB028143) and the Brigham Research Institute.
Compliance with ethics guidelines
Xia Cao, Sushila Maharjan, Ramla Ashfaq, Jane Shin, and Yu Shrike Zhang declare that they have no conflict of interest or financial conflicts to disclose.
