椎间盘钙化与骨化的能谱CT 鉴别
2021-11-23钟鑫丛文斌钟延国张国庆相宏飞段峰
钟鑫,丛文斌,钟延国,张国庆,相宏飞,段峰
(1 青岛大学基础医学院,山东青岛 266071; 2 青岛大学附属医院放射科; 3 昌乐县人民医院骨科; 4 青岛大学附属医院脊柱外科)
能谱CT 主要是利用物质在不同X 射线能量下所产生的不同的吸收谱来分析物质构成、结构、成分比例等[1],近年来已被广泛应用于临床病灶性质分析[2-3]。椎间盘钙化为一种罕见的钙盐异常沉积于软骨组织的退行性病变[4],病理表现为钙盐羟基磷灰石结晶(Ca10(PO4)6(OH)2)的无定型沉积[5]。由于术前常规CT 对钙盐沉积物的鉴别不敏感,临床鉴别诊断困难,而能谱CT 可为钙化诊断提供充分的依据。本研究对病灶的单能量CT 能谱曲线、钙分布直方图、物质密度散点图进行分析,了解钙盐沉积病灶的硬度特征性质,探讨能谱CT 技术诊断椎间盘骨化与钙化的临床应用价值。
1 资料和方法
1.1 一般资料
2017年6月—2020年2月,选取于青岛大学附属医院及首都医科大学附属宣武医院、昌乐县人民医院,因椎管内硬膜外硬质占位性病变行手术治疗病人43例,其中男20例,女23例;年龄46~62岁,平均(53.8±7.4)岁。依照术后病理诊断结果分为钙化组4例,骨化组19例(20例CT 检查病人无病理结果)。另随机选取同期不同部位钙化灶病变病人45例,男23 例,女22 例;年龄51~75 岁,平均(62.7±12.1)岁。其中钙化灶位于主动脉15例,冠状动脉11例,肝7例,脑12例。入选标准:①常规影像主观诊断为“硬质”的椎管内、硬膜外,椎间盘、椎体或后纵韧带来源的占位性病变,主观上需要接受手术病人;②均接受手术治疗,仅对病灶进行干预或取得病灶标本送病理检查者;③病人病史资料完备,术前均行常规影像检查(X 线、CT 或MRI)以及能谱CT 检查;④影像诊断为“钙化灶”病人均未并发其他疾病且当事人接受、同意能谱CT 检查要求;⑤所获得的影像资料均可进行影像分析。排除标准:①合并有慢性心、脑、肾等影响肌肉代谢的急慢性疾病;②影像原始资料不全者;③并发肿瘤、炎症、创伤等病人;④责任病变位置不唯一和不明确者;⑤其他影响影像定量分析的因素。本文研究均经病人和家属知情同意,并获医院伦理委员会审批通过。
1.2 研究方法
术前进行常规CT 扫描确定病灶位置,能谱CT扫描获得病灶能谱曲线,比较钙化组与骨化组关注视野窗显示视野(DFOV)处测量所得能谱曲线70 ke V 处能谱值(图1)、40~110 ke V 能谱曲线斜率;绘制原子序数直方图,比较两组病灶8%像素处原子序数分布密度;绘制钙-水基图像钙密度散点图,获得拟合的曲线,并计算曲线近似斜率,分析散点群分布特点。40~110 ke V 能谱曲线斜率值计算公式:斜率=(Hu40keV-Hu110keV)/40[1]。术后对病灶标本行病理学检查,观察组织形态学特征与特点。所有检测均为扫描主病变单元的常规诊疗过程,数据盲法处理,自动生成单能值(keV)-CT值(Hu)能谱衰减曲线,进行DFOV 70 keV处能谱值分析(图2)。
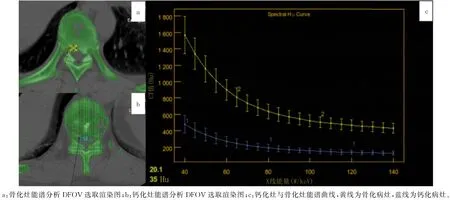
图1 不同病灶的能谱CT扫描
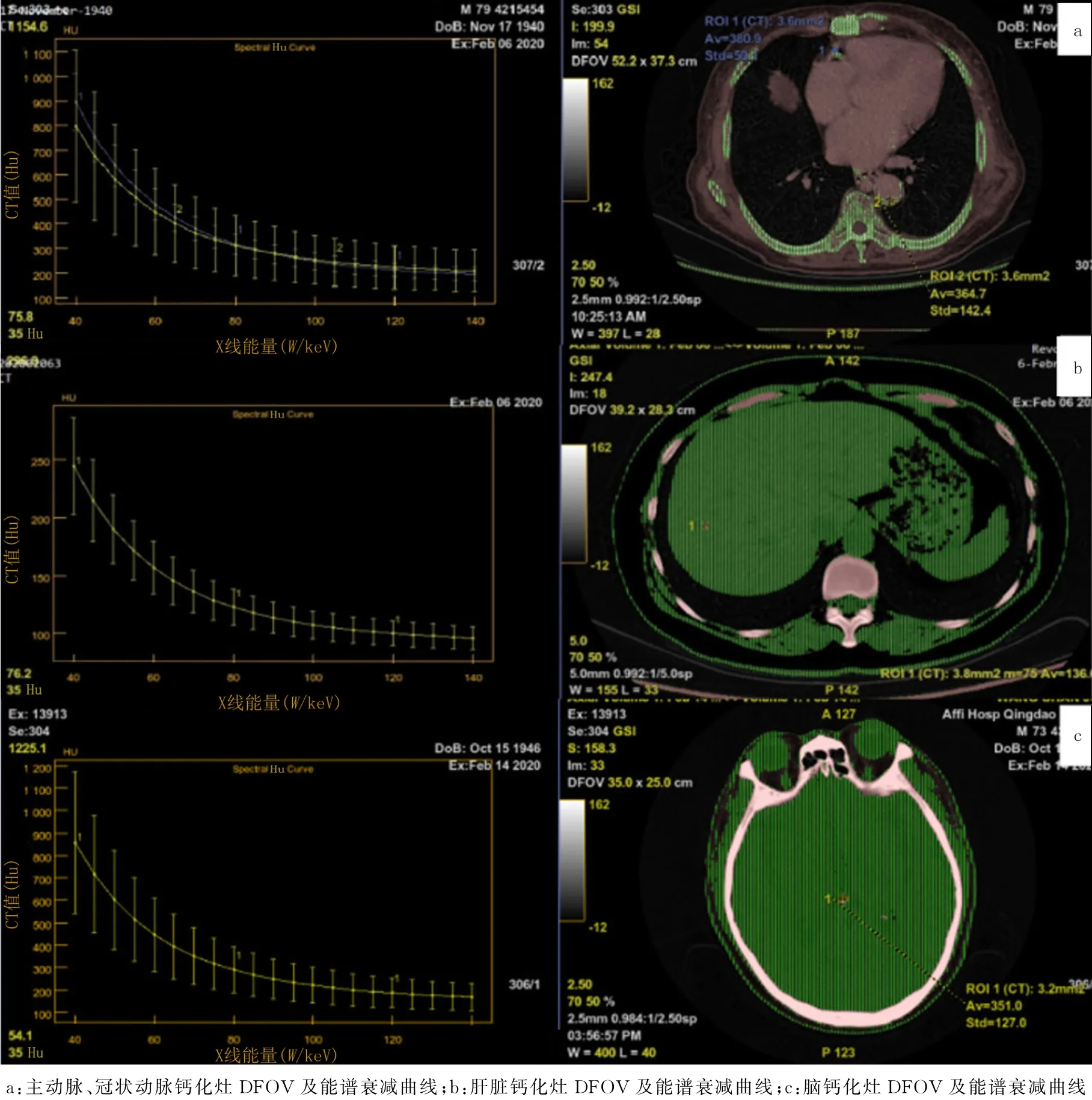
图2 不同组织钙化灶能谱测量
1.3 能谱CT 扫描方法
应用医用能谱CT 即128层双能CT(GE,Milwaukee,Wisconsin,USA)进行扫描。扫描参数如下:管电流200 m A,层厚和重建间隔均为5 mm,DFOV=20 cm2,间距为0.531∶1,像素间距为0.430 mm;螺旋式瞬时开关140~80 k Vp。DFOV测量3次计算平均值,图像重建和分析使用AW 4.7高级工作站进行(AW 4.7,GE Healthcare,USA),图像储存及调阅均通过PACS系统进行。
1.4 统计学处理
应用SPSS 16.0 统计软件包进行分析。符合正态分布的计量资料数据采用±s表示,多组数据比较采用方差分析(ANOVA),两两比较应用LSDt检验;非正态分布计量资料以M(IQR)表示,数据间比较应用Mann-WhitneyU检验。相关性采用Pearson相关分析。以P<0.05表示差异有显著性。
2 结 果
2.1 椎间盘(后纵韧带、椎体后缘)骨化与钙化病理特点比较
病理观察显示,骨化灶在钙化软骨/骨细胞区域基础上向远处延伸,骨化灶均匀而呈现“梁式结构”,内面不含骨细胞,骨化灶内无裂隙亦无结缔组织填充,骨化灶致密而与周围组织界限明显(图3a)。钙化灶聚集在纤维环边缘,裂隙宽而其间缺乏胶原与结缔组织,钙化灶结构松散且独立于正常纤维软骨细胞巢,与病灶内散在的软骨细胞巢呈“同心环形”排列(图3b)。
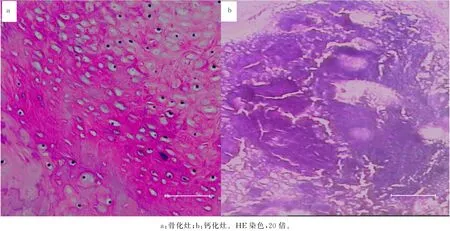
图3 骨化灶与钙化灶的组织病理特点
2.2 不同病灶70 ke V 处关注视野窗DFOV 能谱均值比较
主动脉、冠状动脉、脑、肝脏钙化灶70 ke V 处能谱值分别为(364.7±1.6)、(364.2±1.3)、(365.6±3.2)和(322.6±13.4)Hu,各组比较差异具有显著性(F=116.1,P<0.05),其中肝脏钙化灶70 keV 处能谱值低于其他各组(P<0.05),主动脉、冠状动脉、脑钙化灶70 keV 处能谱值差异无显著性(P>0.05)。除肝脏外钙化灶的形成方式基本一致,由于椎间盘钙化组病例较少,视为不符合正态分布,故以其他组织钙化灶70 ke V 处能谱值与骨化灶进行比较。结果显示,椎间盘钙化灶70 ke V 处的能谱值((213.2±6.3)Hu)低于骨化灶((357.3±5.4)Hu),差异有显著性(t=87.02,P<0.05)。
2.3 椎间盘骨化组与钙化组70 ke V 条件8%像素处原子序数分布密度比较
椎间盘骨化组与钙化组70 ke V 条件下的钙含量密度分布图(即有效原子序数直方图,图4a、b)显示,钙化灶大部分体素含钙量在60~100 mg/cm3之间(中位数59.5 mg/cm3),而骨化灶大部分体素含钙量在180~280 mg/cm3之间(中位数251.0 mg/cm3),钙化灶体素含钙量的平均分布也明显低于骨化灶(Z=2.70,P<0.01)。此外,具有骨结构的骨化灶原子序数分布较为均衡,钙化灶原子序数分布接近于偏态分布,提示骨化灶结构较钙化灶整齐且分布更为规则有序(图4c)。
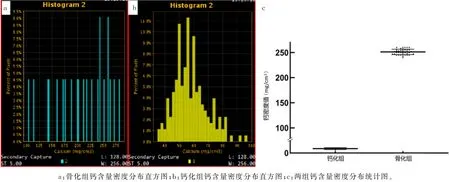
图4 骨化组与钙化组70 keV条件8%像素处原子序数密度分布比较
2.4 椎间盘骨化组与钙化组总体钙盐平均密度散点图及水密度-钙密度回归关系比较
对椎间盘骨化灶及钙化灶的DFOV 分别进行钙-水基图像生成分析,得到两种病灶钙盐平均密度散点图(图5a、b),并对所得散点(水密度-钙密度)进行曲线拟合,结果显示,骨化灶散点分布符合Y=0.87X-858.5线性关系(r2=0.89);钙化灶散点分布符合Y=1.31X-1 348.0线性关系(r2=0.88),两组均呈现正相关关系。总体钙盐平均密度拟合曲线斜率骨化组为0.87、钙化组为1.31。散点图密度分布分析显示,骨化组钙盐平均密度分布高于钙化组(Z=1.90,P<0.05)。见图5c、d。
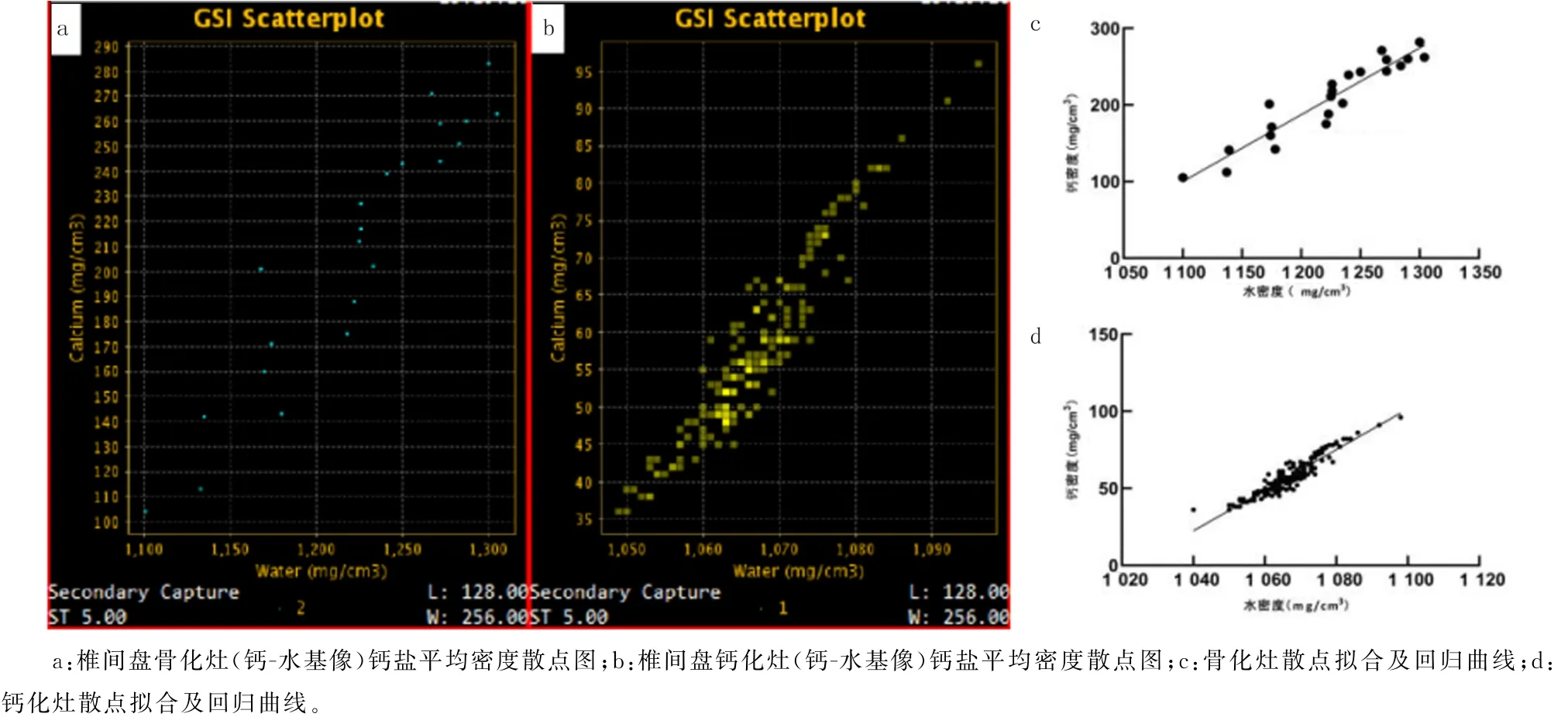
图5 钙化灶与骨化灶钙-水基图像钙盐密度散点及回归分析
3 讨 论
能谱CT 技术主要有单能量成像技术、能谱曲线、物质分离、有效原子序数测定等[6],对骨科术后置入金属的伪影干扰问题解决具有较大的优势[7]。目前研究证实,利用能谱CT 定量测量钙(水)密度值,获得骨小梁中钙的含量可以间接评估骨密度,此方法与骨密度测量的“金标准”有较好的一致性[8],但是在骨科退变性疾病诊断中还没有得到较好的应用。在临床中经常会遇到常规CT 无法鉴别的病变[9],其中椎间盘钙化与骨化的鉴别是长久以来的难点所在[10]。
钙化与骨化是不同原因所致组织钙的异常沉积而导致的硬化,钙化病理过程是钙盐在非骨样基质上的无定型沉积,骨化则是钙在骨样基质上的定型沉积,两种病理改变的过程及病灶硬化的程度不尽相同。成人特发性椎间盘钙化多见于椎间盘“边缘型”钙化,经过一系列复杂的吸收过程形成钙化结局[11]。本文病理检查可见,钙化灶聚集在纤维环边缘,与病灶内散在的软骨细胞巢呈“同心环形”排列。椎间盘边缘骨化、椎体后缘骨化常见于退行性骨及软骨病变,组织来源不同,但都是由于钙盐沉积于对应的组织中,骨细胞参与骨化灶形成,使得钙盐形成骨结构沉积,其病因及形成过程目前仍不清楚[12]。本研究病理观察显示,骨化灶在钙化软骨/骨细胞区域基础上延伸,骨化灶均匀而呈现“梁式结构”,骨化灶致密而与周围组织界限明显。
在脊柱手术过程中,常见由椎间盘层面上突入椎管的赘生组织存在,这些以钙盐沉积为特征的病灶多为骨化和钙化灶,轻者对脊髓功能无影响,重者影响神经功能,手术切除减压成为该类病变治疗的主要手段[13]。然而在选择手术入路时,脊柱外科医师通常会给予病灶处系统的X 线、CT、MRI检查以明确病灶性质,以便制定风险较小的神经减压方式,但是常规CT 无法准确反映病灶硬度及其性质[14],由此常造成预判失误。
能谱CT 是利用两种物质对不同能量的X 线具有不同且特异性强的吸收特点成像,与常规的单一能量CT 成像比较,其最大优势就是可以用不同的物质衰减特征手段和方法来鉴别单纯应用CT 值难以区分的类似物质[15]。本文研究比较了钙化灶及骨化灶能谱曲线,结果显示钙化灶曲线位于骨化灶曲线下方,说明钙化灶与骨化灶能谱不同、物质性质不同;同时观察到肝、脑、冠状动脉、主动脉钙化灶能谱曲线走势均相似,说明病灶内物质种类相似,但病灶硬度性质不同;在70 ke V 条件下钙化灶的物质平均CT 值低于骨化灶,说明骨化灶致密程度要高于钙化灶。本文研究还显示,70 ke V 条件下,钙化灶钙含量的平均分布明显低于骨化病灶;具有骨结构的骨化灶原子序数分布较为均衡,钙化灶原子序数分布接近于偏态分布,骨化灶结构较钙化灶整齐且分布更为规则有序,说明钙化与骨化虽然成分组成类似但是其结构不同。本文对钙-水基像散点图分析显示,钙化灶钙含量低于骨化灶,即骨化灶总体钙盐平均密度较高。根据能谱CT 测定物质的原理,任何一种物质衰减可以用两种“基物质”表达[16];本文钙化灶斜率>骨化灶斜率,所得能谱曲线显示钙化灶比骨化灶能量衰减慢,即曲线较平缓,这解释了常规多能量CT 扫描两种含钙近似病灶所得CT 值相近的原因,由此有理由将斜率值作为钙盐无定型沉积效率[17]。通过能谱CT 对成分类似而结构不同病灶性质进行分析,可以更加清楚地显示病灶结构与成分之间的关系,全面显示病灶特性和功能状态,在判定其他病变如肿瘤、炎症方面也具备较大优势[18]。但本研究也存在相对不足,由于椎间盘钙化临床发病率极低,常以个案报道出现,故较小的样本量存在一定统计学偏倚,其结论还有待进一步的研究证实。
综上所述,外科对钙盐沉积的鉴别重点在于估计其硬度,相同条件下与病灶硬度相关的几个重要因素包括钙盐种类、钙盐绝对含量和钙盐沉积方式(排列、结构)。能谱CT 可鉴别病灶性质,柱状原子序数测定可估计钙盐绝对含量及排列结构情况,而钙-水基图像散点图可显示钙盐沉积方式信息,三者综合可判定病灶情况,据此制定精准手术方案。
