絮体粒径对生物絮团系统中硝化作用的影响
2021-11-23陈晓庆罗国芝谭洪新吴慧芳蒙浩焱
陈晓庆,罗国芝,2,3,谭洪新,2,3,吴慧芳,蒙浩焱,黎 爽
( 1.上海海洋大学,上海水产养殖工程技术研究中心,上海 201306; 2.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306; 3.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306 )
集约化生产方式使水产养殖的放养密度和高蛋白饲料的投放量明显增加。氨氮是蛋白质代谢的最终产物之一。据估算,氨氮产生量约为投喂饲料蛋白质的9.2%[1]。氨氮的积累会直接抑制养殖动物的生长,降低其存活率[2]。水体中氮素的去除主要是通过硝化作用和反硝化作用[3-5]。在生物絮团—水产养殖系统中,硝化现象普遍发生[6]。水体中的硝化作用受一系列因素影响,如环境因子、生态因素、生物因子等[7]。硝化过程通常发生在有机物浓度较低的环境中[8],硝化效率在一定范围内随着碳氮比的增加而降低[9]。生物絮团主要由浮游生物、细菌、原生动物和颗粒有机体等组成[10];絮体形状不规则,可压缩性强,具有高度渗透性(超过99%的穿透力),且随液体渗透而不固定[3,11-17]。絮团的絮体粒径变化区间大,从几微米到几百微米甚至数千微米,高度多孔,比表面积为20~100 cm2/mL。通常认为,生物絮团—水产养殖系统中稳定的生物絮团大小为50~1000 μm[12]。这些物理和生物特性,使生物絮凝技术反应器具有吸附、絮凝固体颗粒物并对其进一步利用的潜能。在生物絮团—水产养殖系统中,生物絮团的絮体粒径可能与培养对象对絮团的摄取能力、消化率以及营养价值有关[3]。
随着对生物絮团的深入研究,已有生物絮团影响因素碳源、碳氮比、水体混合强度、水力停留时间、pH、溶解氧、温度、碱度、盐度和反应器结构及活性污泥粒径等方面的报道,但对生物絮团絮体粒径的相关研究还较少。笔者从絮体本身出发,以50 μm粒径滤膜截留絮团附着细菌,未被50 μm粒径滤膜截留的非附着细菌,再采用0.22 μm粒径滤膜截留[4,18],运用高通量测序技术,揭示絮体内部微生物多样性,为进一步研究生物絮团各反应阶段的微生物组成比例变化提供数据基础,对探究生物絮团硝化作用具有重要的指导意义。
1 材料与方法
1.1 试验装置及材料
试验于上海海洋大学循环水养殖工程与技术实验室进行。生物絮团反应器为9个7 L有机玻璃圆锥体反应器,全高30 cm,锥高4 cm,内径18.5 cm,外径20 cm,有效容积5 L。选用的气泵功率为138 W、曝气量为100 L/min,通过分接器和软管在每个反应器中设置2个曝气头(直径3 cm、高3.5 cm的石英砂聚合气石),为水体提供氧气和搅拌。
1.2 试验设计
试验开始前50 d,在3个150 L养殖水桶培养稳定良好的絮体(图1)[19]。各水桶中投入150 g磨碎后的宝石鲈鱼饲料,初始总悬浮固体物质量浓度1000 mg/L。通过添加碳酸氢钠调控碱度保持在150 mg/L(以碳酸钙计,下同)。试验期间除了补充因蒸发而损失的水分外,不换水。一台罗茨鼓风机供氧(型号HG-750,浙江森森集团股份有限公司),采用间歇式曝气方式(曝气8 h,停止16 h)将系统进行闷曝72 h后开始添加碳源[20]。试验开始时一次性投入足够的葡萄糖,使系统中碳氮比为15。
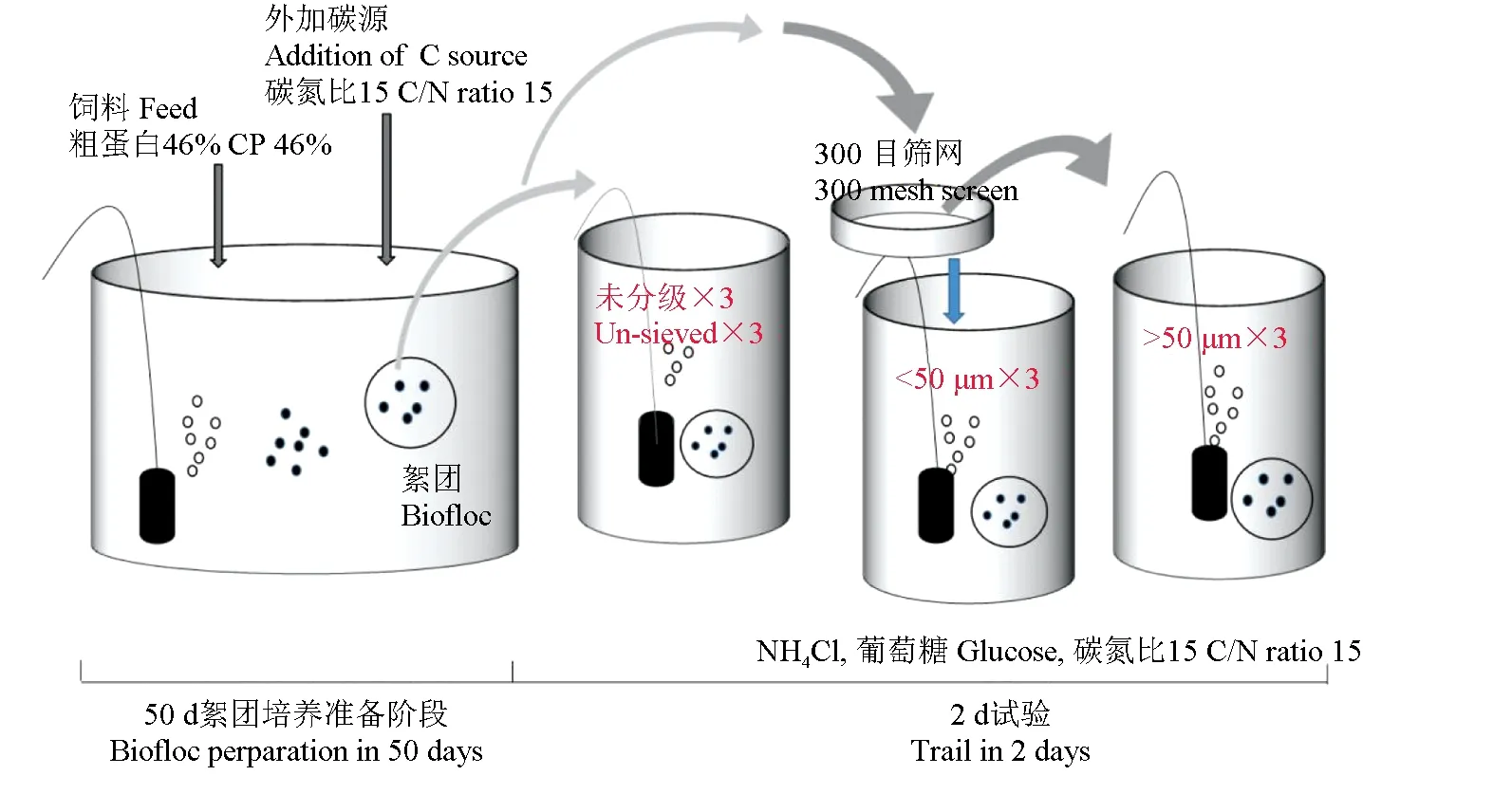
图1 试验设计图[21]Fig.1 Experiment design
待水体中氨氮、亚硝态氮降至最低值,视为系统稳定构建,取3个空桶标记A、B、C。A桶为未分级絮体组;将前期培养絮体过300目筛网,经筛网滤过的絮体分入B桶;截留在筛网上的絮体分入C桶,C桶水体取自原絮体静置5 h后的上清液。3个桶经充分曝气后,分别取15 L注入9个有效容积为5 L的反应器中培养不同粒径生物絮团。试验分3组,每组3个平行:A组为未分级絮体组,B组为<50 μm絮体组,C组为>50 μm絮体组。反应器中分别以氯化铵和葡萄糖作为氮源和碳源,以碳氮比为15分别加入0.19 g氯化铵和1.88 g葡萄糖进行10 mg/L氨氮转化试验。取试验初始水样(A、B、C组各3个)和氨氮转化结束水样(A、B、C组各3个)各50 mL,经0.22 μm孔径滤膜抽滤后将滤膜于-80 ℃冰箱保存,试验结束后送至上海美吉生物科技有限公司进行高通量测序。
1.3 试验指标与测定方法
1.3.1 水质指标的测定
每隔1 d检测水体的温度、pH、溶解氧,并测定水体总氮、总氨氮、亚硝态氮、硝态氮和溶解性有机碳。总氮采用过硫酸钾氧化—紫外分光光度法(型号UV2000,上海尤尼柯,中国,下同)测定。水样经0.45 μm孔径滤膜抽滤后测定三态氮及溶解性有机碳。其中亚硝态氮采用N-(1-萘基)-乙二胺比色法测定,硝态氮含量采用紫外分光光度法测定,总氨氮含量测定采用钠氏试剂法,溶解性有机碳含量使用多功能碳氮元素分析仪(Multi N/C 2100,德国)测定。
1.3.2 絮团成分指标的测定
总固体悬浮颗粒物采用称量质量法测定;絮团经65 ℃烘干后使用碳氮元素分析仪测定絮团中的碳元素和氮元素含量,将氮元素由粗蛋白平均系数6.25换算成粗蛋白含量。
1.3.3 生物絮团微生物样品的测定
按照Omega Water DNA Kit (Omega,USA)的说明,提取水体中的DNA。将提取得到的细菌总DNA通过微量紫外分光光度计(Nano Drop©ND-1000,美国)测定DNA质量浓度和纯度。采用通用引物338F(5′-ACTCCTACGGGA-GGCAGCA-3′)和806R(5′-GGACTACHVGG-GTWTCTAAT-3′)对絮团细菌16S rRNA基因的V3~V4区扩增,修饰后的通用引物含有不同的Tag标签用以区分不同样品。PCR扩增体系为20 μL:5×Fast Pfu Buffer 4 μL、2.5 mmol/L d NTPs 2 μL、Forward Primer(5 μmol/L) 0.8 μL、Reverse Primer(5 μmol/L) 0.8 μL、Fast Pfu Polymerase 0.4 μL、DNA模板10 ng,补双蒸水至20 μL。PCR扩增的反应条件:94 ℃,5 min;30×(94 ℃,30 s,54 ℃,30 s,72 ℃,45 s);72 ℃,10 min。每个样品3个平行,利用上海美吉生物医药科技有限公司的MiSeq PE300测序仪(Illumina Inc,美国)完成序列测定。
Miseq文库构建及Miseq测序:(1)通过PCR将Illumina官方接头序列添加至目标区域外端;(2)使用凝胶回收试剂盒TruSeqTM DNA Sample Prep Kit切胶回收PCR产物;(3) Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;(4)氢氧化钠变性,产生单链DNA片段。检测合格文库后,采用Miseq进行测序。
数据分析处理:采用Mothur软件将得到的16S rDNA基因序列在RDP数据库中进行嵌合体检验,充分去除嵌合体序列。为得到每个运算分类单元(OUT)对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的运算分类单元代表序列进行分类学分析,用Mothur软件构建稀释性曲线[15]。
1.4 去除效率计算公式
总氨氮去除效率(R,%)计算公式:
R=(ρ1-ρ2)/ρ1×100%
式中,ρ1为初始总氨氮质量浓度(mg/L);ρ2为终末总氨氮质量浓度(mg/L)。
1.5 数据分析
试验数据采用Excel软件进行结果统计,由Origin、Adobe Illustrator软件进行相关图表的绘制。试验数值用平均值±标准差形式表示,采用SPSS 17.0统计软件对数据进行单因素方差分析,P<0.05为差异显著。
2 结果与分析
2.1 絮体培养阶段水质及三态氮的动态变化
试验前50 d稳定絮体培养阶段的三态氮及总氮变化趋势见图2。生物絮团在第43天亚硝态氮降至最低并趋于稳定,絮体基本形成。试验期间,各组温度18.4~28.4 ℃,溶解氧7.5~9.6 mg/L、pH 7.7~9.0,因前期絮体培养阶段加入少许盐,水体盐度7.1~7.7,各组环境指标组间差异不显著(P>0.05)。3个处理组的碱度均维持在155~240 mg/L。

图2 絮体培养阶段三态氮及总氮的动态变化Fig.2 Dynamics of total ammonia-N, nitrite-N, nitrate-N and total nitrogen in the water in the 3 different groups
2.2 氨氮的转化
溶解性有机碳质量浓度及总氨氮质量浓度计算见图3。3组反应器中溶解性有机碳含量与总氨氮含量的初始比值分别为16.24、15.01、14.07。试验期间,pH、溶解氧、温度等水质指标见表1,各组温度22.0~23.5 ℃、溶解氧8.2~8.7、pH 8.2~8.6,各组环境指标组间差异不显著(P>0.05)。3个处理组的碱度均维持在250 mg/L,氨氮快速转化期间3个处理组碱度波动范围差异不显著(P>0.05)。
3组反应器初始氨氮质量浓度分别为(8.43±0.13)、(9.71±0.07)、(10.52±0.44) mg/L,在第2 h,3组氨氮均达到峰值,分别为(16.46±1.34)、(17.93±1.91)、(18.62±1.19) mg/L,下降后均有回升,最后趋于稳定快速下降。3组反应器均在12 h基本将10 mg/L总氨氮同化去除完毕,氨氮去除率分别达97.33%、95.28%和95.09%(图3a);总体上看,3组反应器对氨氮的同化去除速度是一样的,3个处理组的氨氮变化差异不显著(P>0.05)。反应过程中亚硝态氮有反复出现小幅度“先升后降”的趋势,3组间差异不显著(P>0.05)(图3b)。3组反应器硝态氮含量升降起伏明显,均有少量增加后降低趋势,并低于初始值,3组反应器硝态氮变化差异不显著(P>0.05)(图3c)。到反应结束,未额外产生亚硝态氮和硝态氮,与已有的研究结果[1]相符。溶解性有机碳质量浓度呈持续下降趋势(图3d),不同絮体粒径组溶解性有机碳变化差异不显著(P>0.05)。
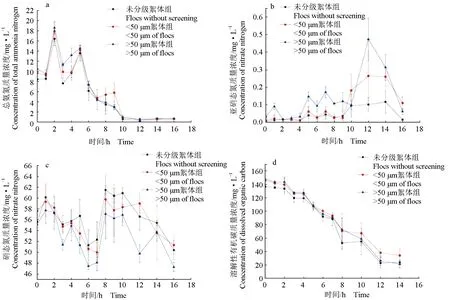
图3 10 mg/L氨氮快速转化期间3个处理组中总氨氮(a)、亚硝态氮(b)、硝态氮(c)及溶解性有机碳(d)的动态变化Fig.3 Dynamics of total ammonia-N (a), nitrite-N (b), nitrate-N (c) and dissolved organic carbon (d) in the water in the 3 different groups during rapid conversion of 10 mg/L ammonia-N

表1 10 mg/L氨氮快速转化期间3个处理组中各水质指标的平均值、最小值和最大值
2.3 絮团总固体悬浮物及粗蛋白
每组反应器取3个样品进行总悬浮固体物测定,以确定初始的总悬浮固体物质量浓度。10 mg/L氨氮快速转化试验中,3组初始总悬浮固体物分别为(720.33±52.21)、(693±58.28) mg/L和(753.67±59.55) mg/L。3组的总悬浮固体物质量浓度在12 h内的变化均有所升高,同时段不同粒径处理组之间总悬浮固体物质量浓度差异不显著(P>0.05)(图4)。由表2可见,不同粒径处理组对絮体粗蛋白含量差异不显著(P>0.05)。
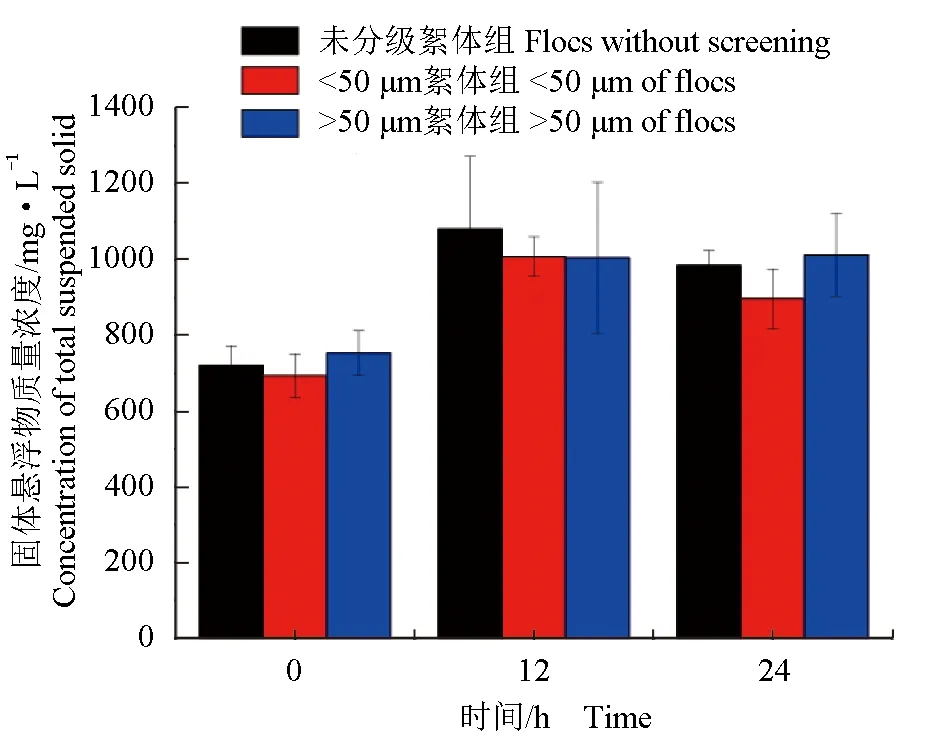
图4 氨氮快速转化期间3个处理组絮团中总固体悬浮物含量Fig.4 Contents of total suspended solids in the 3 different biofloc treatment groups during the rapid ammonia-N transformation period
2.4 微生物序列数目和多样性
分别取初始0 h时间段与终末12 h时间段絮团进行高通量测序多样性分析,絮体细菌原核16S序列数目和平均长度见表3。初始絮团更能准确反映不同粒径的微生物群落丰度、多样性差异。通过比较sobs、ace和chao指数分析可知,初始微生物丰度由大到小排序为:<50 μm絮体组,>50 μm絮体组,未分级絮体组;由表3可见,初始微生物多样性由大到小排序为:未分级絮体组,>50 μm絮体组,<50 μm絮体组;3个组处理组Shannon值差异不显著(P>0.05)。终末时段各组微生物群落多样性相对初始时段均有所降低。
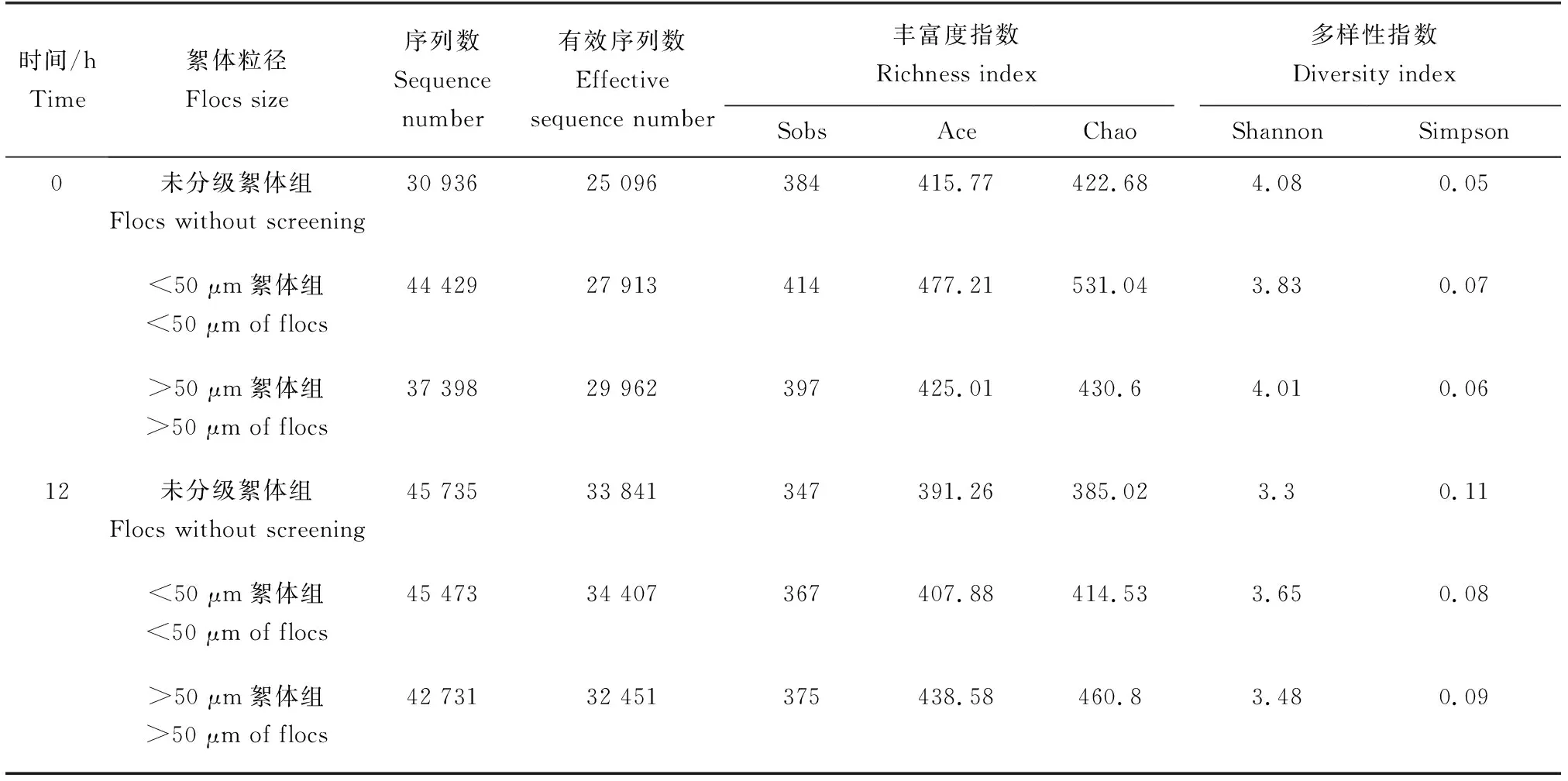
表3 不同絮体粒径组絮团微生物群落丰富度和多样性指数
2.5 微生物群落组成分析
10 mg/L氨氮快速转化期间,在门水平上,3组絮团样品中微生物群落结构组成情况相似,但各种微生物所占比例略有差异(图5a)。样品中微生物主要隶属于12个门,初始时段絮团最能客观反映不同粒径絮团中生物群落组成差异。试验初始0 h时,变形菌门(未分级絮体组36.69%,<50 μm絮体组28.19%,>50 μm絮体组31.02%)和放线菌门(未分级絮体组28.30%,<50 μm絮体组23.98%,>50 μm絮体组29.60%)占主要优势,其他优势菌门分别为拟杆菌门(未分级絮体组11.66%,<50 μm絮体组10.15%,>50 μm絮体组10.38%)、厚壁菌门(未分级絮体组6.26%,<50 μm絮体组20.57%,>50 μm絮体组8.53%),绿弯菌门(4.49%~5.81%)、浮霉菌门(2.44%~2.75%)、芽单胞菌门(1.22%~1.73%)和疣微菌门(1.02%~1.99%)等。<50 μm絮体组厚壁菌门丰度显著高于未分级絮体组和>50 μm絮体组(P<0.05),其余菌门细菌差异不显著(P>0.05)。12 h后,3组絮体样本的变形菌门和放线菌门的细菌数量均有所增加,变形菌门(未分级絮体组51.88%,<50 μm絮体组44.85%,>50 μm絮体组44.91%)成为主要优势菌,其次是放线菌门(未分级絮体组32.39%,<50 μm絮体组29.62%,>50 μm絮体组34.31%),其余菌群在数量上均有所减少。各组微生物在门水平上的组成分布与本试验之前的研究结果[20]一致。
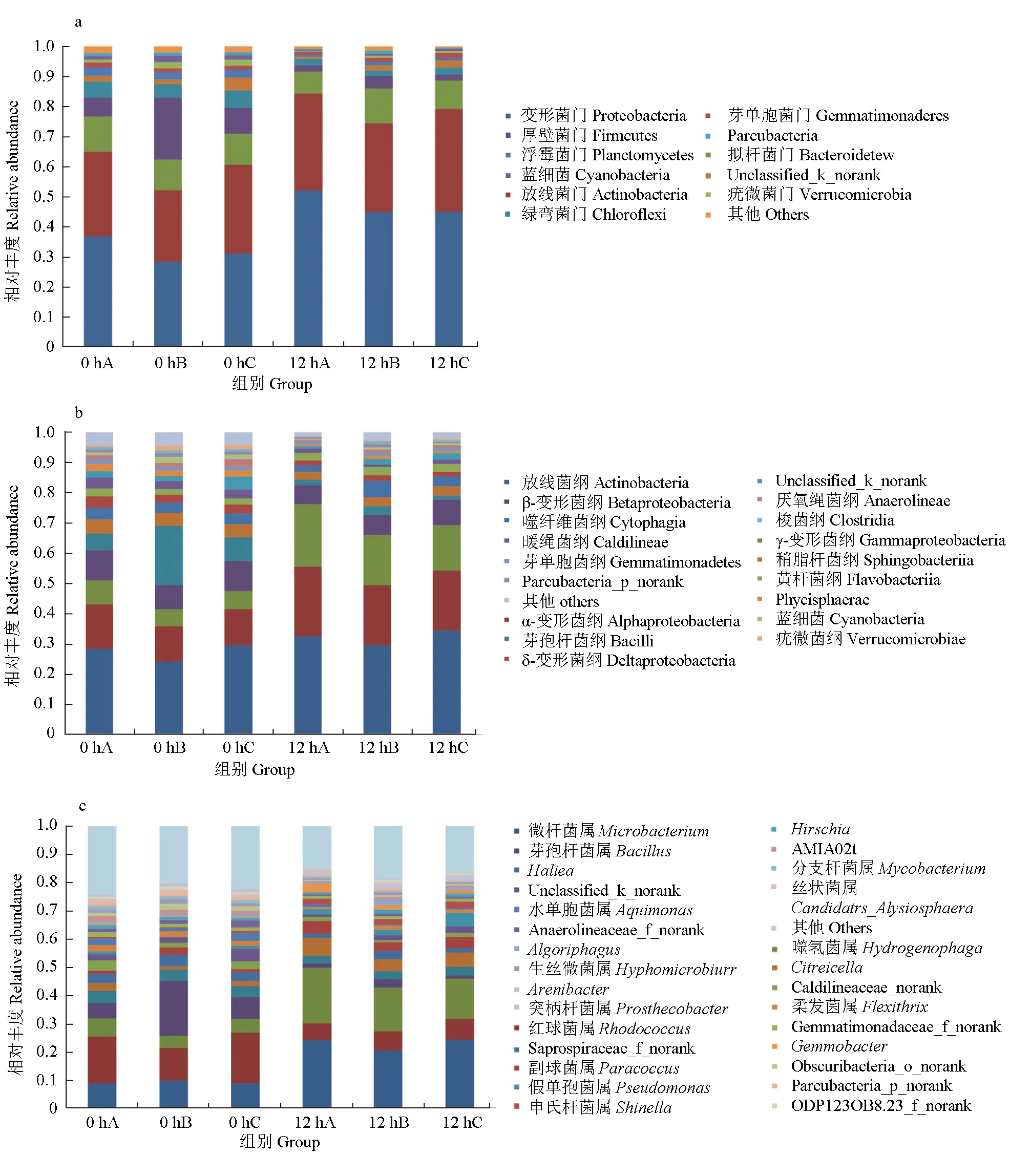
图5 氨氮快速转化不同时间点3组粒径絮体在门(a)、纲(b)、属(c)水平上群落结构组成分布Fig.5 The composition and distribution of community structure at different time on the phylum(a), class(b) and genus(c) levels in the three different treatment groups throughout the rapid ammonia nitrogen conversion periodA.未分级絮体组; B.<50 μm絮体组; C.>50 μm絮体组.A.flocs without screening; B.<50 μm of flocs; C.>50 μm of flocs.
纲的分类水平上,3组絮体主要菌纲有放线菌纲(未分级絮体组28.30%,<50 μm絮体组23.98%,>50 μm絮体组29.60%)、α-变形菌纲(未分级絮体组14.70%,<50 μm絮体组11.81%,>50 μm絮体组11.85%)、γ-变形菌纲(未分级絮体组9.91%,<50 μm絮体组8.03%,>50 μm絮体组9.87%)、β-变形菌纲(未分级絮体组8.03%,<50 μm絮体组5.63%,>50 μm絮体组6.08%)和芽孢杆菌纲(未分级絮体组5.51%,<50 μm絮体组19.55%,>50 μm絮体组7.78%),<50 μm絮体组芽孢杆菌纲显著高于未分级絮体组和>50 μm絮体组(P<0.05)(图5b)。鞘脂杆菌纲、噬纤维菌纲、δ变形菌纲、黄杆菌纲、暖绳菌纲、芽单胞菌纲、蓝细菌、梭菌纲等丰度均低于5%,且不同粒径絮团差异不显著(P>0.05)。
属的分类水平上,将相对比例小于0.5%的归为其他,占21.37%~24.51%(图5c)。未分级絮体组和>50 μm絮体组优势菌属包括红球菌属(Rhodococcus)(未分级絮体组16.45%,>50 μm絮体组17.84%,<50 μm絮体组11.58%)、微杆菌属(Microbacterium)(未分级絮体组8.91%,>50 μm絮体组8.86%,<50 μm絮体组9.69%)和噬氢菌属(Hydrogenophaga)(未分级絮体组6.50%,>50 μm絮体组4.41%,<50 μm絮体组4.89%);此外,<50 μm絮体组中芽孢杆菌属(Bacillus)(<50 μm絮体组19.49%,未分级絮体组5.40%,>50 μm絮体组7.71%)显著高于其他两组(P<0.05)。其余菌属副球菌属(Paracoccus)、Caldilineaceaenorank、假单胞菌属(Pseudomonas)、柔发菌属(Flexithrix)、水单胞菌属(Aquimonas)、申氏杆菌属(Shinella)、Gemmobacter、Algoriphagus、生丝微菌属(Hyphomicrobium)、分支杆菌属(Mycobacterium)、Arenibacter、丝状菌属(Candidatus_Alysiosphaera)、突柄杆菌属(Prosthecobacter)及不知名属等均低于5%。
3 讨 论
3.1 不同絮体粒径对氮素转化的影响
Yang等[22]研究发现,当水体中氨氮的质量浓度大于10 mg/L时,水体中硝化细菌的硝化反应将会受到抑制。本试验中氨氮转化监测发现,试验前2 h氨氮质量浓度先升后降,亚硝态氮、硝态氮均有小幅下降再回升,可能是此时段硝化反应提速。而后,在碳源充足的条件下,生物絮团异养细菌的同化作用快于水体中硝化细菌的硝化作用。8 h后,氨氮持续降低,亚硝态氮、硝态氮开始上升,说明此时絮团进行硝化过程。
3.2 不同絮体粒径絮团的营养成分和微生物群落组成
本试验中,生物絮团中粗蛋白水平分别为(31.91±1.58)%、(34.40±0.39)%、(34.67±1.59)%,与Emerenciano等[23]在圣保罗对虾(Farfantepenaeuspaulensis)养殖系统中用蔗糖和麦麸作为碳源,Xu等[24]在凡纳滨对虾(Litopenaeusvannamei)养殖系统以蔗糖作为碳源,其所培养生物絮团中粗蛋白水平一致,说明生物絮团是一种水产动物潜在的重要食物来源。在生物絮团系统中添加碳源可以提高微生物群落的多样性、稳定性和缓冲性[25-27]。本试验结果显示,随着碳源的添加,生物絮团异养微生物的生物代谢率远高于硝化细菌的生物代谢率,生物絮团微生物群落结构转变成以变形菌门、厚壁菌门、放线菌门、拟杆菌门为优势菌的结构。已有研究证实了生物絮团系统微生物群落结构的变化情况[6,27]。随着溶解性有机碳的降低,微生物群落多样性降低。本次试验絮体检测后均发现,<50 μm絮体组中芽孢杆菌属为主要优势菌属,且显著高于其他两组,说明粒径对厚壁菌门
芽孢杆菌的含量影响显著。
3.3 不同絮体粒径对絮团功能的影响
组成生物絮团的细菌群落是复杂多样的,需要借助功能基因的研究来揭示细菌群体感应的影响机制和作用机理。异养细菌是生物絮团系统中总氨氮去除的主要力量[28]。本试验结果显示,在两次氨氮快速转化过程中均发现变形菌门、放线菌门、拟杆菌门、厚壁菌门、绿弯菌门、浮霉菌门和芽单胞菌门等异养细菌,其中放线菌和拟杆菌是常见的益生菌[29]。变形菌门细菌的功能主要是清除水中有机物[30-31],变形菌门占据优势菌群,对有效调节水质起到至关重要的作用。浮霉菌门的细菌具有介导参与厌氧氨氧化,使亚硝态氮和氨氮直接转化成氮气的能力[32]。厚壁菌门为革兰氏阳性、低G+C含量的一类原核微生物[33]。芽孢杆菌纲和梭菌纲构成了厚壁菌门的主体。其中芽孢杆菌纲内的物种由于大多可形成抗逆性极强的芽孢,因而具有极强的环境适应性。迄今为止,已筛选出的异养硝化—好氧反硝化菌主要集中于副球菌属、假单胞菌属、不动杆菌属(Acinetobacter)与芽孢杆菌属等。本试验中,氨氮快速转化絮团中均检测到芽孢杆菌,芽孢杆菌是一类重要的产絮菌[34-35],具有异养硝化—好氧反硝化能力[36],能改善养殖用水水质[37],作为饲料添加剂使用时可促进养殖动物生长,提高机体免疫及抗病能力[38-40]。本试验在絮团中均检测到芽孢杆菌属,分析菌群丰度可知,芽孢杆菌属在<50 μm絮体组中为主要优势菌,丰度显著高于其他两组。
4 结 论
本试验结果显示,3组不同粒径絮体组对氨氮的同化去除速度相同,对水体中氨氮快速转化效果差异不显著。高通量测序技术检测结果表明,不同粒径絮体组在门、纲、属水平上的微生物群落组成基本相似,生物絮团培养过程中主要生物类群隶属于6个纲即放线菌纲、α-变形菌纲、β-变形菌纲、γ-变形菌纲、芽孢杆菌纲和鞘脂杆菌纲。在属水平上,红球菌属、微杆菌属、噬氢菌属和芽孢杆菌属为优势菌属,其余为副球菌属、假单孢菌属、水单胞菌属、分支杆菌属、丝状菌属等多个菌属和一些未知菌属。氨氮快速转化絮团检测结果显示,<50 μm絮体组厚壁菌门(芽孢杆菌属)菌群丰度显著高于其余两组,粒径对厚壁菌门(芽孢杆菌属)的含量影响差异性显著;碳源添加可以提高微生物群的多样性、稳定性,随着溶解性有机碳的降低,微生物多样性降低。由试验结果可知,控制生物絮团—水产养殖中絮体粒径<50 μm的絮团占主要地位,有利于芽孢杆菌的富集生长,对调控同化作用和硝化作用的竞争关系起至关重要的作用。
