左归丸促进K562细胞向红系分化的分 子 机 制*
2021-11-22赵汗青张群秀王文娟
赵汗青,张群秀,王文娟
(首都医科大学中医药学院,北京 100069)
肿瘤相关性贫血(cancer related anemia,CRA)为恶性肿瘤常见伴随疾病之一,是肿瘤患者在疾病发展及治疗过程中发生的贫血。临床主要表现为红细胞数及压积下降,血红蛋白浓度降低。患者可出现疲乏、头晕、食欲减退、消化不良、呼吸困难等症状。国内外研究表明,肿瘤患者贫血发生率为30%~90%[1-2]。贫血不仅对肿瘤患者的体能、精神状态和生活质量产生影响,还可引起肿瘤组织乏氧从而影响放化疗效果[3],导致肿瘤耐药[4],促进肿瘤转移[4],增加患者死亡风险。据报道,肿瘤伴贫血患者的平均生存期可缩短20%~43%[5]。因此,贫血已成为肿瘤的一个独立预后不良因素[6]。
目前临床改善贫血的方法主要有治疗潜在病因、输注红细胞、补充铁剂、使用红细胞刺激因子等[7],然而诸方法均存在一定的局限,导致抗贫血治疗尚不能达到满意的疗效。中医药改善贫血多从健脾补肾、益气养血入手,具有疗效稳定、副作用小等优势[8]。为进一步阐明补肾生血法改善贫血的机制,本研究采用具有红系分化潜能的人髓性红白血病K562细胞为模型,以补肾生血法代表方左归丸血清进行干预,通过检测细胞增殖、红系分化相关指标,明确其调控红系分化的机制,以期为临床有效防治肿瘤相关性贫血提供实验依据。
1 材 料
1.1 实验动物SPF级健康雄性SD大鼠16只,体质量(250±20)g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006,实验动物合格证号:110011191 1018409。将大鼠饲养在屏障级动物室,采用12 h循环照明,温度(25±1)℃,湿度70%,自由摄食、饮水,适应性饲养3 d。本研究经首都医科大学实验动物伦理委员会批准,伦理编号:AEEI-2017-036。
1.2 细胞株K562细胞株(北京泰科兰博科技有限公司)。
1.3 药物与试剂 左归丸,方药组成:熟地黄24 g,炒山药12 g,枸杞子12 g,山萸肉12 g,川牛膝9 g,菟丝子12 g,鹿角胶12 g,龟甲胶12 g,上述中药饮片购自北京同仁堂药店。
RPMI 1640不完全培养液(江苏凯基生物技术股份有限公司,批号:KG023945);胎牛血清(上海碧云天生物技术有限公司,批号:011717170405);Cell Counting Kit-8试剂盒(日本同仁,批号:FH783);瑞氏-吉姆萨复合染液(北京索莱宝科技有限公司,批号:20180201);FITC anti-human CD71(BioLegend,批号:B253417);FITC Mouse IgG2a,k Isotype Ctrl(BioLegend,批号:B269543);Cell Staining Buffer(BioLegend,批号:B264524);GAPDH(D16H11)XP Rabbit mAb(美国CST,批号:#5174);GATA-1(D52H6)XP Rabbit mAb(美国CST,批号:#3535);Anti-rabbit IgG HPR-linked Antibody(美国CST,批号:#7074);Simply P总RNA提取试剂盒(杭州博日科技有限公司,批号:C528H1a);Fast King cDNA第一链合成试剂盒(北京天根生化科技有限公司,批号:#R7025);SuperReal荧光定量预混试剂增强版(北京天根生化科技有限公司,批号:#R6620)。
1.4 主要仪器 定制型BD LSRFortessa SORP流式细胞分析仪(BD公司);DM6000B型正置荧光显微镜及图像分析系统(Leica公司);iD3型多功能基因蛋白检测仪(SpectraMax公司);FUSION FX6 XT型凝胶化学发光成像分析系统(VIVILBER公司);CFX96型荧光定量PCR仪(BIO-RAD公司)。
2 方 法
2.2 K562细胞分组、干预K562细胞培养于含RPMI 1640、10%胎牛血清、100 IU/mL青霉素、100 IU/mL链霉素的完全培养基中,37℃、5%CO2、饱和湿度条件下置培养箱中培养。
取对数生长期细胞,接种于培养板中,随机分为空白对照组、空白血清组、阳性对照组、左归丸血清组。空白对照组:在50%RPMI 1640完全培养基的基础上,加入50% RPMI 1640基础培养基;空白血清组:在50%RPMI 1640完全培养基的基础上,加入30% RPMI 1640基础培养基、20%空白血清;阳性对照组:在50%RPMI 1640完全培养基的基础上,加入49%RPMI 1640基础培养基、1% 50 mmol/L丁酸钠溶液;左归丸血清组:在50%RPMI 1640完全培养基的基础上,加入30%RPMI 1640基础培养基、20%左归丸血清。于培养箱中孵育48 h后收集细胞。
2.3 CCK8检测左归丸血清对细胞增殖活性的影响 取对数生长期细胞,调整密度为5×104个/mL,按100 μL/孔接种于96孔板中。分别加入5%、10%、15%、20%、25%左归丸血清,同时设空白对照组(无含药血清),每组3个复孔,于培养箱中分别培养24、48、72 h。每孔加入10 μL CCK8溶液,于培养箱中孵育2 h。酶标仪450 nm波长处测定OD值。
2.4 瑞氏-吉姆萨染色观察细胞形态 取对数生长期细胞,调整密度为4×105个/mL,按1 mL/孔接种于6孔板中,加药孵育48 h后收集细胞。离心去上清,PBS清洗2次,加PBS缓冲液50 μL重悬细胞。取10 μL细胞悬液滴在多聚赖氨酸黏附载玻片上,制成细胞涂片。涂片用4%多聚甲醛固定30 min,滴加瑞氏-吉姆萨染液,光镜下观察细胞形态。
2.5 光镜下计数联苯胺蓝染细胞阳性率 取对数生长期细胞,调整密度为4×105个/mL,按1 mL/孔接种于6孔板中,每组3个复孔,加药孵育48 h后收集细胞。离心去上清,PBS清洗2次,加PBS缓冲液400 μL重悬细胞。联苯胺染液和30%H2O2以50∶1混合,于96孔板中加9 μL染液和81 μL细胞,混合均匀,室温静置5 min。显微镜下计数200个细胞,计算蓝染细胞阳性率(%)。
2.6 酶标仪检测血红蛋白含量 取对数生长期细胞,调整密度为4×105个/mL,按1 mL/孔接种于6孔板中,每组3个复孔,分别加药孵育24、48 h后收集细胞。4℃1 000 r/min离心10 min,去上清液。PBS清洗1次,去上清。细胞中加入70 μL联苯胺溶液、70 μL 1%H2O2,混匀,4℃避光染色30 min,加入10%乙酸700 μL。按200 μL/孔加入96孔板中,酶标仪490 nm波长处测定OD值。
2.7 流式细胞仪检测CD71表达情况 取对数生长期细胞,调整密度为4×105个/mL,按1 mL/孔接种于6孔板中,在原分组基础上增加ISO同型对照,每组3个复孔。加药孵育24 h后收集细胞,离心去上清。用Cell Staining Buffer清洗2次,去上清。ISO组加入0.4 μL Isotype、99.6 μL Cell Staining Buffer,其余组分别加入2 μL CD71抗体、98 μL Cell Staining Buffer,4℃避光静置15 min。用Cell Staining Buffer清洗2次,去上清液。加入500 μL Cell Staining Buffer重悬细胞,上流式细胞仪检测细胞表面CD71荧光强度,分析CD71表达率(%)。
1990年新年,憨豆先生再次出现。原本这仅仅是一次喜剧表演。但该角色取得了成功,20世纪90年代,艾金森又拍摄了多部续集。最终,该剧被制作成为电影,艾金森从此成为国际影星。他的视觉喜剧风格让他获得了“带着橡皮脸的男人”的昵称。
2.8 Western blotting检测GATA-1蛋白表达情况 取对数生长期细胞,调整密度为1×106个/mL,按2 mL/孔接种于6孔板中,设6个复孔。加药孵育48 h后收集细胞,离心去上清,PBS洗2次。加入裂解液充分裂解,提取总蛋白。BCA试剂盒测蛋白浓度,调整蛋白浓度为2 μg/μL。蛋白上样量20 μg,依次电泳、转膜、封闭。加入目的蛋白GATA-1一抗(用TBST以1∶1 000稀释)5 mL和内参蛋白GAPDH一抗(用TBST以1∶1 000稀释)5 mL,4℃孵育过夜,洗膜;加入二抗(用TBST以1∶1 000稀释)5 mL;洗膜,ECL发光采集图像。采用Image J软件计算条带灰度值,以GAPDH为内参,计算GATA-1蛋白相对表达量。
2.9 Real-time PCR检测GATA-1 mRNA、EPO mRNA、EPOR mRNA表达情况 取对数生长期细胞,调整密度为1×106个/mL。按1 mL/孔接种于6孔板中,设7个复孔。加药孵育48 h后收集细胞,2 500 r/min离心4 min,去上清,PBS洗2次。按照试剂盒操作提取总RNA,反转录成cDNA,进行实时荧光定量PCR扩增。引物设计序列见表1。采用20 μL反应体系:cDNA 2 μL,上下游引物各0.6 μL,2×Super Real Pre Mix Plus 10 μL,RNase-Free dd H2O 6.8 μL。扩增条件:95℃15 min预变性,95℃10 s变性,60℃20 s退火,72℃32 s延伸,共40个循环。以GAPDH为内参,采用2-ΔΔCT法计算K562细胞中促红细胞生成素(EPO)、促红细胞生成素受体(EPOR)、红系特异性转录因子-1(GATA-1)的mRNA相对表达量。

表1 引物设计
2.10 统计学方法 使用SPSS 22.0软件进行统计分析。计量资料符合正态分布者采用“均数±标准差”(±s)表示;组间比较采用单因素方差分析,方差齐者两两比较采用LSD法,方差不齐者采用Dunnett’s T3法。以P<0.05为差异有统计学意义。
3 结 果
3.1 左归丸血清不同浓度、干预时间对K562细胞增殖活性的影响 干预24、48、72 h,左归丸血清在5%~20%浓度范围内均存在着明显的量效关系,且随着左归丸血清浓度增加,K562细胞增殖活性逐渐降低。经统计分析,与空白血清组比较,各浓度左归丸血清组K562细胞增殖活性均明显降低(P<0.05)。其中20%左归丸血清作用24 h和48 h抑制K562细胞增殖活性的效果最佳(P<0.01)。(见图1)

图1 各组K562细胞增殖活性比较(n=3)
3.2 各组K562细胞形态比较 干预48 h,空白对照组K562细胞呈圆形,胞核较大,胞浆较少,核浆比较大;空白血清组和阳性对照组K562细胞呈圆形,胞核较大,胞浆较少,核浆比较大,与空白对照组差别不大;左归丸血清组与其他3组比较,细胞染色质固缩,胞核明显变小,胞浆丰富,核浆比降低。(见图2)

图2 各组K562细胞光镜形态比较(×1 000)
3.3 各组K562细胞血红蛋白含量比较 干预24 h,空白血清组、阳性对照组、左归丸血清组K562细胞血红蛋白含量均明显高于空白对照组(P<0.01);阳性对照组K562细胞血红蛋白含量低于空白血清组(P<0.01);左归丸血清组K562细胞血红蛋白含量明显高于阳性对照组(P<0.01)。
干预48 h,空白血清组、左归丸血清组K562细胞血红蛋白含量均明显高于空白对照组(P<0.01);阳性对照组K562细胞血红蛋白含量与空白对照组比较,差异无统计学意义(P>0.05);阳性对照组K562细胞血红蛋白含量低于空白血清组(P<0.01);左归丸血清组血红蛋白含量明显高于阳性对照组(P<0.01)。(见图3)
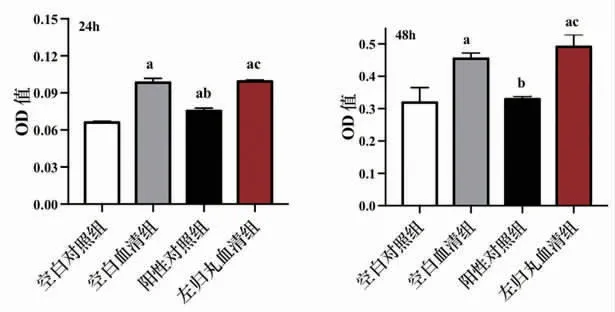
图3 各组K562细胞血红蛋白含量比较(x±s,n=3)
3.4 各组K562细胞血红蛋白表达阳性率比较 干预48 h,空白血清组、左归丸血清组K562细胞血红蛋白表达阳性率均明显高于空白对照组(P<0.01);阳性对照组K562细胞血红蛋白表达阳性率与空白对照组比较,差异无统计学意义(P>0.05);阳性对照组K562细胞血红蛋白表达阳性率明显低于空白血清组(P<0.01);左归丸血清组K562细胞血红蛋白表达阳性率明显高于阳性对照组(P<0.01)。(见图4)
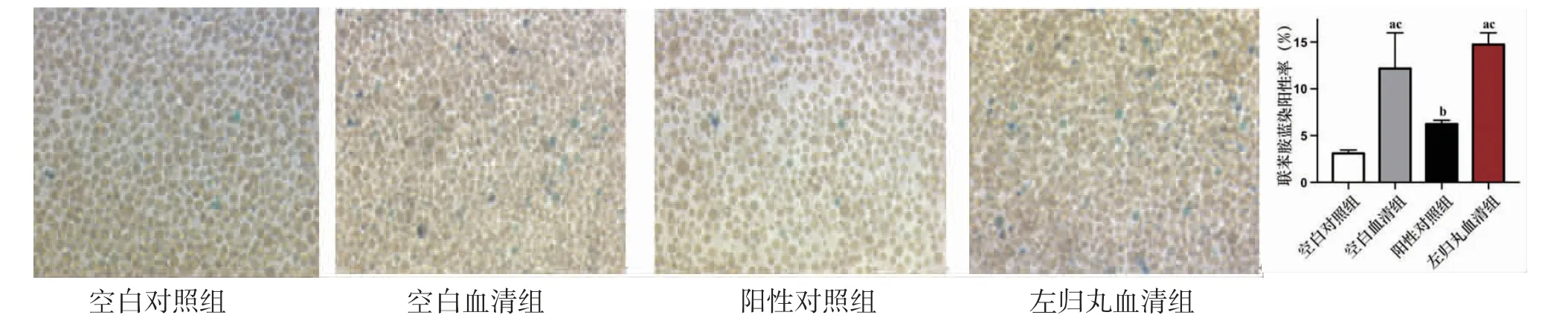
图4 各组K562细胞血红蛋白表达阳性率比较
3.5 各组K562细胞红系分化标志CD71表达率比较 干预24 h,空白对照组表达CD71的K562细胞大多数小于103,空白血清组表达CD71的K562细胞平均分布于103两侧,阳性对照组表达CD71的K562细胞大多数小于103,左归丸血清组表达CD71的K562细胞大多数大于103。空白对照组、空白血清组、阳性对照组K562细胞CD71表达率比较,差异无统计学意义(P>0.05);左归丸血清组K562细胞CD71表达率明显高于空白对照组、空白血清组、阳性对照组(P<0.05或P<0.01)。(见图5)
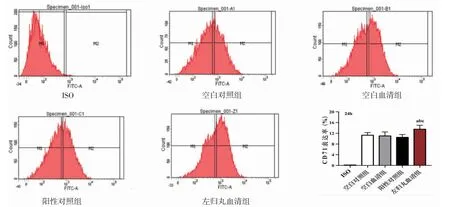
图5 各组K562细胞CD71表达率比较
3.6 各组K562细胞红系分化相关蛋白GATA-1表达比较 干预48 h,与空白对照组比较,空白血清组、阳性对照组、左归丸血清组K562细胞GATA-1蛋白表达均明显上调(P<0.05或P<0.01)。(见图6)
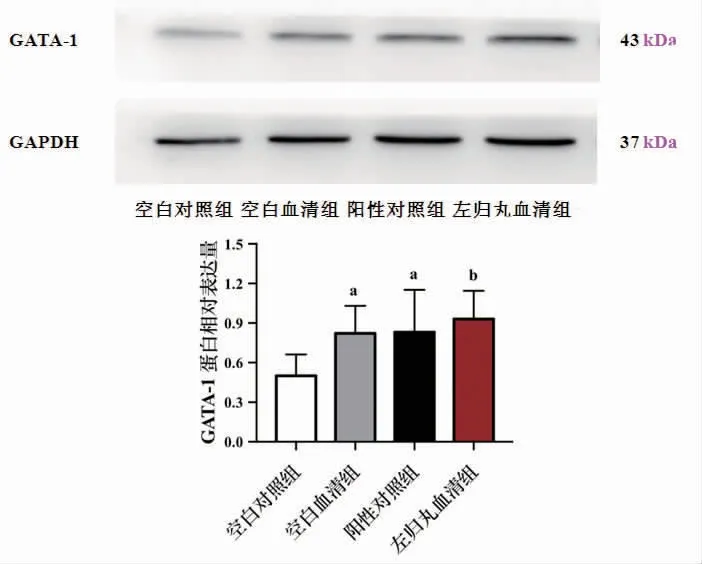
图6 各组K562细胞GATA-1蛋白表达比较
3.7 各组K562细胞红系分化相关基因GATA-1 mRNA、EPO mRNA、EPOR mRNA表达比较 干预48 h,空白对照组、空白血清组、阳性对照组K562细胞GATA-1 mRNA、EPO mRNA、EPOR mRNA表达比较,差异无统计学意义(P>0.05);左归丸血清组K562细胞GATA-1 mRNA、EPO mRNA、EPOR mRNA表达均明显高于空白对照组、空白血清组和阳性对照组(P<0.05或P<0.01)。(见图7)

图7 各组K562细胞GATA-1 mRNA、EPO mRNA、EPOR mRNA表达比较
4 讨 论
肿瘤相关性贫血可造成患者预后较差,严重影响生存质量,是临床迫切需要解决的问题[2]。其发生机制主要是红细胞生成不足、破坏过多及失血[7]。原因主要有肿瘤所致贫血、肿瘤治疗相关性贫血、营养素缺乏所致贫血[8]。目前西医治疗贫血尚未达到满意效果,因此需积极寻找有效治疗手段。调控红系分化是近年抗贫血研究热点。红系分化是造血干细胞增殖、分化、发育为成熟红细胞的过程,该过程受细胞内多种基因和细胞因子调控,其中关键因素有EPO、EPOR、GATA-1等[9-11]。有研究报道,龟甲、丹参、党参、黄芪等中药,人参多糖、人参总皂甙、苦参碱、藤黄酸、甘草次酸等中药成分可促红系分化[12-18]。
中医学认为肿瘤相关性贫血患者常见面色少华、神疲乏力、头晕耳鸣、心悸失眠、食欲减退、舌淡暗、苔薄白、脉细弱无力等,基本病机为气血两虚,而其重要病机是脾肾亏虚、精血化生乏源[8]。肾藏精生髓,精血互化,髓能养血,因此补肾可促进血液化生。临床报道已证实[19-21],采用补肾生血治疗贫血能取得明显的临床疗效。左归丸由熟地黄、枸杞子、山茱萸、龟甲胶、鹿甲胶、牛膝、菟丝子、山药组成,可补肾养阴、填精益髓,临床上多用来联合西药治疗再生障碍性贫血,有研究显示其疗效优于单纯西药组[22-23];沈辉等[24]采用左归丸合当归补血汤治疗化疗后骨髓抑制,疗效也明显优于对照组。研究[25]显示,左归丸中熟地黄、山萸肉、枸杞子、菟丝子、鹿角胶、龟甲等药均为临床治疗肿瘤相关性贫血常用药,但作用机制尚不明确。
本实验采用左归丸作为补肾生血法代表方,以具有分化潜能的红白血病K562细胞为模型,从红系分化角度进行机制研究。实验结果显示:左归丸血清干预24、48、72 h对K562细胞增殖具有显著抑制作用(P<0.05),在5%~20%浓度范围内呈现出明显的量效关系;细胞涂片瑞氏-吉姆萨染色显示,左归丸血清干预后细胞染色质固缩,胞核变小,胞浆丰富,核浆比降低,呈现出成熟细胞的特点。20%左归丸血清作用24 h和48 h抑制细胞增殖的效果最佳(P<0.01),且干预48 h的作用尤为突出,因此实验时间选择48 h或者24 h。
血红蛋白是红系标志之一,联苯胺可与血红蛋白发生反应而呈蓝色,镜下可见细胞蓝染,采用酶标仪可定量检测血红蛋白含量。K562细胞是未分化的原始细胞,血红蛋白含量较低。实验结果显示,左归丸血清干预后,K562细胞中表达血红蛋白的阳性细胞率明显上升,血红蛋白含量也明显增加(P<0.01)。
CD71为转铁蛋白受体,与转铁蛋白结合后可介导细胞内铁摄取。随着造血干/祖细胞向红系分化,承担铁运输作用的血红蛋白合成逐渐增加,因此CD71表达逐渐升高,故CD71可作为红系分化标志。本实验结果显示,左归丸血清能明显升高K562细胞CD71表达率(P<0.05),而CD71仅在24 h差异显著,48 h却差异不大,是否存在对于CD71的调节仅表现在24 h,原因仍待探究。
EPO为红系特异性细胞因子,与EPOR结合后可激活JAK-STATs、Ras等信号通路而刺激红系造血。在红系造血过程中,EPO首先诱导GATA-1、EPOR表达[9]。EPOR基因启动子中存在着特异性GATA-1结合元件,GATA-1与该元件结合后能激活转录EPOR基因,增加红系细胞对EPO的反应性[10]。GATA-1能特异性激活多种红系基因,诱导细胞向红系分化,促进红细胞发育成熟,并随红系分化成熟而上调[11]。可见GATA-1、EPO、EPOR之间存在着密切联系,共同促进红系分化。实验结果显示,左归丸血清可显著上调K562细胞中GATA-1蛋白表达(P<0.01),同时还明显上调GATA-1 mRNA、EPO mRNA、EPOR mRNA表达(P<0.01或P<0.05)。
综上所述,左归丸血清可促进K562细胞向红系分化,其机制与调控GATA-1、EPO、EPOR表达有关。左归丸血清对K562细胞GATA-1 mRNA、EPO mRNA、EPOR mRNA表达均有明显上调作用,对GATA-1的蛋白表达也有明显上调作用,对EPO和EPOR蛋白表达的影响尚不明确,这是下一步实验的研究方向。由于血清成分较复杂,目前尚不能明确是左归丸本身的药效作用,还是左归丸与血清的协同作用诱导K562细胞向红系分化,因此还需今后进一步从血清药理学角度开展深入研究。
