鸡血莲黄酮通过调节AMPK/Sirt1/NF-κB信号通路改善小鼠非酒精性脂肪肝的实验研究
2021-11-22阮金兰
杨 娴,阮金兰
(1.石家庄四药有限公司药物研究院,河北 石家庄 050000;2.武昌理工学院生命科学学院,湖北 武汉 430223)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种在无酒精滥用、病毒性肝炎、药物因素和自身免疫性肝炎等原因的情况下,肝脏的脂肪变性疾病[1]。据报道,预计在未来10年之内,NAFLD患者的数量将急剧增加,并将于2030年成为肝移植最常见的指征[2]。NAFLD包括广泛的肝脏病理改变,从单纯性脂肪肝到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化和肝硬化,甚至部分患者可发展为肝癌[3]。临床和非临床研究表明,NAFLD患者和动物模型的活性氧(reactive oxygen species,ROS)和炎性细胞因子水平均升高[4-5]。氧化应激和炎症反应在NAFLD从单纯性脂肪变性到晚期脂肪变性过程中发挥关键作用。ROS能够诱发肝脏炎症反应进而刺激Kupffer细胞合成和释放TGF-β、IL-6和TNF-α等炎症因子,这些炎症因子刺激肝星状细胞转化为肌成纤维样细胞,诱发肝脏纤维化和肝细胞坏死的发生,从而加重NAFLD[6-7]。
鸡血莲是金星蕨科,新月蕨属,披针新月蕨[Abacopteris penangiana (Hook.) Ching]的根茎,它作为我国土家族与苗族的传统药物,历史悠久。鸡血莲含有丰富的黄酮成分,尤其是黄烷-4-醇苷类化合物,其中7-羟基-4-甲氧基-6,8-二甲基花青素是鸡血莲黄酮的主要成分。前期药理学研究表明鸡血莲黄酮具有明确的抗炎和抗氧化活性[8-11]。有研究表明,具有抗氧化和抗炎作用的中草药有助于NAFLD疾病进展的控制[12-13]。本研究利用高脂饮食诱导小鼠NAFLD模型,观察鸡血莲黄酮对NAFLD小鼠的作用,并探讨其作用机制。
1 材料与方法
1.1 实验动物 40只6~8周龄SPF级雄性昆明小鼠,体质量18~22 g,购自华中科技大学实验动物中心,动物许可证号:SCXK(鄂)2010-0009。经医学实验动物管理委员会批准,在温度(25±5)℃,湿度(65±5)%,12 h光照/12 h黑暗循环的饲养条件下饲养,允许其自由饮水与饮食,同时密切观察实验动物的存活状况。
1.2 药物与试剂 鸡血莲采收自湖北省恩施自治州,九江市森林植物标本馆谭策名研究员鉴定其为金星蕨科新月蕨属植物披针新月蕨[Abacopteris penangiana (Hook.) Ching]的根茎。取鸡血莲2 kg经粉碎后,用80%(V/V)乙醇回流提取1 h。提取液经减压,浓缩,干燥,得到鸡血莲总提取物。将总提取物以3 mg/mL的浓度加到HPD500大孔树脂柱中,先用上样量5倍的水进行冲洗,然后用5倍量的70%(V/V)乙醇进行冲洗,收集洗脱液,浓缩、干燥、得黄酮提取物187 g。以Triphyllin A作为对照品,采用紫外分光光度法,在波长276 nm处,测定鸡血莲黄酮中黄酮的含量。
Triphyllin A(华中科技学同济医学院药学院,湖北省天然药物化学与资源评价重点实验室提供,纯度>98%);HPD 500大孔树脂(Bon Adsorher Technology Company);胆固醇(TC)试剂盒(批号:A111-2-1)、甘油三酯(TG)试剂盒(批号:A110-2-1)、天门冬氨酸转氨酶(AST)试剂盒(批号:C010-2-1)、丙氨酸转氨酶(ALT)试剂盒(批号:C009-3-1)、丙二醛(MDA)试剂盒(批号:A003-1-2)、过氧化氢酶(CAT)试剂盒(批号:A007-1-1)、超氧化物歧化酶(SOD)试剂盒(批号:A001-1-2)和谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:A005-1-2)(南京建成生物工程有限公司);肿瘤坏死因子α(TNF-a)ELISA试剂盒(批号:ECM102a.96)、白介素-6(IL-6)ELISA试剂盒(批号:ECMC004(H).96)、白介素-1β(IL-1β)ELISA试剂盒(批号:ECMC0013.96)(欣博盛生物科技有限公司);NF-κB抗体(批号:8242)、AMPK抗体(批号:2532)、Sirt1抗体(批号:8469)(Cell Signaling Technology)。
高脂饮食配方:正常饲料47%,猪油20%,蛋黄20%,蔗糖10%,胆固醇2%,胆酸盐1%[10]。
1.3 主要仪器 XD-101型倒置显微镜(南京江南光电集团股份有限公司);酶标仪(三元科技有限公司);UV1910型紫外可见分光光度计(上海凌光技术有限公司);RE-2000B型旋转蒸发仪(巩义市英峪高科仪器厂);Gel Doc XR+型凝胶电泳仪和凝胶成像系统(Bio Rad公司)。
1.4 造模与分组 40只小鼠适应性饲养1周后,随机分为正常组、模型组、鸡血莲黄酮高剂量组、鸡血莲黄酮低剂量组,每组10只。正常组饲喂常规饲料,其余各组采用高脂饮食诱导小鼠NAFLD模型[10],饲喂高脂饲料连续4周后,各组随机选取2只动物采用脊椎脱臼法处死,取出肝脏,观察肝脏病理学变化。高脂饮食期间,观察高脂喂养小鼠的体征变化,其中观察到毛色发黄伴有油腻感,体质量增加,连续血脂、肝功能检测异常,结合肝脏HE染色出现明显大小不一的脂肪空泡,判断模型复制成功。
1.5 实验给药 造模成功后,剂量设计参考文献[8],鸡血莲黄酮高、低剂量组小鼠分别灌胃给予200、100 mg/kg鸡血莲黄酮提取物;正常组和模型组灌胃给予等体积的生理盐水,连续4周。给药期间,正常组继续饲喂常规饲料,其余各组饲喂高脂饲料。
1.6 观察指标
1.6.1 体质量、腹部脂肪质量、肝脏质量及肝指数的测定 末次给药后,各组小鼠禁食12 h,称定各组小鼠体质量,摘眼球取血,断颈处死,分离腹部脂肪,称质量;剥离完整肝脏,用生理盐水将肝脏冲洗干净,滤纸吸干表面水分,精密称定质量,计算肝脏指数。肝脏指数=肝脏质量(g)/体质量(g)×100%。
1.6.2 小鼠血清AST、ALT及血脂水平的检测 小鼠摘眼球取血,血液放置于1.5 mL离心管中,冰上静置30 min后,3 500 g离心15 min,吸取上清,参照试剂盒说明测定TC、TG、AST和ALT的含量。
1.6.3 氧化应激相关指标的检测 取相同部位的肝组织0.5 g,将肝脏剪碎后,按照1∶9(m/V)的比例放入4 ℃预冷的生理盐水中,制备10%肝组织匀浆。匀浆液在4 ℃3 500 g下离心15 min,吸取上清,参照试剂盒说明测定MDA、SOD、CAT和GSH-Px的含量。
1.6.4 肝脏组织学观察及免疫组化染色 取相同部位的肝组织,4%多聚甲醛固定24 h,先后经酒精脱水,透明,浸蜡,石蜡包埋等步骤,随后以4 μm厚度切片,切片以常规方法进行苏木精-伊红(HE)染色,封片,200倍光学显微镜下观测肝脏组织形态改变情况。
此外,用脱蜡切片进行免疫组化分析。将上述石蜡包埋的组织切成小薄片,在37 ℃恒温烘箱中烘干,脱蜡,3% H2O2室温浸泡,5%山羊血清封闭切片,磷酸盐缓冲液(PBS)冲洗,加NF-κB(1∶200)4 ℃冰箱中保存孵育过夜,然后加入HRP标记的第二抗体并于37 ℃恒温箱中温育30 min。PBS冲洗后加入显色剂,将显色后的薄片用蒸馏水冲洗,苏木精染色切片,酒精脱水,置于200倍显微镜下观察。
1.6.5 肝脏炎症因子检测 肝脏上清液采用“1.6.3”方法制备,ELISA试剂盒检测TNF-α、IL-1β和IL-6的含量,具体步骤参照试剂盒说明书。
1.6.6 小鼠肝脏组织中Sirt1和AMPK蛋白的检测 Western blotting法检测肝脏组织中Sirt1和AMPK蛋白的表达。肝组织经研磨后用BCA试剂盒测定蛋白含量,50 μg蛋白用10%SDS-PAGE处理后,恒压100 V,1.5 h转膜。PVDF膜与一抗Sirt1(1∶500),AMPK(1∶500);β-actin(1∶500)4 ℃孵育过夜。经TBST洗涤后,PVDF膜与二抗在室温下孵育1 h。按电化学发光试剂盒说明书步骤,配备显影液,显影。
1.7 统计学方法 采用统计学软件SPSS 25.0进行数据处理,计量资料以“均数±标准差”()表示,组间数据比较采用单因素方差分析,两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结 果
2.1 鸡血莲黄酮中黄酮的含量 线性回归方程:A=3.963 7C+0.005 7,R=0.999 8,C=0.012 5~0.400 0 mg/mL。说明浓度在0.012 5~0.400 0 mg/mL的范围内,化合物Triphyllin A浓度与吸光度之间呈现良好的线性关系。最终测得,鸡血莲黄酮中黄酮的含量为69.4%。
2.2 各组小鼠体质量、腹部脂肪质量、肝脏质量和肝脏指数比较 模型组小鼠的体质量、腹部脂肪质量、肝脏质量和肝脏指数均高于正常组(P<0.05);鸡血莲黄酮高、低剂量组小鼠的体质量、腹部脂肪质量、肝脏质量和肝脏指数均低于模型组(P<0.05);鸡血莲黄酮低剂量组小鼠的体质量、腹部脂肪质量、肝脏质量和肝脏指数均高于鸡血莲黄酮高剂量组(P<0.05)。(见表1)
表1 各组小鼠体质量、腹部脂肪质量、肝脏质量和肝脏指数比较()
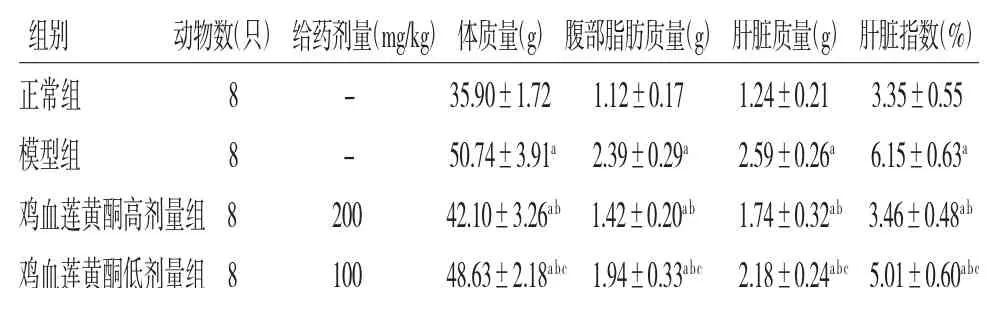
表1 各组小鼠体质量、腹部脂肪质量、肝脏质量和肝脏指数比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与鸡血莲黄酮高剂量组比较,cP<0.05
2.3 各组小鼠血清AST、ALT、TC、TG水平比较 模型组小鼠血清TC、TG、ALT和AST高于正常组(P<0.05),说明高脂饮食诱导小鼠肝功能异常及体内脂代谢紊乱,提示造模成功;鸡血莲黄酮高、低剂量组小鼠血清TC、TG、ALT和AST低于模型组(P<0.05);鸡血莲黄酮低剂量组小鼠血清TC、TG、ALT和AST均高于鸡血莲黄酮高剂量组(P<0.05)。结果表明鸡血莲黄酮能够调节高脂饮食诱导的小鼠肝功能异常及脂代谢紊乱。(见表2)
表2 各组小鼠血清TC,TG,AST 和ALT 比较()

表2 各组小鼠血清TC,TG,AST 和ALT 比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与鸡血莲黄酮高剂量组比较,cP<0.05
2.4 各组小鼠氧化应激指标比较 模型组小鼠肝脏中MDA含量高于正常组(P<0.05),SOD、CAT及GSH-px含量低于正常组(P<0.05),提示NAFLD小鼠肝脏内存在氧化应激;鸡血莲黄酮高剂量组中MDA含量低于模型组(P<0.05),SOD及GSH-px含量高于模型组(P<0.05);鸡血莲黄酮低剂量组中MDA含量低于模型组(P<0.05),SOD、GSH-px含量高于模型组(P<0.05),而CAT含量与模型组比较,差异无统计学意义(P>0.05);鸡血莲黄酮低剂量组中MDA含量高于鸡血莲黄酮高剂量组(P<0.05),SOD、CAT及GSH-px含量均低于鸡血莲黄酮高剂量组(P<0.05)。结果表明鸡血莲黄酮能够改善NAFLD小鼠肝脏氧化应激状态。(见表3)
表3 各组小鼠肝组织中MDA、SOD、CAT 及GSH-px 含量比较()
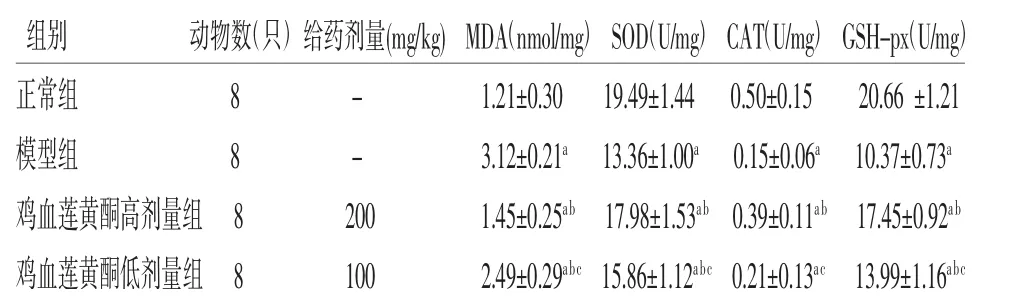
表3 各组小鼠肝组织中MDA、SOD、CAT 及GSH-px 含量比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与鸡血莲黄酮高剂量组比较,cP<0.05
2.5 各组小鼠肝脏组织及病理学变化 正常组小鼠肝脏红润,肝组织结构正常,肝细胞结构清晰完整,细胞内无明显脂滴沉积;模型组小鼠肝脏外观明显发黄,肝脏组织内充满大量大小不一的脂肪空泡,肝细胞结构紊乱、膨胀,大量炎细胞浸润,提示造模成功;鸡血莲黄酮高、低剂量组小鼠肝组织与正常组比较,仍可见轻至中度肝细胞脂肪变性,但与模型组比较,脂肪变性程度减轻,胞内脂滴数量明显减少,同时细胞体积缩小,炎性细胞的浸润程度降低。结果表明鸡血莲黄酮能够抑制高脂饮食诱导的小鼠肝组织脂肪变性和炎症病变。(见图1~2)
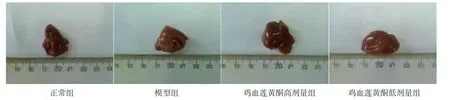
图1 各组小鼠肝组织形态图
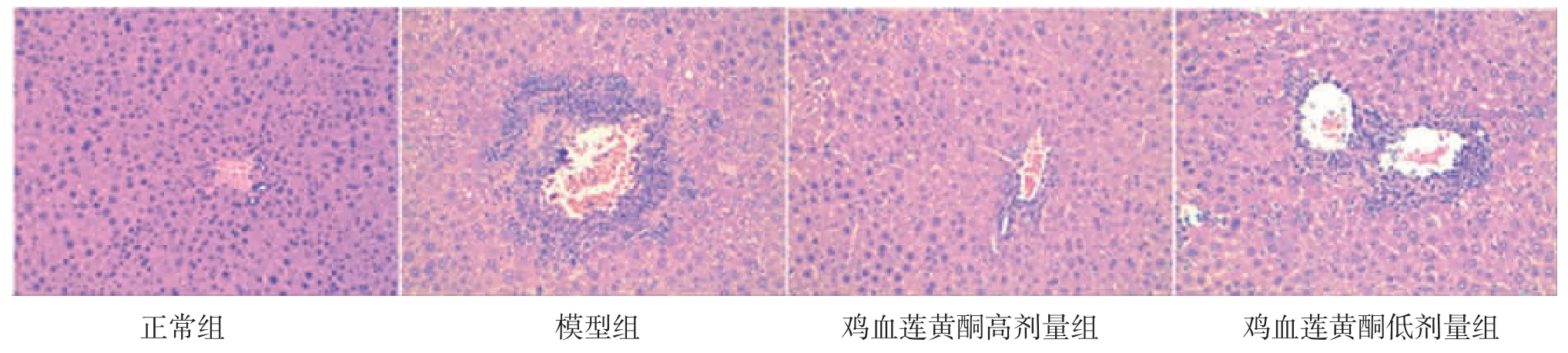
图2 各组小鼠肝组织病理切片图(HE,×200)
2.6 各组小鼠炎症指标比较 模型组小鼠肝脏中TNF-α、IL-1β和IL-6含量高于正常组(P<0.05),提示NAFLD小鼠肝脏存在炎症反应;鸡血莲黄酮高、低剂量组小鼠肝脏TNF-α、IL-1β和IL-6含量低于模型组(P<0.05);鸡血莲黄酮低剂量组小鼠肝脏TNF-α、IL-1β和IL-6含量均高于鸡血莲黄酮高剂量组(P<0.05)。结果表明鸡血莲黄酮能够降低NAFLD小鼠肝脏炎症因子水平。(见表4)
表4 各组小鼠肝组织中TNF-α、IL-1β 和IL-6 含量比较(,μg/mL)
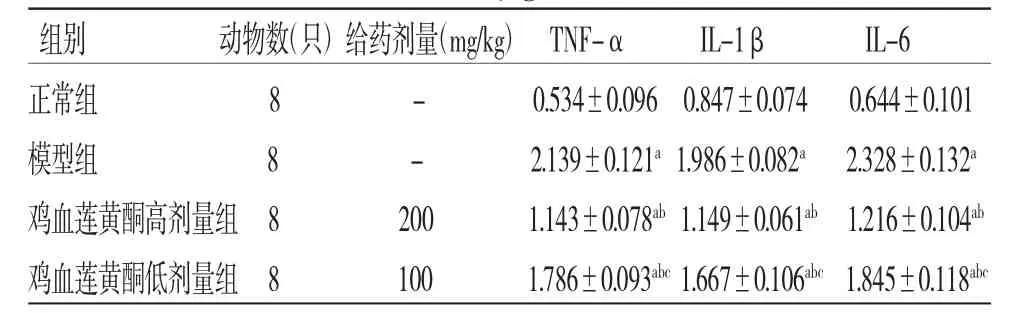
表4 各组小鼠肝组织中TNF-α、IL-1β 和IL-6 含量比较(,μg/mL)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与鸡血莲黄酮高剂量组比较,cP<0.05
2.7 各组小鼠肝脏NF-κB表达比较 与正常组比较,模型组呈深棕色,提示NF-κB的表达量增加;鸡血莲黄酮高、低剂量组小鼠肝组织与模型组比较,棕色变浅,提示NF-κB的表达量下降。结果表明鸡血莲黄酮能够抑制高脂饮食诱导的NF-κB表达量增加。(见图3)
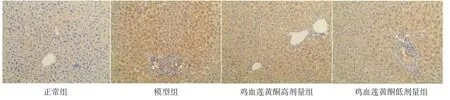
图3 各组小鼠肝脏NF-κB 表达情况
2.8 各组小鼠Sirf1和AMPK蛋白表达比较 模型组小鼠肝脏中Sirt1和AMPK表达量低于正常组(P<0.05);鸡血莲黄酮高剂量组小鼠肝脏中Sirt1和AMPK表达量高于模型组(P<0.05)。结果表明鸡血莲黄酮能够部分逆转高脂饮食诱导的小鼠肝脏中Sirt1和AMPK表达障碍。(见图4、表5)
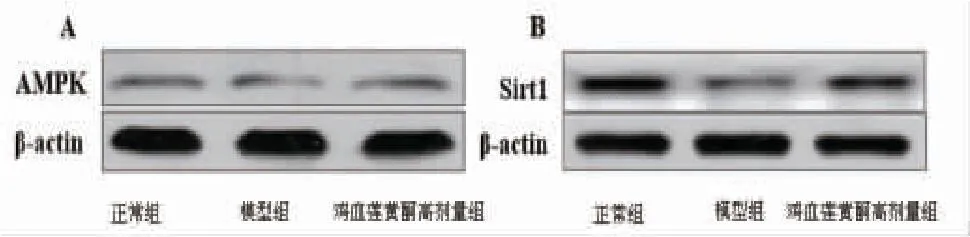
图4 各组小鼠Sirf1 和AMPK 蛋白表达的比较
表5 各组小鼠Sirf1 和AMPK 蛋白表达比较()

表5 各组小鼠Sirf1 和AMPK 蛋白表达比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
3 讨 论
NAFLD是一种临床常见的慢性肝病,它的发生往往与肥胖、高血压、2型糖尿病及血脂异常等因素有关。血浆中的脂质含量与NAFLD的严重程度密切相关。NAFLD患者体内脂代谢紊乱,一般表现为血浆中的TG、TC、AST、ALT水平较高[14]。高脂饮食可诱导小鼠体内高脂血症及肝脏脂代谢紊乱,引起肝细胞脂肪变性,肝脏结构与功能受损。在本研究中,与正常组比较,模型组小鼠TC、TG、AST、ALT水平增加,说明高脂饲料可成功诱导小鼠脂代谢紊乱。肝脏的病理切片观察发现,模型组小鼠肝脏组织中出现弥漫性肝细胞大泡性脂肪病变和炎性细胞,说明NAFLD造模成功,且该模型属于非酒精性脂肪性肝炎(NASH)。
氧化应激对NAFLD的发展具有促进作用。高脂、高热量的膳食不仅能够引起机体脂代谢异常,还能激活细胞内还原型酰胺嘌呤二核苷酸磷酸氧化途径,生成过量ROS,肝脏抗氧化酶活性下降,MDA含量增加,导致胰导素抵抗(IR)、炎症和纤维化,从而导致NAFLD进一步恶化[15]。本研究中,高脂饮食诱导的模型组小鼠肝脏组织中MDA的含量增加,SOD、GSH-px、CAT的含量降低,表明NAFLD小鼠肝脏发生了氧化应激事件。鸡血莲黄酮能够增加抗氧化酶的含量,同时降低MDA的含量,进而起到减缓NAFLD的作用。
过度炎症反应是NAFLD的典型病理改变之一。研究表明,炎症因子如TNF-α、IL-1β、IL-6参与了NAFLD继发肝损伤[16-17]。在本研究中,HE染色结果显示,高脂饮食诱导了小鼠肝脏大量的炎细胞浸润,肝组织中TNF-α、IL-1β、IL-6水平增加,肝脏组织存在炎症反应。鸡血莲黄酮给药后可有效抑制炎性细胞浸润,减少TNF-α、IL-1β、IL-6的含量。提示鸡血莲黄酮能够抑制炎症反应,从而起到抑制NAFLD的作用。
AMPK是导致NAFLD的发生和调节肝脏脂质代谢的重要因子。最近的研究报道,药物可通过AMPK通路增强抗氧化酶活性以减轻氧化应激[3]。AMPK通路的激活可增加Sirt1的活性。研究资料证实,Sirt1的激活能够增加肝内线粒体的生成,并促进肝内超氧化物歧化酶的表达,从而提高NASH抗氧化应激能力[18]。本研究发现,模型组小鼠肝脏组织中AMPK、Sirt1的表达下降,而鸡血莲黄酮给药后能够增加AMPK、Sirt1的表达。转录因子NF-κB存在于多种细胞中,包括脂肪细胞和巨噬细胞,它是一种关键的氧化还原敏感的促炎性转录因子,在炎症反应中调节多种基因的表达,肝损伤能够导致NF-κB的上调[19]。本研究发现,模型组小鼠肝脏组织中,NF-κB的表达量升高,而鸡血莲黄酮给药后,NF-κB的表达下降。以上结果提示鸡血莲黄酮能够通过调节AMPK/Sirt1/NF-κB通路,调节高脂饮食诱导的脂代谢紊乱,减缓由此引发的氧化应激及炎症反应。
本研究从动物水平证实鸡血莲黄酮具有缓解NAFLD的潜力,为鸡血莲用于NAFLD治疗药物的开发,提供了实验依据。
