盐生草根际耐盐性木霉菌分离鉴定及其耐盐性评价
2021-11-22谢佳丽张树武徐秉良
谢佳丽,李 宝,刘 佳,张树武,徐秉良
(甘肃农业大学植物保护学院 / 甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
近年来,由于人们对自然资源的过度开发以及对环境资源的巨大破坏导致土壤质量严重下降,盐渍化问题已成为影响地球上有限土地资源的重要问题所在[1]。据报道,全世界超过20% 栽培地和50%灌溉地已受到盐渍化的威胁[2]。同时,土壤盐渍化已成为制约农业发展的关键要素,限制农作物的生产,造成严重的产量和经济损失[3-4]。谢文军等[5]研究表明,当土壤中含盐量超过3.5 g·kg−1时会大幅降低小麦(Triticum aestivum)的产量。Ghoulam 等[6]研究表明,盐碱地中Na+和Cl−对植物的毒害作用极大,可破坏氧化还原平衡,产生大量毒性物质,最终对植物细胞造成毒害。高盐碱可使土壤腐殖质严重淋失,土壤通气透水性下降,很容易造成植物萎蔫、中毒和烂根死亡等现象,影响作物的产量和品质[7]。杨志莹等[8]研究表明盐胁迫可导致玫瑰(Rosa rugosa)细胞膜遭到破坏和影响其正常生理功能,进而抑制玫瑰的生长和降低其生物量。因此,对于盐碱地的改良和防治已成为农业和社会经济可持续发展的重要内容[9]。但目前土壤盐碱化改良依然利用传统的化学手段、农业措施和水利工程等措施[10-12],而化学修复会带来环境污染,农业措施和水利工程则存在见效慢和成本高等缺点。因此,利用耐盐微生物解决土壤盐渍化问题是当前国内外研究的重点和热点之一。
木霉菌(Trichodermaspp.) 属于无性态,丝孢纲丝孢目木霉菌属[13]的一类分布较为广泛、适应能力极强的土壤习居性真菌,其对多种植物病原菌具有较好的拮抗作用,以及对相应病害具有较好的防治作用,在生物防治领域受到广泛青睐[14-15]。研究表明在盐胁迫条件下,植物可以通过合成有机小分子来降低细胞水势,从外界环境中吸收水分[16],清除活性氧自由基,使其免受盐胁迫的危害[17]。另外,张树武等[18]研究发现长枝木霉(T. longibrachiatum)T6 菌株具有较强的耐盐活性,其可在盐胁迫条件下促进小麦幼苗的生长,但是有关盐生草(Halogetonarachnoideus)根际土壤中耐盐木霉菌的分离鉴定及其耐盐性评价等方面尚未见报道。
为此,通过对盐生草根际盐碱土中木霉菌的分离,并结合形态学和分子生物学鉴定,以及对其耐盐性的评价,旨在筛选出耐盐性较强的木霉菌株,诱导植物产生抗性并降低盐害对植物的影响,有效缓解土壤盐渍化的影响[19]。研究结果将为木霉菌应用于土壤盐碱化治理提供一定的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 根际盐碱土采集
供试盐生草根际盐碱土采自甘肃省武威市民勤县。当地气候条件干旱炎热,多为氯化物盐土,1 m 土层含盐量可达0.4%~1.39%,土壤pH 为6.5,植物种类稀少且植被稀疏,主要以梭梭草(Cyperus rotundus)为主。采集土样时去除盐生草根际土壤表面干土,收集0 - 20 cm 土层土壤,带回实验室后室温风干,然后过0.23 mm 筛,获得的土样用于后续试验。
1.1.2 供试化学药品
NaCl 分析纯AR (无色晶体)购自国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 根际盐碱土土壤稀释液配制
称取待测盐碱土样10 g 于150 mL 锥形瓶中,加入10 个玻璃珠和90 mL 无菌水后放到25 ℃摇床中,设置转速为130~160 r·min−1,然后将其振荡1.5~2.5 h,使土壤中的菌物均匀地散落在液体中,然后静置20~30 min,所得土壤稀释液为10 倍稀释液,并利用无菌水依次稀释为不同稀释倍数的土壤悬浮液(100 和1 000 倍液)。
1.2.2 根际盐碱土稀释液中木霉菌的分离
采用平板分离法进行盐生草根际盐碱土中木霉菌的分离。将配制好的不同浓度土壤稀释液依次吸取200 μL 均匀涂布到马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上,于超净工作台上风干150~200 s 后置于25 ℃ (16 h·d−1)光照条件的恒温培养箱内培养,每个处理重复6 次。培养3 d后分别记录每个培养基中木霉菌的菌落数量并观察其菌落形态。
1.2.3 根际盐碱土稀释液中木霉菌的纯化培养
培养3 d 后,挑选菌落形态类似于木霉菌的菌株接种至PDA 培养基上,对木霉菌进行纯化,每个菌株接种6 皿。待木霉菌产孢后重复上述步骤,直到菌株纯化,并每隔24 h 记录1 次菌落形态特征,持续观察7 d 后转接至冻存管中进行保存备用。
1.2.4 根际盐碱土中木霉菌的分离及筛选
利用含盐培养基模拟盐碱土条件,配制800 mmol·L−1NaCl 的PDA 培养基来筛选耐盐性较强的木霉菌,以不含盐的空白PDA 培养基为对照。待培养基冷却凝固后,中央接种纯化的木霉菌株菌饼(d = 5 mm),并置于25 ℃ (16 h·d−1)光照条件的恒温培养箱内培养。待培养3 d 后,采用“十字交叉法”测量菌落直径,试验过程中所有处理和对照均重复3 次。
1.2.5 根际分离木霉菌鉴定
采用形态学和分子生物学相结合的方法鉴定耐盐性较强的木霉菌株。
1) 形态学鉴定:参考Samuels[20]木霉菌分类方法进行形态学鉴定。具体方法为,将筛选获得的耐盐性较强的木霉菌株接种于PDA 平板上,于25 ℃下连续培养3 d,待刚刚产生绿色孢子时,观察其菌落的形态、颜色,并于显微镜下观察和记录菌丝、分生孢子梗、分生孢子大小及形态特征。
2) 分子生物学鉴定:参考李琳等[21]CTAB (cetyltrimethylammonium ammonium bromide)法提取耐盐性较强的木霉菌株DNA。将提取的DNA 进行琼脂糖凝胶电泳检测,并通过Nano PhotometerTM Pearl 紫外分光光度计对所提取的DNA 浓度进行测定,分装后置于-80 ℃超低温冰箱中保存备用。利用引物ITS-F/ITS-R 扩增ITS 片段,使用引物TEF-F/TEF-R 扩增TEF 片段。所有引物由上海生物技术有限公司合成(表1)。

表1 引物名称及序列Table 1 Primer names and sequences
3) ITS 和 TEF 片段扩增反应。ITS 序列:PCR 反应 体 系 为2 × Taq PCR MasterMixⅡ 12.5 μL、DNA 3 μL、RNase-Free ddH2O 7.5 μL、上下游引物各1 μL(ITS1-F 和ITS4-R),反应总体系25 μL。PCR 扩增条件为95 ℃预变性5 min、95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,共30 个循环,最后72 ℃延伸7 min,扩增产物经1%琼脂糖凝胶电泳检测。
TEF 序 列:PCR 反 应 体 系 为2 × Taq PCR MasterMixⅡ 10 μL、DNA 1 μL、RNase-Free ddH2O 7 μL、上下游引物各1 μL (TEF-F 和TEF-R),反应总体系20 μL。PCR 扩增条件为97 ℃预变性3 min、96 ℃变性30 s、55 ℃退火1 min、72 ℃延伸1 min,循环重复35 次,最后在72 ℃下延伸10 min,扩增得到的产物再经过1%琼脂糖凝胶电泳进行检测。
4) 序列分析及系统进化树构建:将测序后获得的T-ITS 和T-TEF 序列分别提交到NCBI 网站上,并利用Blast 1.83 X 软件进行序列比对。然后根据NCBI 数据库中木霉菌株的ITS 和TEF 序列信息,利用MEGA5 软件进行多重序列比较,并采用邻接法构建系统进化树(Bootstrap = 500)进行菌株分子生物学鉴定。
1.2.6 木霉菌耐盐性评价
利用含盐培养基模拟盐碱土条件,参考赵忠娟等[22]报道的关于木霉菌耐盐活性的鉴定方法,制作含盐量分别为100、200、400、600 和800 mmol·L−1的PDA 培养基进行木霉菌耐盐性评价,对照为不含盐的空白PDA 培养基。待培养基冷却凝固后,中央接种耐盐性较强的木霉菌株菌饼(d = 5 mm),置于25 ℃ (16 h·d−1)光照条件的恒温培养箱内培养。采用“十字交叉法”测量菌落直径并观察其形态,并于培养第3 天时使用血球计数板测定其产孢量。试验过程中所有处理和对照均重复3 次。
2 结果与分析
2.1 根际盐碱土中木霉菌的分离及筛选
经分离纯化共获得4 株木霉菌株,分别命名为T-A、T-B、T-C 和T-D,且在盐浓度为800 mmol·L−1时,菌株T-B 的耐盐性最强。T-A、T-B、T-C 和T-D相对生长速率分别为18.72、22.72、17.44 和22.44 mm·d−1。
2.2 木霉T-B 菌株形态学鉴定
木霉T-B 菌株在PDA 培养基上培养4 d 时生长较快,基本覆盖整个培养皿并产生大量孢子,菌落正面形态呈现放射状向四周生长,边缘大量分布着白色的菌丝,中央区域可以产生大量分生孢子;菌落背面在培养初期为白色,在后期为淡黄色(图1A和图1B)。分生孢子梗的分枝情况大多为轮生,很少有单生,分枝几乎接近直角。瓶梗主要为单生,呈烧瓶形,中部略微膨大,顶部和基部出现了稍微溢缩的现象(图1C),分生孢子呈无色,为椭圆形或卵圆形(图1D)。结合上述所有形态特征,依据《木霉分类与鉴定》[23]对其进行鉴定,初步将木霉T-B菌株确定为长枝木霉菌。
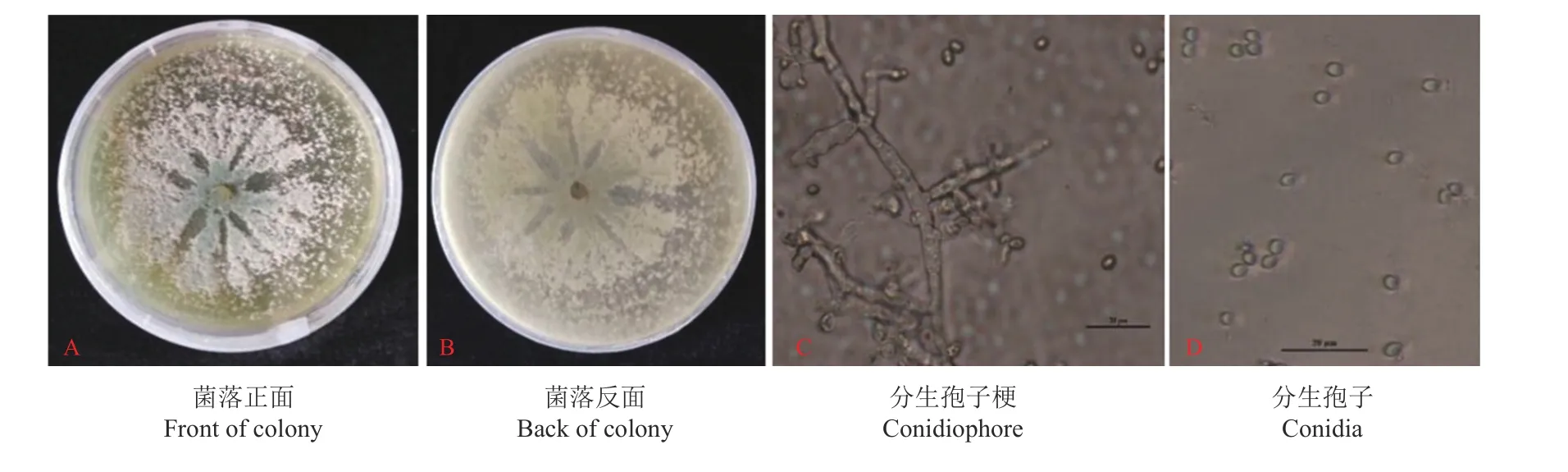
图1 木霉菌株T-B 的形态特征Figure 1 Morphological characteristics of Trichoderma strain T-B
2.3 木霉T-B 菌株分子生物学鉴定
利用通用引物ITS-1 和ITS-4 以及特异性引物TEF-R 和TEF-F 分别对分离得到的木霉菌进行ITS 和TEF 基因序列的扩增,扩增得到的条带分别约为600 和300 bp (图2),并将PCR 扩增获得的T-ITS 和T-TEF 产物经测序后得到的序列分别提交到NCBI 网站,利用Blast1.83 X 软件进行序列比对,利用MEGA5 软件进行多重序列比较,并采用邻接法构建系统进化树(Bootstrap = 500)进行菌株分子生物学鉴定,并结合形态学特征初步将木霉T-B 菌株鉴定为长枝木霉(图3A 和图3B),其与长枝木霉的相似度为99.18%。
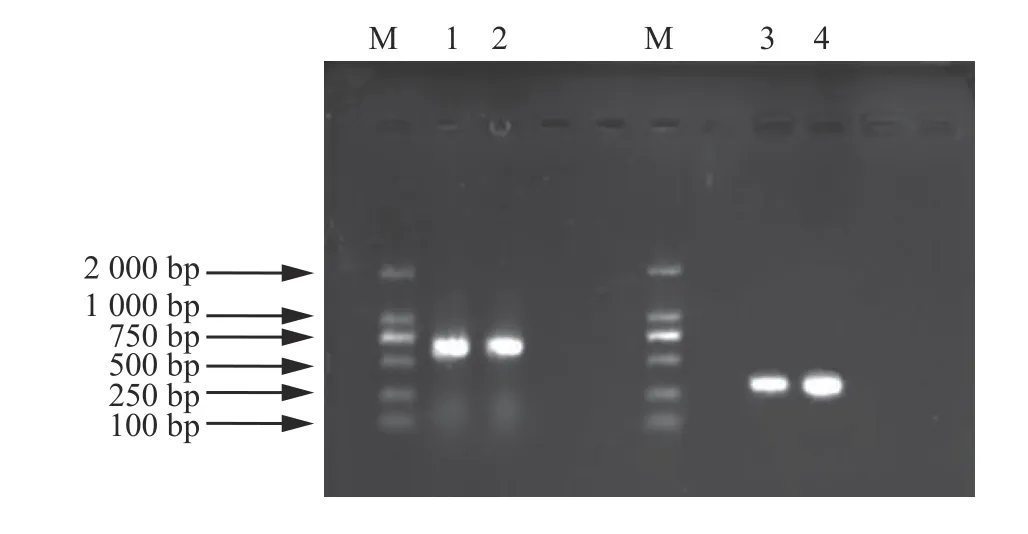
图2 ITS 和TEF 扩增序列的凝胶电泳图Figure 2 Gel electrophoresis diagram of ITS and TEF amplified sequences
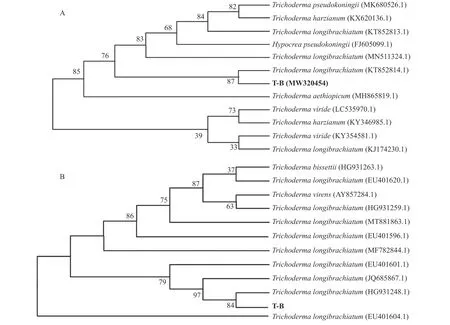
图3 木霉T-B 菌株ITS 和TEF 系统发育树Figure 3 ITS and TEF phylogenetic tree of Trichoderma T-B strain
2.4 长枝木霉耐盐性评价
不同浓度NaCl 处理对长枝木霉菌的生长和产孢量具有不同程度的影响。随着NaCl 溶液浓度升高,长枝木霉菌的生长速率呈降低趋势,且随着培养时间增加,不同浓度NaCl 溶液对其生长的影响效果呈降低趋势。与对照相比(图4ⅠA和图4ⅡG),当NaCl 溶 液 浓 度 为100 mmol·L−1时(图4ⅠB 和图4ⅡH),在培养时间段内(3~7 d)长枝木霉菌的菌落直径与对照无显著差异(P> 0.05) (表2)。当NaCl溶液浓度为200 mmol·L−1时,在培养时间段内(3~4 d) (图4ⅠC 和图4ⅡI),长枝木霉菌的菌落直径与对照无显著差异(P> 0.05) (表2)。当NaCl 溶液浓度为400 mmol·L−1时(图4ⅠD 和图4ⅡJ),在培养3~5 d时长枝木霉菌的菌落直径与对照差异显著(P< 0.05),较对照菌落直径有所降低,但是在培养6~7 d 时,其菌落直径与对照相比无显著差异(P> 0.05),表现出较强的耐盐性(表2)。当NaCl 溶液浓度为600 和800 mmol·L−1时(图4ⅠE、ⅠF、ⅡK 和ⅡL),在培养时间段内(3~7 d)长枝木霉菌的菌落直径与对照相比有所降低,且存在显著差异(P< 0.05) (表2)。同时,与对照相比,当NaCl 溶液浓度为100 mmol·L−1时,在培养7 d 时长枝木霉菌的产孢量显著高于对照(P< 0.05),较对照增加9.17% (表2)。然而,当NaCl溶液浓度大于100 mmol·L−1时,在培养7 d 时长枝木霉菌的产孢量显著低于对照(P< 0.05) (表2)。

图4 不同浓度NaCl 溶液对长枝木霉菌落生长的影响Figure 4 Effect of NaCl solution at different concentrations on the growth of Trichoderma longibrachiatum
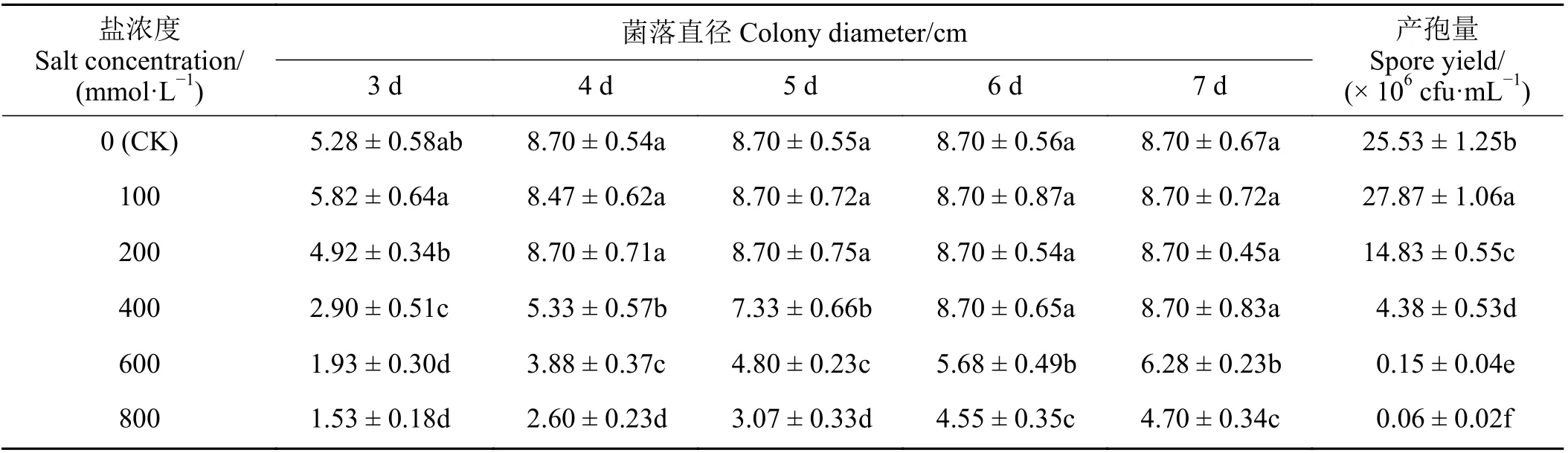
表2 不同浓度NaCl 溶液对木霉T-B 菌株生长的影响Table 2 Effect of NaCl solution at different concentrations on the growth of Trichoderma T-B strain
3 讨论与结论
木霉菌是一类非常重要的多功能有益微生物,不仅具有抗菌杀线的作用,而且具有改良土壤环境和促进植物生长的作用[24]。Zhang 等[25]研究表明长枝木霉T6 菌株具备较强的耐盐能力,并且其在盐胁迫下对小麦的生长具有较好的促生作用。赵忠娟等[22]研究表明哈茨木霉(Tricoderma harzianum)和深绿木霉(T. viride)在高盐胁迫下菌丝生长量可达到50%。本研究结果表明,从盐生草根际土壤中分离获得一株具有较好耐盐活性的长枝木霉T-B 菌株,于培养第3 天时,在盐浓度为100 mmol·L−1时其生长良好,不仅菌丝生长速度较快,而且能产生大量孢子;当NaCl 溶液浓度为800 mmol·L−1时,筛选出的耐盐木霉菌株T-B 菌丝生长量在50%以上,具有较强的耐盐性,为后续研究高耐盐性木霉菌株对盐渍化土壤的修复能力奠定了基础。
Cuppers 等[26]研究表明,低盐有助于促进孢子的产生,在低盐时表现出较强的耐盐性,但高盐对木霉菌的抑制作用较强。本研究结果发现,当NaCl溶液浓度为100 mmol·L−1时,在培养时间段(3~7 d)内长枝木霉菌的生长速率与对照相比无显著差异,并且其产孢量显著高于对照,表明低盐状态下木霉菌的生长不仅不会受到限制,反而会促进其产孢,但是随着NaCl 溶液浓度的升高,NaCl 溶液对长枝木霉菌的生长具有不同程度的抑制作用,其产孢量随着盐浓度增加呈现明显的降低趋势,表明高盐状态下木霉菌菌丝生长以及产孢均受到限制,与前期的研究结果一致。
因此,本研究分离鉴定获得一株具有较强耐盐性的长枝木霉菌株,并发现其在低盐浓度处理下具有较好的耐盐活性,但是有关其耐盐作用机制及其对作物的解盐促生作用还有待进一步研究。
