钛纳米管负载米诺环素羟基磷灰石复合涂层的构建
2021-11-22高啟坤吴明月
高啟坤 吴明月
口腔种植义齿被誉为“人类的第三副牙齿”,是依靠钛种植体支持和固位,成为牙列损失患者的治疗手段之一。但在临床治疗过程中,依然存在2%~3%的失败率,种植体骨结合不佳和种植体周围炎是口腔种植修复失败主要原因。钛基底材质生物化惰性的特性,使其植入体内后存在骨愈合周期长、愈合效果差等缺陷,在骨质、骨量不佳的区域内表现更为明显。而TiO纳米管特有的多孔隙蜂窝状管腔,可以作为活性分子生物化修饰的理想载体,实现材料表面结构化与功能化修饰协同效应,以提高材料的生物相容性。通过阳极氧化法制备钛纳米管,将羟基磷灰石和米诺环素分子同时负载在钛纳米管基材表面,构建具有成骨和抑菌双重效应的复合活性涂层。本研究通过TiO纳米管为基底材质,应用浸泡法将模拟体液中形成的羟基磷灰石晶体负载在TiO纳米管基材表面,构建活性涂层,随后采用滴加法加载盐酸米诺环素,成功构建钛纳米管-羟基磷灰石-米诺环素复合涂层,为钛种植体表面生物化和抗菌化修饰研究提供可能性。现将相关研究结果报道如下。
1 材料与方法
1.1 实验材料和仪器
1.1.1 材料 99.99%高纯度钛片(深圳市海源铝业有限公司);配置氟化胺乙二醇和模拟体液等试剂(天津市致远化学试剂有限公司),均为分析纯。
1.1.2 仪器 直流稳压电源(DY60V6A,深圳市海源铝业有限公司),场发射扫描电镜(Sirion200,FEI,美国Thermo-VG Scientific公司),X射线光电子能谱仪(PHI1500VersaProbe,美国Thermo-VG Scientific公司),傅立叶红外光谱(Thermo Nicolet 8700,美国Thermo-VG Scientific公司),X射线衍射仪(X,Pert PRO,Philip,美国Thermo-VG Scientific公司)。
1.2 实验方法
1.2.1 钛纳米管的电解制备 将购置的成品钛片加工成厚度为0.25 mm、直径为1 mm的圆形钛片,用金刚砂纸打磨成光滑镜面状,清洗干燥。将纯钛片置为阳极,石墨为阴极,置于浓度为90 mmol/L氟化铵乙二醇电解质溶液中,采用两步法阳极氧化,电解系数为6 V 10 min、45 V 50 min。电解结束后用离子水超声清洗,干燥备用。
1.2.2 钛纳米管表面固定羟基磷灰石 将制备好的钛纳米管完全浸入配备好的模拟体液中,参照kokuko等的方法配置模拟体液,调节pH在7.2~7.4。将样品置于水浴锅中,37℃恒温处理7 d,用去离子水反复冲洗,去除物理性吸附的羟基磷灰石晶体,自然风干备用。
1.2.3 米诺环素负载实验 配置1 g/L的米诺环素溶液,取12 μL 的米诺环素溶液平铺在钛纳米管表面,使其负载量达120 μg,干燥备用。
1.2.4 样品表征 利用场发射扫描电镜(field emission scanning electron microscope,FESEM)观察基材表面微观结构,X射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS)分析材料表面薄膜元素构成及含量分布,傅立叶红外光谱(Fourier transform infrared spectroscopy,FTIR)检测基材基团成分,X射线衍射仪(X-ray diffraction,XRD)分析基材表面涂层的分子结构。
2 结果
2.1 样品形貌结构分析 FESEM结果示,纯钛片呈光滑镜面状,未见明显划痕;钛纳米管呈蜂窝管腔状结构,管腔大小较为均一,管径大多集中在50~90 nm,其中70 nm管径约占基材表面的2/3。见图1。

2.2 样品XPS分析 XPS结果示,140eV和350eV处分别出现磷和钙元素的特征性波峰。见表1、图2。

表1 钛纳米管经羟基磷灰石修饰前后表面各元素含量百分比(%)
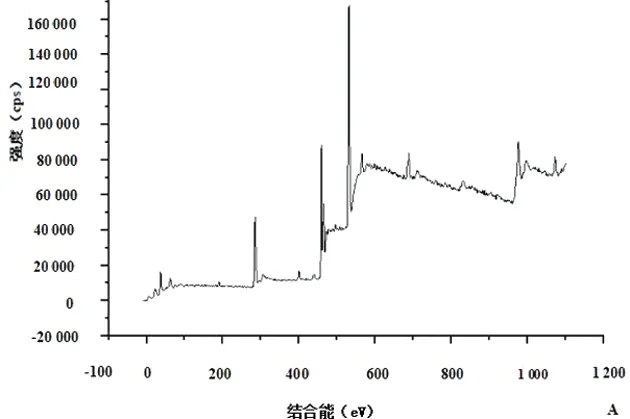

图2 钛纳米管经羟基磷灰石修饰前后XPS分析图谱
2.3 羟基磷灰石修饰后基材的XRD相分析 XRD结果显示,在衍射角度数值2θ=34°、38°、40°和53°可见4个显著的骨样磷酸盐衍射峰。见图3。
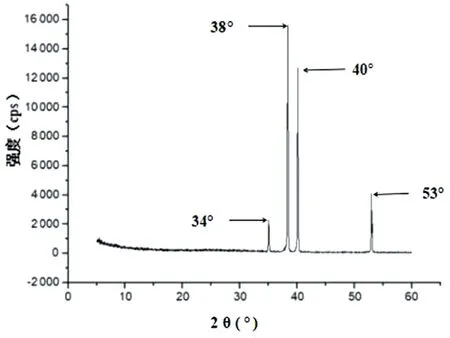
图3 羟基磷灰石修饰后基材的XRD检测结果
2.4 米诺环素修饰后复合涂层的FTIR检测 FTIR图谱显示C=C和苯环官能团的特征性波峰。见图4。

图4 米诺环素修饰后复合涂层的FTIR检测结果
2.5 复合涂层的表面形貌分析 SEM示,钛纳米管-羟基磷灰石基材表面有一薄层、云雾状的灰白色沉积物;钛纳米管-羟基磷灰石-米诺环素样品见大块的絮状物将蜂窝状的纳米管和薄层的羟基磷灰石完全覆盖。见图5。

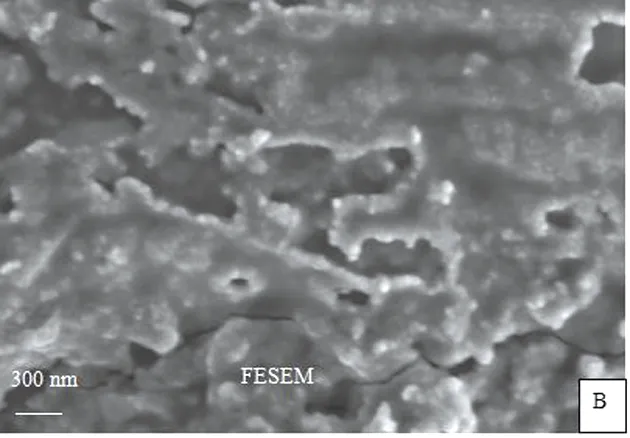
图5 扫描电镜下钛纳米管经羟基磷灰石和
3 讨论
目前,口腔种植修复效果主要取决于近期的骨结合成功率和远期的种植体周稳定性。其中促进骨结合主要有物理、化学、形态学等方法,而通过阳极氧化法制备的钛纳米管,排列高度平整,其一端开口而另一端封闭,管腔可作为容纳生物活性分子的储存器。本课题组前期研究证实70 nm管径的钛纳米管表现出最佳的骨结合促进效应,故选择70 nm管径的钛纳米管作为研究的基材。FESEM图片示:纯钛片呈光滑镜面状,钛纳米管为管距相近、均一分布的蜂窝状结构。
多项研究证实,羟基磷灰石多孔隙、多亲水基团的表面微结构为种植体周-组织界面的细胞生物学活动提供良好的外部环境,继而促进蛋白的吸附和细胞的黏附、生长。本实验采用模拟体液浸泡法,将溶液中的钙磷分子沉积在蜂窝状的钛纳米管基材表面,其中钛纳米管特有的筛孔状结构增加了分子和基材的机械性嵌合力,减少了材料-组织界面的不良应力。通过去离子水反复冲洗吸附的分子,继而表明羟基磷灰石分子与基材并非是简单的物理性吸附,而是蜂窝状、高活性的钛纳米管基材诱导羟基磷灰石晶体的生成与沉积。目前的研究大多集中在种植体生物化改性或抗菌修饰,而实现两者同期修饰研究较少,故本研究可为种植体多重改性提供一种新的思路和方法。目前较为成熟、理想的抗菌修饰是构建抗菌表面,钛纳米管和羟基磷灰石多孔隙、高活性的结构可作为抑菌药物分子的良好载体并有望避免药物突释,发挥其缓释效应。本课题选用针对兼性和专性厌氧菌的广谱抗菌药物米诺环素,将其负载于纳米管-羟基磷灰石表面,利用分子的相互化学反应,稳固附着米诺环素,同时羟基磷灰石分子可作为缓释支架,控制药物分子的释放速率,继而成功构建钛纳米管-羟基磷灰石-米诺环素复合活性涂层。

本实验通过阳极氧化法在钛基材表面形成蜂窝状、均一的纳米管阵列,采用模拟体液浸泡法和盐酸米诺环素滴加法,成功构建钛纳米管-羟基磷灰石-米诺环素复合活性涂层,为种植体表面同期实现生物化改性和抑菌改性提供了新的方法与思路,但该复合活性涂层的缓释动力学、生物学效应尚有待体外细胞学及体内动物实验的进一步验证。
