平喘方调控HMGB1/TLR4通路对哮喘小鼠气道炎症的影响
2021-11-21

〔摘要〕 目的 观察平喘方调控高迁移率族蛋白B1/Toll样受体4(HMGB1/TLR4)通路对哮喘小鼠气道炎症的影响,探索其缓解哮喘气道炎症的潜在机制。方法 将32只BALB/c小鼠随机分为4组:空白组、模型组、地米组、平喘方组,每组8只,采用卵清白蛋白(OVA)联合氢氧化铝腹腔注射和5% OVA雾化吸入激发的方法建立哮喘模型,平喘方组按20 mL/(kg·d)灌胃平喘方汤剂,地米组以等量的地塞米松溶液灌胃,空白组和模型组以等量的蒸馏水灌胃,每日1次,给药干预7 d。各组于最后一次给药后处死小鼠,收集血清、肺泡灌洗液(BALF)及肺组织。HE染色观察肺组织病理学改变;免疫组化染色及定量观察HMGB1、TLR4表达;ELISA法检测BALF及血清中HMGB1、TLR4、IL-4及IFN-γ表达;RT-PCR检测肺组织中HMGB1、TLR4 mRNA表达。结果 (1)与空白组比较,模型组小鼠气道炎性细胞浸润明显,气道壁增厚,管腔狭窄;BALF及血清中HMGB1、TLR4、IL-4含量明显升高(P<0.01),IFN-γ含量明显降低(P<0.01)。(2)與模型组比较,地米组、平喘方组小鼠气道炎症减轻、管腔狭窄减小;BALF及血清中HMGB1、TLR4、IL-4含量明显降低(P<0.05,P<0.01),IFN-γ水平升高(P<0.01)。(3)与地米组比较,平喘方组小鼠气道炎症变化不明显;HMGB1表达增强(P<0.01);BALF中TLR4、IL-4、IFN-γ含量均明显升高(P<0.05,P<0.01),HMGB1含量减少(P<0.01);血清中HMGB1、TLR4含量明显降低(P<0.01),IL-4、IFN-γ含量明显升高(P<0.05,P<0.01)。结论 平喘方可降低哮喘小鼠HMGB1、TLR4、IL-4含量,升高IFN-γ含量,改善哮喘小鼠肺组织炎症,其作用机制可能与平喘方抑制HMGB1/TLR4通路的表达相关。
〔关键词〕 哮喘;平喘方; HMGB1/TLR4通路;炎症
〔中图分类号〕R256.12 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.10.007
Effect of Pingchuan Recipe on Airway Inflammation in Asthmatic Mice by
Regulating HMGB1/TLR4 Pathway
WU Shuyan1, YU Jianer2, XUE Zheng1,2*
(1. Shanghai Municipal Hospital of Traditional Chinese Medicine, Shanghai University of Traditional Chinese Medicine,
Shanghai 200071, China; 2. Institute of Pediatrics of Traditional Chinese Medicine, Shanghai Institute of
Traditional Chinese Medicine, Shanghai 200071, China)
〔Abstract〕 Objective To observe the effect of Pingchuan Recipe on inflammation of asthmatic mice by regulating high
mobility group box 1 protein/toll like receptors 4 (HMGB1/TLR4) signaling pathway, and to explore the internal mechanism of relivering airway inflammation in asthma. Methods 32 BALB/c mice were randomly divided into four groups: blank group, model
group, dexamethasone group, Pingchuan Recipe group, with eight mice in each group. Asthma model was established by intraperitoneal injection of ovalbumin (OVA) combined with aluminum hydroxide sensitization and aerosolized inhalation of 5% OVA. Pingchuan Recipe group was given Pingchuan Recipe at 20 mL/(kg·d) by gavage, dexamethasone group was given the same amount of dexamethasone solution by gavage, blank group and model group were given the same amount of distilled water, once a day, for seven days. Mice in each group were sacrificed after the last administration, serum, bronchoalveolar lavage fluid (BALF) and lung tissue were collected. HE staining was used to observe lungs tissue pathological changes in each group. The positive expression levels of HMGB1 and TLR4 in lungs tissues were observed by immunohistochemical staining and quantification. The expression levels of HMGB, TLR4, IL-4, IFN-γ in BALF and serum were determined by ELISA. RT-PCR was used to detect the expression of HMGB1 and TLR4 mRNA in lungs tissue. Results (1) Compared with blank group, airway inflammatory cell infiltration was obvious, airway wall thickened and lumen narrowed in model group, the content of HMGB1, TLR4 and IL-4 was significantly increased (P<0.01), while the content of IFN-γ was significantly decreased (P<0.01). (2) Compared with model group, airway inflammation and lumen stenosis of mice in dexamethasone group and Pingchuan Recipe group were reduced, the content of HMGB1, TLR4 and IL-4 was significantly decreased (P<0.05, P<0.01), while the level of IFN-γ was increased (P<0.01) in BALF and serum. (3) Compared with dexamethasone group, the changes of airway inflammation in Pingchuan Recipe group were not obvious. The expression of HMGB1 was enhanced (P<0.01). The content of TLR4, IL-4 and IFN-γ in BALF was significantly increased (P<0.05, P<0.01), while the content of HMGB1 was decreased (P<0.01). The content of HMGB1 and TLR4 in serum was significantly decreased (P<0.01), while the content of IL-4 and IFN-γ was significantly increased (P<0.05, P<0.01). Conclusion Pingchuan Recipe can reduce the content of HMGB1, TLR4 and IL-4, and increase the content of IFN-γ, and improve lungs inflammation in asthmatic mice, the mechanism may be related to the inhibition of the expression of HMGB1/TLR4 pathway by Pingchuan Recipe.
〔Keywords〕 asthma; Pingchuan Recipe; HMGB1/TLR4 pathway; inflammation
支气管哮喘是以可逆性气流受限和气道高反应性为主要特征的慢性气道炎症性疾病,主要表现为喘息、咳嗽、气促、胸闷等症状。高迁移率族蛋白B1(high mobility group box 1 protein, HMGB1)主要定位于炎症细胞及气道上皮细胞的细胞核及细胞质,在炎性反应中既可作为早期促炎因子生成介质,又可作为晚期炎性反应的启动因子,在感染、炎症及免疫反应中发挥重要的作用[1-2]。Toll样受体4(toll like receptors 4, TLR4)作为HMGB1的主要受体,位于细胞膜和细胞质,参与支气管上皮细胞的损伤修复[2-3]。研究[4]证实,HMGB1/TLR4信号通路在哮喘的发生发展过程中发挥着重要的作用。
平喘方是海派中医徐氏儿科学术传承人虞坚尔教授的经验方,在临床上治疗小儿哮喘有确切疗效[5]。前期研究[6-9]发现,平喘方可以干预哮喘小鼠树突状细胞分化,增加吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase1, IDO1)、T盒子转录因子(t-transcription factors, T-bet)表达,减少TLR4、肿瘤坏死因子配体超家族成员4(recombinant tumor necrosis factor ligand superfamily member 4, TNFSF4)、转录因子GATA结合蛋白3(GATA binding protein 3, GATA-3)表达,调节辅助性T淋巴细胞1/辅助性T淋巴细胞2(T helper 1 cell/T helper 2 cell, Th1/Th2)免疫失衡,减轻哮喘气道炎症,故推测平喘方可能对HMGB1/TLR4信号通路亦起到干预作用。本研究运用现代分子生物学方法,观察平喘方调控HMGB1/TLR4通路相关因子的表达,为其临床应用提供实验依据。
1 材料与方法
1.1 动物
清洁级雄性BALB/c小鼠32只,体质量(20±2) g,4~6周龄,购于上海斯莱克实验动物有限责任公司(合格证编号:2015000516948),饲养于上海中医药大学市中医医院SPF级实验动物房,于温度20~24 ℃、湿度50%~70%环境下,IVC-Ⅱ型独立送风笼具中饲养。小鼠适应性饲养1周,自由饮食。
1.2 主要药物
平喘方原方组成:炙麻黄6 g,苦杏仁9 g,紫苏子9 g,莱菔子9 g,桃仁6 g,花椒目9 g,地龙干9 g,炙甘草6 g,黄芩6 g。中药购于上海市药材有限公司,药物煎煮时按照原方比例组方,煎煮2次。煎煮提取方法参考李仪奎等[10]的方法,配置灌胃浓度为含生药量5.33 g/mL。醋酸地塞米松片(规格:0.75 mg/片,批号:H31020793)购于上海信谊药厂有限公司,配制成浓度为0.075 mg/mL的溶液。
1.3 主要试剂
卵清白蛋白(ovalbumin, OVA)(批号:A6075)、氢氧化铝凝胶(批号:239186)均购于西格玛奥德里奇(上海)贸易有限公司;HMGB1(批号:101141)、TLR4(批号:H203135M)ELISA试剂盒均购于泉州市睿信生物科技有限公司;白介素4(interleukin 4, IL-4)(批号:F4052)、γ-干扰素(interferon γ, IFN-γ)(批号:PI507)ELISA试剂盒均购于上海泛柯实业有限公司;逆转录试剂盒[批号:9458271,赛默飞世尔科技(中国)有限公司];HMGB1抗体(批号:GT12057,上海睿铂赛生物科技有限公司);TLR4抗体[批号:ab2097642,艾博抗(上海)贸易有限公司]。
1.4 主要仪器
ABI-7300型实时荧光定量PCR检测仪[赛默飞世尔科技(中国)有限公司];TG-16M型低温冷冻离心机(上海卢湘仪离心机仪器有限公司);DNM-9602型酶标仪(北京普朗新技术有限公司);SQ2125型石蜡切片机[徕卡显微系统(上海)贸易有限公司];PRO200型电动匀浆机(上海弗鲁克公司);Tanon-5200成像系统(上海天能科技有限公司);PARI BOYN型超声雾化器(德国帕瑞公司);雾化箱(自制,40 cm×30 cm×25 cm泡沫箱)。
1.5 动物分组及模型制备
适应性饲养1周后,按照随机数字表法将小鼠分为4组:空白组、模型组、地米组、平喘方組,每组8只。根据课题组前期摸索的成熟造模条件[11],将10 g OVA、1 g 氢氧化铝凝胶溶于100 mL生理盐水中,配成浓度为10%的致敏液,每次即配即用。除空白组小鼠注射等量的生理盐水外,其余每只小鼠腹腔注射50 mL/kg致敏液2次,每次间隔1周。末次致敏7 d后,将模型组、地米组、平喘方组的小鼠置于5 L密闭容器中,雾化吸入5% OVA激发液,1次/d,40 min/次,共7 d;空白组同时给予相同体积的生理盐水腹腔注射及雾化吸入。
哮喘模型激发成功的标志[12]:每次雾化时,小鼠出现咳嗽、呼吸加深加快、弓背、口唇四肢末梢紫绀、烦躁甚至跌倒、抽搐等表现。
1.6 给药方法
各组均于末次雾化激发后开始给药,平喘方组以20 mL/(kg·d)的剂量灌胃平喘方汤剂,地米组以等量的地塞米松溶液灌胃,空白组和模型组以等量的蒸馏水灌胃。1次/d,均灌胃7 d。
1.7 标本收集与制备
1.7.1 外周血收集 所有小鼠在灌胃7 d后予以5%的水合氯醛溶液麻醉。将小鼠固定后,充分暴露其眼球,采取摘除眼球的方法收集小鼠血液并置于枸橼酸抗凝管中,充分混匀小鼠血液与枸橼酸,将收集小鼠血液的枸橼酸抗凝管置于离心机上,离心半径20 cm,3 000 r/min,离心10 min,离心完毕后收集上层血浆并置于-20 ℃冰箱保存,用于ELISA检测。
1.7.2 肺组织标本制作 小鼠采集完血液标本后,采取颈椎脱臼离断脊髓的方法处死所有小鼠,开胸暴露肺脏和心脏,迅速用细绳结扎左肺,剪下左肺组织,立即装入DEPC水处理过的EP管,置入-80 ℃冰箱冷冻保存,以备RT-PCR待检;随后经右心室插管,向其内快速灌注4 ℃的生理盐水冲洗右肺组织,至肺叶变成白色时取下,并用4%多聚甲醛固定24 h。
1.7.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)收集 将已暴露肺脏的小鼠回收右肺灌洗液,4 ℃下以2 000 r/min,离心半径20 cm,离心10 min,离心后以PBS重悬细胞沉淀并涂片,将上清液分装,-20 ℃保存,用于ELISA检测。
1.8 检测指标及方法
1.8.1 HE染色观察肺组织病理改变情况 将由甲醛固定的肺组织放入包埋盒中,分别置于流水及不同浓度的酒精中脱水,于二甲苯中脱蜡后对肺组织进行包埋。对包埋好的组织蜡块切至每片4 μm,脱蜡、水化后经苏木精、伊红染色,将透明的切面滴上树脂制成玻片,运用光学显微镜在镜下观察。
1.8.2 免疫组化法检测肺组织HMGB1、TLR4表达 取肺组织样本切片经脱蜡、水化后,运用柠檬酸钠缓冲溶液进行抗原修复15 min,PBS冲洗3次,每次3 min。阻断内源性过氧化物酶的活性,然后按照最佳稀释比例滴加一抗,室温下孵育1 h后运用PBS冲洗3次,加入二抗进行孵育30 min,后运用DAB染色及苏木精染色,最终放置于二甲苯中透明并封片。运用显微镜拍照后分析相关部位,并计算阳性面积。
1.8.3 ELISA检测血清HMGB1、TLR4、IL-4和IFN-γ水平 将保存于-20 ℃冰箱的小鼠血清及BALF上清液取出,严格按照ELISA试剂盒所附操作说明书操作,在450 nm处测吸光值,测定HMGB1、TLR4、IL-4和IFN-γ的实际浓度。
1.8.4 RT-PCR检测肺组织HMGB1、TLR4 mRNA表达 取小块待测肺组织,加入裂解液进行裂解,按照Trizol方法分别测定肺组织中的目标总RNA表达水平。引物序列见表1。PCR反应条件:95 ℃ 5 s,60 ℃ 30 s,40个循环。融解曲线:65 ℃ 30 s。每个样品重复3次,扩增结束,记录Ct值,按照2-△△Ct方法对检测结果进行统计分析,结果用2-△△Ct表达。
1.9 统计学方法
采用SPSS 21.0统计软件分析,数据采用“x±s”表示。用One-Way ANOVA进行方差齐性检验,如方差齐则进行单因素方差分析,并用LSD、SNK进行两两比较;如方差不齐,则运用Lg10+1进行变量转换后符合方差齐,再用One-Way ANOVA程序进行单因素方差分析,并用LSD、SNK进行两两比较。以P<0.05为差异有统计学意义。
2 结果
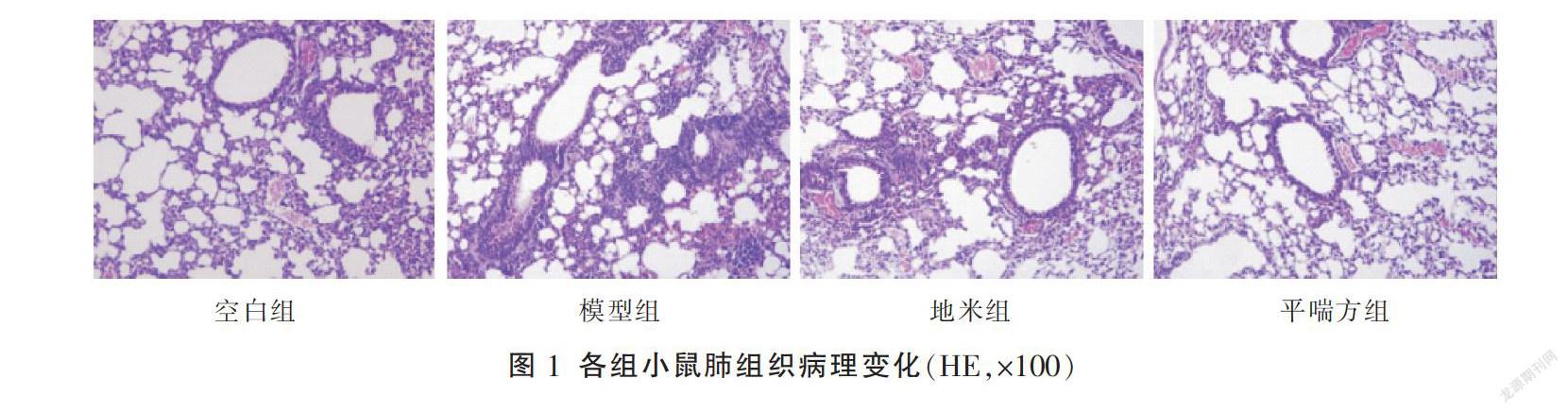
2.1 各组小鼠肺组织HE染色结果
空白组小鼠气道上皮细胞排列整齐,极少量炎症细胞浸润,管腔无明显狭窄,气道壁厚度正常;模型组小鼠气道管壁周围有大量炎性细胞浸润,气道壁及气道平滑肌层明显增厚,同时还可见坏死脱落的气道上皮细胞,管腔明显狭窄;地米组及平喘方组小鼠气道炎症细胞数量明显减少,上皮细胞紊乱及管腔狭窄减轻,气道壁厚度较模型组小鼠明显减少。见图1。
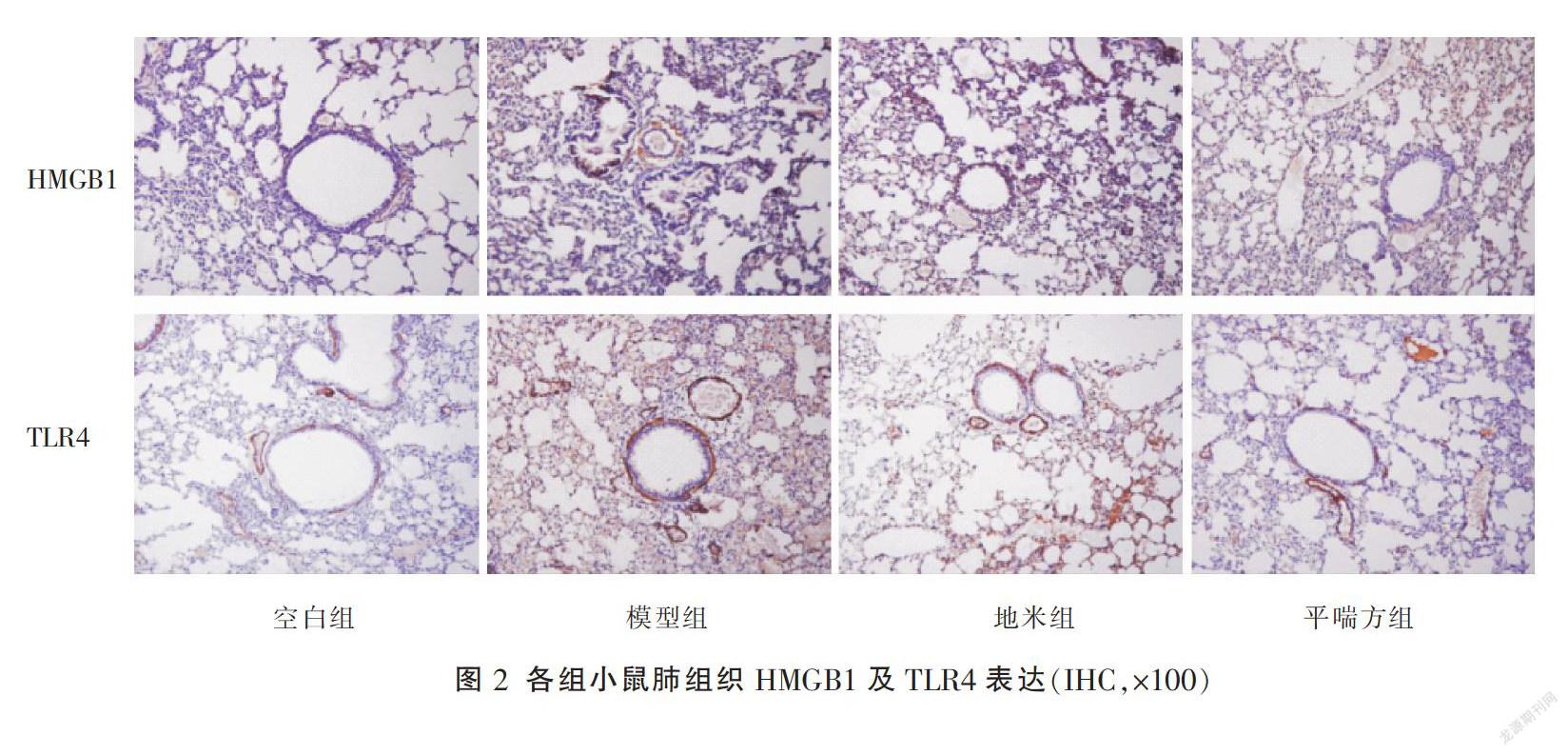
2.2 各组小鼠肺组织HMGB1、TLR4表达水平比较
与空白组比较,模型组HMGB1、TLR4表达明显增强(P<0.01);与模型组比较,地米组及平喘方组HMGB1、TLR4表达减弱(P<0.05,P<0.01);与地米组比较,平喘方组HMGB1、TLR4表达增强(P<0.01)。见图2、表2。
2.3 各组小鼠BALF中HMGB1、TLR4、IL-4及IFN-γ含量比较
与空白组比较,模型组HMGB1、TLR4及IL-4含量明显升高(P<0.01),IFN-γ含量明显降低(P<0.01);与模型组比较,地米组及平喘方组HMGB1、TLR4及IL-4含量明显降低(P<0.01),平喘方組IFN-γ水平升高(P<0.01);与地米组比较,平喘方组TLR4、IL-4、IFN-γ含量均明显升高(P<0.05,P<0.01),HMGB1含量减少(P<0.05)。见表3。
2.4 各组小鼠血清中HMGB1、TLR4、IL-4及IFN-γ含量比较
与空白组比较,模型组HMGB1、TLR4及IL-4含量明显升高(P<0.01),IFN-γ含量明显降低(P<0.01);与模型组比较,地米组及平喘方组HMGB1、TLR4及IL-4含量明显降低(P<0.01),IFN-γ含量升高(P<0.01);与地米组比较,平喘方组HMGB1、TLR4含量明显降低(P<0.01),IL-4、IFN-γ含量明显升高(P<0.05,P<0.01)。见表4。
2.5 各组小鼠肺组织HMGB1、TLR4 mRNA表达水平比较
与空白组比较,其余各组HMGB1、TLR4 mRNA表达水平均明显升高(P<0.05,P<0.01);与模型组比较,地米组、平喘方组HMGB1、TLR4 mRNA表达水平明显降低(P<0.01);与地米组比较,平喘方组HMGB1、TLR4 mRNA表达水平差异无统计学意义(P>0.05)。见表5、图3-4。
3 讨论
哮喘在中医学中称为“喘证”或“哮病”,由外因诱发,触动伏痰,痰随气升,壅塞气道,气逆而上,而发哮鸣气喘。哮喘的难治性在于痰、瘀互结为患。“痰”为哮喘发病的主要病理因素,肺内宿痰内伏,外感侵袭,易导致痰结于气道,肺的宣肃功能失调,气道挛急,发为哮喘[13],故中医常选用化痰平喘药物治疗哮喘。虞坚尔教授认为“血瘀”是哮喘发病的另一病理因素,患儿先天禀赋不足、肺脾气虚,血行不畅,肺中内生瘀血,与“痰”相合产生痰瘀互结之象,令哮喘迁延难愈[14]。虞坚尔教授在三十余年的临床实践种,承前人之理,立化痰祛瘀平喘法,创平喘方,取得很好的效果[15]。课题组临床研究[16]发现,平喘方可以改善哮喘发作期患儿的临床症状,改善肺功能最大呼气峰流速(peak expiratory flow, PEF)、呼出气一氧化氮(fractional exhaled nitric oxide, FeNO)指标,并降低患儿血清嗜酸性粒细胞计数(eosinophil count, EOS)、免疫球蛋白E(immunoglobulin E, IgE)表达,从“化痰祛瘀”角度论治小儿哮喘临床疗效已被证实[17]。相关研究[18]认为,中医“血瘀”可将现代医学中炎症反应包含在内,如临床在运用激素治疗哮喘时常伴有血液黏稠度增高、血栓素B2升高,进而影响血小板和血流变的指标,加重肺部瘀血及气道炎症,当归可通过抑制TLR4/NF-κB炎症通路缓解气道炎症和血瘀状态,达到治疗哮喘的目的。平喘方中炙麻黄宣肺平喘,为君药;苦杏仁、紫苏子、莱菔子、桃仁活血化瘀、止咳平喘,助麻黄使肺气宣降有司,痰、瘀之邪得化或从大肠而走,为臣药;莱菔子、花椒目、地龙、黄芩清肺降气平喘,共为佐药;炙甘草补脾益气、润肺止咳、调和诸药,为使药。平喘方宣肺降气以定其喘,化痰以治其本,兼化瘀以撼其根,标本兼治,以达平喘之目的。
支气管哮喘是由多种细胞以及细胞组分参与的气道慢性炎症性疾病,虽然其发病机制目前尚不完全清楚,但细胞免疫因子起到了调控、延续以及级联放大炎性反应的重要作用[19]。哮喘时,Th1型炎症因子IFN-γ等合成不足,Th2型炎症因子IL-4等合成增加,促使炎性细胞呼吸道浸润,形成呼吸道炎性反应,Thl/Th2失衡是哮喘发病的重要免疫学机制[20]。平衡Thl/Th2炎性反应有利于减轻呼吸道炎症,缓解哮喘症状,而IL-4、IFN-γ在这一过程中发挥重要作用[20]。在本研究中,与空白组比较,模型组BALF中IL-4含量明显升高(P<0.01),IFN-γ含量明显降低(P<0.01),二者呈现相反方向的变化,提示哮喘模型出现了Thl/Th2平衡紊乱。平喘方组IL-4、IFN-γ变化方向与模型组截然相反(P<0.01),提示平喘方可通过减少IL-4水平、增加IFN-γ水平,改善Thl/Th2平衡紊乱,实现对哮喘气道炎症的改善作用。
正常情况下,肺组织HMGB1主要位于细胞核中,处于低表达水平,但对维持肺及气道的正常生理功能具有重要作用[21-22]。近年来,在动物模型和人类疾病的研究上发现,气道上皮受到有害因素攻击后,HMGB1可被主动释放到胞外,与其受体TLR4结合,由此引起下游炎性反应递质如IFN-γ等的释放,引发炎性反应的级联效应,使炎性反应逐级放大[2,23]。TLR4作为HMGB1的主要受体之一,在感受入侵病原体的相关分子模式刺激后,经由胞内信号转导通路,最终促进IL-12、IFN-γ等细胞因子的产生并释放到胞外,引起炎性反应,发挥早期免疫应答的效应[24]。目前普遍认为,Th1/Th2型免疫应答失衡及Th2型优势应答,是哮喘呼吸道炎症形成的基础,TLR4通过调节Th1/Th2型免疫应答在哮喘中发挥作用[25]。基于上述观点,本研究检测了以Th1/Th2型免疫应答失衡为主要病理生理变化的哮喘模型中HMGB1与TLR4的含量变化,发现平喘方能减少哮喘小鼠HMGB1、TLR4 mRNA表达,改善气道炎症,提示平喘方可能通过抑制HMGB1/TLR4分泌,减轻哮喘肺部炎症。
综上所述,平喘方调节HMGB1/TLR4 通路表达,减轻哮喘模型小鼠的气道炎症。
参考文献
[1] 屈东明,侯长春.HMGB1参与调节平滑肌细胞表型转化机制的研究进展[J].中国医学创新,2019,16(23):169-172.
[2] 乔俊英,宋 丽,张艳丽,等.哮喘小鼠HMGB1/TLR4/NF-κB信号通路及维生素D的作用[J].中国当代儿科杂志,2017,19(1):95-103.
[3] 黄 蓉,吴 青,李茂军,等.Toll样受体4在免疫相关细胞中的作用[J].中华临床医师杂志(电子版),2016,10(8):1178-1182.
[4] 乔俊英,张艳丽,宋 丽,等.高迁移率族蛋白B1和Toll样受体4与哮喘气道炎症的关系及维生素D的作用[J].西安交通大学学报(医学版),2017,38(4):529-535.
[5] 吴 杰,虞坚尔,薛 征.平喘方加味治疗小儿哮喘发作期临床疗效观察[J].中华中医药杂志,2013,28(10):3012-3014.
[6] HUANG W F, ZHAO H J, DONG H M, et al. High-mobility group box 1 impairs airway epithelial barrier function through the activation of the RAGE/ERK pathway[J]. International Journal of Molecular Medicine, 2016, 37(5): 1189-1198.
[7] 劉 斐,虞坚尔,薛 征,等.平喘方对哮喘模型小鼠pDC/cDC通路的干预作用研究[J].浙江中医药大学学报,2019,43(7):693-701.
[8] 白 莉,张新光,吴 杰,等.平喘方及其拆方对支气管哮喘小鼠肺组织转录因子T-bet/GATA-3表达的影响[J].世界中医药,2011,6(5):444-447.
[9] 徐万超,虞坚尔,薛 征,等.平喘方对哮喘模型小鼠气道平滑肌内TLR4mRNA和蛋白及相关炎症因子水平的影响[J].辽宁中医杂志,2018,45(10):2196-2199.
[10] 李仪奎.中药药理实验方法学[M].2版.上海:上海科学技术出版社,2006:38.
[11] 朱慧华,虞坚尔,张晓峰,等.平喘方对支气管哮喘模型小鼠巨噬细胞炎性蛋白-1α水平及CD86分子表达的实验研究[J].上海中医药杂志,2008,42(9):58-62.
[12] 赵毅涛,张新光,白 莉,等.平喘方对哮喘模型小鼠肺组织炎症及γ干扰素和白细胞介素4的影响[J].中西医结合学报,2012,10(7):807-813.
[13] 刘 敏,张才圣,柏正平.麻葶舒喘汤对哮喘小鼠气道黏液高分泌的影响及机制研究[J].湖南中医药大学学报,2020,40(12):1449-1455.
[14] 周静冬,虞坚尔.虞坚尔教授辨治小儿哮喘经验[J].吉林中医药,2012,32(7):663-665.
[15] 白 莉,张新光,虞坚尔,等.平喘方及其拆方对支气管哮喘小鼠肺组织转录因子T-bet/GATA-3 表达的影响.世界中医药,2011,6(5):444-447.
[16] 刘 斐,虞坚尔,毛玉燕,等.平喘方治疗小儿哮喘发作期的临床观察[J].中华中医药学刊,2019,37(7):1633-1636.
[17] 李 欣,罗世杰.化痰祛瘀法治疗小儿哮喘初探[J].陕西中医学院学报,2009,32(2):8-9.
[18] 王志旺,付晓艳,姚 楠,等.当归与激素合用对哮喘小鼠的治疗作用及其机制[J].中国应用生理学杂志,2018,34(4):379-384.
[19] ZU KA-PROT M, JAROSZEWSKI J J, MA LANKA T. Involvement of regulatory T cells and selected cytokines in the pathogenesis of bronchial asthma[J]. Post
[20] 李利清,霍莉莉,虞坚尔,等.支气管哮喘与Th1/Th2失衡研究进展.中西医结合学报,2005,3(5):403-407.
[21] E J SHIM, E J ChUN, H S LEE, et al. Role of HMGB-1 in asthma[J]. Clinical and Experimental Allergy, 2012, 42: 958-965.
[22] DI CANDIA L, GOMEZ E, VENEREAU E, et al. HMGB1 is upregulated in the airways in asthma and potentiates airway smooth muscle contraction via TLR4[J]. The Journal of Allergy and Clinical Immunology, 2017, 140(2): 584-587.e8.
[23] WANG H, BLOOM O, ZHANG M, et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999, 285(5425): 248-251.
[24] 李婉雁,田允波,許丹宁,等.Toll样受体与免疫的研究进展[J].畜牧与兽医,2012,44:12-14.
[25] 邹 璐,孙祝美,郭春荣,等.中医药防治支气管哮喘气道重塑相关信号通路研究进展[J].中华中医药杂志,2018,33(11):5057-5060.
