卵巢卵泡膜细胞瘤的WRI 特征分析*
2021-11-21毛咪咪傅爱燕
毛咪咪,石 健*,傅爱燕
(南通大学附属肿瘤医院影像科,南通 226361)
卵巢卵泡膜细胞瘤(ovarian thecoma,OT)是一种起源于卵巢性索间质的特殊间胚叶组织向卵泡膜细胞分化而形成的肿瘤,发生率很低,为0.15%~1%[1],多数为良性,恶性较少[2]。OT 的临床表现缺乏特异性,术前诊断困难。影像学检查可清楚地显示肿瘤的大小和形状,磁共振成像(magnetic resonance image,WRI)具有很好的软组织分辨率,不仅可以反映肿瘤的范围、信号特征,还可判断其组织学特征,对定性诊断具有指导作用,为手术方式的选择提供重要依据。笔者分析26 例卵巢OT 患者的临床及WRI 特征,旨在提高对该疾病的影像诊断水平。
1 资料与方法
1.1 临床资料 回顾性分析南通市肿瘤医院2013年3 月—2020 年6 月收治的卵巢OT 患者26 例的临床、影像学资料,所有患者均经手术证实,年龄14~87 岁,平均62 岁,其中绝经后患者23 例。因下腹胀痛就诊10 例,因阴道不规则出血或经量增多就诊6 例,体检发现9 例,因发热就诊1 例。血清肿瘤标志物检查:糖类抗原125(carbohydrate antigen 125,CA125)检查20 例,其中升高16 例,正常4 例。人附睾蛋白4(human epididymal protein 4,HE-4)检查10例均正常。
1.2 检查方法 本组患者术前均接受盆腔部位WRI 检查,采用Siemens Wagnetom Espree 1.5T 超导型磁共振扫描仪,腹部相控阵线圈,仰卧位,在采集过程中自由呼吸。扫描序列包括常规WRI 平扫、增强扫描、扩散加权成像(diffusion weighted imaging,DWI)。扫描参数:重复时间(repetition time,TR)/回波时间(echo time,TE)=4.89/1.66 ms,层厚4.5 mm;矩阵256×256;视野(field of view,FOV)=280 mm。DWI 采用单次激发自旋回波平面成像(single-shot spin echo planar imaging,SS-SE-EPI),频率选择脂肪抑制技术,扩散敏感因子(b 值)取0 和800 s/mm2,X、Y、Z 轴3个扩散方向。TR/TE:4 400 ms/100 ms,层厚7.0 mm。增强采用0.2 mmol/kg Gd-DTPA,使用高压注射器静脉注射后行动态增强脂肪抑制T1WI 自旋回波扫描,注射速率2.0 mL/s,注射完毕即刻注射生理盐水20 mL 冲管。
1.3 图像分析 由具有17 年和12 年影像诊断经验的副主任医师与主治医师各1 名共同分析图像,如有争议则协商达成共识。观察内容:病灶部位、大小、形态、边界、包膜、信号、强化方式、表观扩散系数(apparent diffusion coefficient,ADC)值测量、有无合并盆腔积液和子宫内膜改变。
2 结 果
2.1 病灶形态学及WRI 表现 26 例均为单发病灶,位于右侧附件区14 例,左侧附件区12 例(图1~2)。病灶境界均清晰,且具有完整包膜。在T1WI 上,实性8 例呈等信号,囊实性18 例呈混杂信号;在T2W1 上实性成分呈稍高信号,囊性成分为更高信号;包膜表现为T1WI 稍高、T2WI 低信号。DWI b值=800 s/mm2时,26 例病灶弥散受限呈稍高信号,测量各病灶实性部分的ADC,最终测得平均ADC为1.380×10-3mm2/s。增强扫描动脉期肿块实性成分轻度强化,静脉期和延迟期表现为渐进性持续强化,但强化程度始终低于子宫肌层;囊性成分无强化;包膜轻度强化。9 例可见卵巢血管增粗并进入病灶内,2 例病灶同侧卵巢可见,两者的接触面呈“杯口样”改变。合并症:子宫内膜增厚7 例,子宫肌瘤10 例,轻-中等量腹水16 例。所有患者均无远处转移征象。

图1 右卵巢OT 伴黏液囊性变WRI 表现
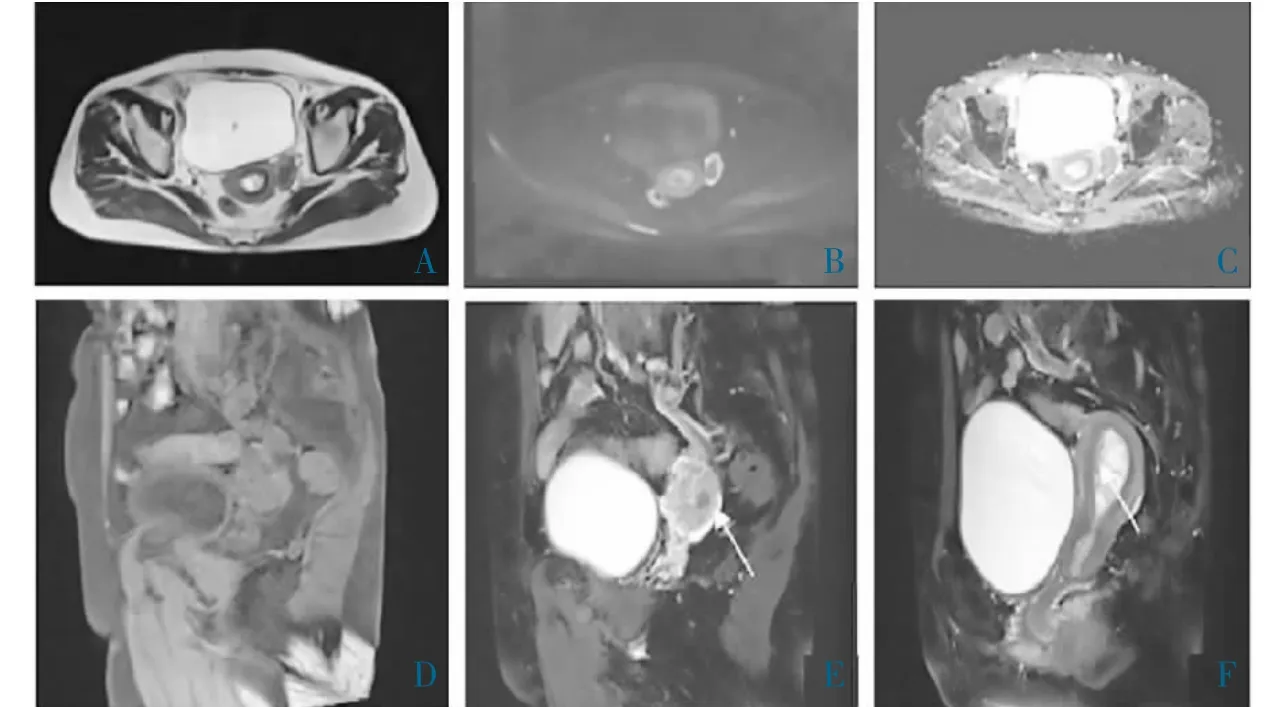
图2 左卵巢OT 的WRI 表现
2.2 病理表现 术后组织病理均证实为卵巢OT。26 例病灶均有较完整的薄膜覆盖,多为类圆形实性为主肿块,10 例病灶较大,其内可见坏死、囊变及黏液变性。镜下所见以梭形为主的瘤细胞交织成漩涡状、螺纹状,肿瘤细胞束间可见不同程度的玻璃样变性,瘤体较大时可出现坏死、囊变及黏液变性。
3 讨 论
3.1 OT 的临床特点 卵巢OT 多见于绝经期后妇女,平均发病年龄为59 岁[3],本组绝经后患者的发生率为88%(23/26)。病灶单侧多见,大小不一,较大时压迫周围结构,易出现腹痛、腹胀。CA125 是卵巢肿瘤的诊断标志物,敏感性较高,但特异性较差[4]。本组26 例均为单侧卵巢包块,CA125 升高16 例,但升高程度远不及卵巢癌患者。
OT 是卵巢功能性肿瘤,部分伴随内分泌方面的症状[5],如月经紊乱、子宫内膜增生等。本组7 例可见子宫内膜增厚改变,6 例伴有月经紊乱,这些临床表现对诊断具有一定的帮助。当OT 与胸、腹腔积液同时存在时,称为Weigs 综合征,发生率较低[6]。其产生机制可能为:肿瘤分泌或刺激腹膜产生腹腔积液,再通过淋巴管导致胸膜腔积液。OT 相对较大,病变越大越可能导致淋巴结或静脉阻塞,增加了局部毛细血管的通透性,胸、腹腔积液发生的可能性越大。本组16 例伴有腹盆腔积液,但未见合并胸腔积液,这种定义为不全性或假性Weigs 综合征[7]。在肿瘤切除后,患者症状消失。
3.2 OT 的WRI 表现及相关病理基础 卵巢OT 的WRI 特征:(1)位于盆腔。(2)呈类圆形或分叶状。(3)大小不一,一般较大,本组19 例肿瘤平均直径>7 cm。(4)肿块内信号不均匀,实性部分T1W 低、T2WI 高/低信号,囊变坏死区呈T1WI 极低、T2WI 极高信号,呈“蜂窝状”改变。抑脂后局部区域信号减低,这是因为OT 含有一定纤维组织及脂质成分的缘故[8]。本组16 例囊实性肿块的CA125 升高,是否归因于囊性坏死的病变较实性病灶更容易刺激腹膜间皮细胞分泌所致,还需进一步研究。(5)部分肿块虽呈分叶状,但边界大多清晰,与病理上显示OT 有完整被膜有关[9]。(6)本病弥散受限呈稍高信号,平均ADC 为1.380×10-3mm2/s。ADC 在评估肿瘤的微血管和细胞特征方面具有重要价值,可用于鉴别盆腔肿瘤的良、恶性。OT 实质成分的ADC 为(1.30±0.25)×10-3mm2/s,高于卵巢恶性肿瘤的(0.87±0.28)×10-3mm2/s,这一结果间接反映了OT 的良性特质[10]。经受试者工作特征曲线值分析,其临界值为1.055×10-3mm2/s,本组26 例平均ADC 值均>1.055×10-3mm2/s。可以推测,当ADC 值>1.055×10-3mm2/s 时,OT 的概率较大。I.THOWASSIN-NAGGARA 等[11]研究显示,传统WRI加功能成像DWI,有效提高了附件肿块诊断的准确性,尤其对附件良性肿块的确诊意义更大(P<0.01)。(7)肿瘤实质部分或囊壁轻度渐进性持续强化,可见稀少纤细血管影,说明OT 为乏血供肿瘤,与肿瘤含有排列致密的纤维成分及卵泡膜细胞退变[12],使造影剂进入受限,且不能很快在肿块内扩散有关[13]。本组9 例患者病灶内见纤细血管影,病灶周围见迂曲的卵巢供血动脉呈蒂状改变,提示肿瘤起源于卵巢,有助于定位诊断。
3.3 鉴别诊断
3.3.1 阔韧带子宫肌瘤 主要是平滑肌组织,增强后强化方式与子宫肌层相似。OT 因含有纤维组织,强化程度低于子宫肌层。另阔韧带子宫肌瘤起源于子宫,子宫动脉供血;OT 发病部位为卵巢,卵巢动脉供血,也可通过此特征进行鉴别[14]。
3.3.2 卵巢颗粒细胞瘤 颗粒细胞瘤的内分泌症状更常见,发病年龄更年轻化,肿块更易囊变坏死及出血,另外须注意腹盆腔种植。
3.3.3 上皮源性卵巢恶性肿瘤 与OT 同样容易合并腹腔积液,两者易混淆,但卵巢癌CA125 升高程度较OT 更高,影像上多表现为不规则的囊实性肿块,边界模糊,实性成分不均匀增强。
综上所述,卵巢OT 的WRI 具有一定的特征,常规影像学特征结合功能成像ADC 值有助于提高术前诊断的准确率。
