依达拉奉对急性缺血性卒中患者外周血自噬及氧化应激水平的影响*
2021-11-20李雪莉杨清武
李雪莉,杨清武
(陆军军医大学第二附属医院神经内科,重庆 400038)
急性缺血性卒中(acute ischemic stroke,AIS)是临床常见的脑血管疾病之一,目前,该疾病呈现“四高”特征,主要表现为发病率、病死率、致残率及复发率高,给社会和家庭带来沉重的经济负担[1]。AIS患者脑梗死区及梗死周围区神经元细胞过度凋亡及坏死是引起患者神经功能障碍的直接原因,同时继发的机体氧化应激及炎症通路的激活可进一步加重神经功能障碍[2]。尽管积极的溶栓和介入取栓在AIS的临床治疗中发挥了重要作用,但有效的药物治疗也不可替代。依达拉奉是一种脑保护剂,可明显抑制脂质过氧化,防止神经细胞及血管内皮细胞的氧化损伤,已广泛用于脑梗死引起的神经病变[3]。近年来,细胞自噬与AIS发生及发展的关系逐渐被人们所认识。有研究表明,在AIS动物模型中机体细胞自噬明显激活,抑制过度激活的细胞自噬可明显改善AIS动物模型神经功能,同时降低其病死率[4]。而依达拉奉是否可降低AIS患者自噬水平,目前尚未见相关文献报道。本研究探讨了依达拉奉对AIS患者外周血细胞自噬、氧化应激及炎症水平的影响,旨在为其临床运用提供理论依据。
1 资料与方法
1.1 一般资料
选取2017年1月至2020年12月本院收治的AIS患者150例作为研究对象,采用随机数字表法分为观察组和对照组,每组75例。两组患者性别、年龄、病程、基础疾病及基础治疗方案等一般资料比较,差异均无统计学意义(P>0.05),见表1。本研究获得本院伦理委员会批准并征得了患者书面知情同意。

表1 两组患者一般资料比较
1.2 纳入标准
(1)满足AIS的诊断标准[5];(2)行静脉溶栓或动脉取栓治疗。
1.3 排除标准
(1)合并脑出血;(2)严重意识障碍;(3)合并恶性肿瘤、自身免疫性疾病及严重感染;(4)入院24 h内死亡;(5)对药物(依达拉奉)过敏。
1.4 治疗方法
对照组入院后根据AIS诊治指南[5]给予相应基础治疗,发病3~6 d内者予以溶栓或取栓规范化治疗,同时给予抗血小板、调脂、降压、脑保护等处理。观察组在常规治疗基础上入院当天即给予依达拉奉(国药集团国瑞药业有限公司,批号20160822,规格20 mL:30 mg)30 mg配以 100 mL生理盐水注射液静脉滴注,每天2次。两组患者均连续治疗2周。两组患者调脂药物均采用阿托伐他汀(美国辉瑞公司)20 mg,每天1次。
1.5 观察指标
1.5.1自噬相关基因mRNA水平
收集两组患者治疗前及治疗2周后外周血标本各2 mL,提取外周血单个核细胞(peripheral blood mononuclear cell,PBMC),采用TRIzol提取总RNA,然后进行反转录,实时荧光定量-聚合酶链反应(polymerase chain reaction,PCR)引物序列见表2。建立20 μL反应体系,包括1 μL cDNA、2 μL×PCR缓冲液、2.0 mmol MgCl2、0.2 mmol dNTP、每种引物1.0 μL及0.5 μL Taq DNA聚合酶。扩增反应条件:94 ℃预变性5 min,94 ℃变性30 s,59 ℃退火45 s;溶解曲线:95 ℃、15 s,60 ℃、1 min,95 ℃、30 s,60 ℃、15 s。以GAPDH作为内参,使用2-ΔΔCt方法计算靶基因相对mRNA水平。
1.5.2外周血炎性和氧化应激指标
分别于治疗前及治疗2周后采集两组患者外周血3 mL,采用酶联免疫吸附试验测定外周血炎性细胞因子[白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]和氧化应激指标[丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)]。具体操作依据试剂盒(南京建成生物技术公司)说明书进行。
1.5.3神经功能
分别于治疗前及治疗2周后采用美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评分和日常生活活动能力(activities of daily living,ADL)量表评估两组患者神经功能。NIHSS评分越低表示神经功能越好,ADL评分越高表示神经功能越好。

表2 PCR引物序列
1.5.4脑血流动力学
分别于治疗前及治疗2周后采用经颅超声多普勒测定两组患者大脑动脉血流情况,包括基底动脉、左右侧大脑中动脉血流等。
1.5.5不良反应
记录两组患者治疗期间不良反应发生情况,包括出血、恶心、呕吐、皮疹等。
1.6 统计学处理
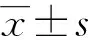
2 结 果
2.1 两组患者治疗前后自噬相关基因mRNA水平比较
两组患者治疗前PBMC中自噬相关基因Beclin-1、LC3-Ⅱ mRNA水平比较,差异均无统计学意义(P>0.05);两组患者治疗2周后上述指标均较治疗前降低,且观察组患者低于对照组,差异均有统计学意义(P<0.05),见表3。
2.2 两组患者治疗前后外周血炎性和氧化应激指标比较
两组患者治疗前外周血氧化应激(MDA、SOD)和炎性指标(IL-1β、TNF-α)比较,差异均无统计学意义(P>0.05);两组患者治疗2周后MDA、IL-1β、TNF-α均较治疗前降低,且观察组患者低于对照组(P<0.05);SOD均较治疗前升高,且观察组患者高于对照组,差异均有统计学意义(P<0.05),见表4。
2.3 两组患者治疗前后神经功能比较
两组患者治疗前神经功能(NIHSS、ADL评分)比较,差异无统计学意义(P>0.05);两组患者治疗2周后NIHSS评分均较治疗前降低,ADL评分均较治疗前升高,且观察组NIHSS评分低于对照组,ADL评分高于对照组,差异均有统计学意义(P<0.05),见表5。
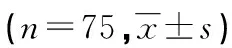
表3 两组患者治疗前后自噬相关基因mRNA水平比较
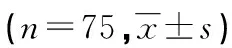
表4 两组患者治疗前后外周血炎性和氧化应激指标比较
2.4 两组患者治疗前后脑血流动力学比较
两组患者治疗前脑血流动力学指标基底动脉、左右侧大脑中动脉血流比较,差异均无统计学意义(P>0.05);两组患者治疗2周上述指标均较治疗前升高,且观察组患者高于对照组,差异均有统计学意义(P<0.05),见表6。
2.5 两组患者不良反应发生情况比较
观察组患者中治疗期间发生出血1例,恶心、呕吐1例,皮疹1例,不良反应发生率为4.0%;对照组患者中治疗期间发生出血1例,恶心、呕吐1例,不良反应发生率为2.7%。两组患者不良反应均较轻微,未经特殊处理症状均自行消失。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。

表5 两组患者治疗前后神经功能比较分)
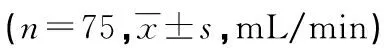
表6 两组患者治疗前后脑血流动力学指标比较
3 讨 论
AIS是脑血管疾病中的危重症,随着我国进入人口老年化,该病发病率及病死率均呈逐年升高趋势。近年来广泛开展的卒中三级预防,对降低AIS发病率及病死率发挥了重要作用,在三级预防的基础上如何进一步提高AIS患者的疗效和改善其预后是目前临床医师关注的重点。AIS的发生机制主要与多种原因如动脉粥样硬化、心源性血栓及小动脉闭塞等引起脑组织血液供应障碍,导致组织缺血、缺氧有关[6]。目前,针对AIS患者已成立卒中中心,采取多种方法进行救治,如第一时间溶栓或取栓恢复脑组织缺血再灌注;积极运用抗血小板、调脂、神经保护等药物,挽救受损神经细胞等。
近年来,相关研究表明,细胞自噬在多种疾病如动脉粥样硬化、急性心肌梗死、恶性肿瘤等的发生及进展中发挥了重要作用[7-9]。细胞自噬是机体通过吞噬及降解受损细胞质及细胞器,维持机体细胞代谢稳定的过程。但一旦机体遭受某些刺激如缺血、缺氧、酸中毒等,可显著激活机体细胞自噬[10]。目前,有研究表明,细胞自噬在AIS发生后神经细胞凋亡中起着双重作用,一方面AIS发生可促进机体细胞自噬的过度激活,进一步导致神经元凋亡和坏死,并增加脑梗死面积和加重神经功能的缺损;另一方面若在脑组织缺血缺氧前激活细胞自噬可显著降低神经元死亡和脑损伤程度[11-12]。因此,自噬在AIS发生、发展中的作用可能取决于其激活的时间差异(AIS发生前或后)及程度。
依达拉奉作为神经保护剂,通过有效清除氧自由基,减轻神经细胞损伤,但对细胞自噬通路的影响目前尚未见相关文献报道。本研究结果显示,针对AIS患者在常规治疗的基础上加用依达拉奉可明显降低机体过度激活的细胞自噬。有研究表明,过度的细胞自噬可促进细胞凋亡,进而激活氧化应激及炎性通路,加重组织器官损伤及细胞功能障碍[13]。对AIS患者,依达拉奉可明显降低机体氧化应激和炎性相关指标水平,其可能与依达拉奉降低机体过度激活的细胞自噬有关。
NIHSS、ADL评分是评价AIS患者临床疗效及预后的关键指标,NIHSS评分越高表示神经功能越差,ADL评分越高表示神经功能越佳。本研究结果显示,在常规治疗基础上依达拉奉可明显降低NIHSS评分,升高ADL评分,更有效地恢复AIS患者受损的神经功能,与其他研究结果一致[14]。除NIHSS、ADL评分外,脑血流动力学也是一项评估AIS患者临床疗效的重要指标。本研究结果显示,依达拉奉可明显改善AIS患者脑血流,可能与降低细胞自噬、改善氧化应激及炎性反应,从而降低血液黏度、抑制血小板黏附与聚集、同时改善血管内皮功能有关。针对AIS患者在常规治疗基础上加用依达拉奉并未明显增加不良反应发生率,说明在提高AIS患者疗效及预后的同时安全性较好,值得临床进一步推广运用。
综上所述,依达拉奉可明显降低AIS患者机体过度激活的细胞自噬及下游氧化应激和炎性通路的激活,从而减轻脑组织缺血再灌注损伤,有助于恢复受损的神经功能。但目前依达拉奉如何降低细胞自噬的相关机制尚需进一步通过动物及细胞实验予以研究。
