主要含透明质酸的生物贴膜抑制BALB/c小鼠AD模型炎症反应及恢复其皮肤屏障功能的实验研究
2021-11-20刘付华
刘付华,何 黎,顾 华※
(1.广州医科大学第六附属医院清远市人民医院皮肤性病科,广东 清远 511500;2.昆明医科大学第一附属医院皮肤科/云南省皮肤病性病研究所,云南 昆明 650032)
特应性皮炎(AD)是一种慢性复发性、瘙痒性、炎症性皮肤病,影响全世界10%~20%的儿童和1%~3%的成人[1]。AD的发病机制十分复杂,涉及遗传因素、皮肤屏障的缺陷、免疫功能失调[2]。AD是以Th2型细胞因子优势表达为特点的慢性皮肤病,与皮肤细胞免疫相关并产生过多的IgE[3]。Th细胞分为3种亚类,PTh细胞,是指初始CD4+T细胞,主要分泌IL-2;Th1细胞,主要分泌IL-2、IL-12、IFN-r、TNF-a,并介导细胞免疫;Th2细胞,主要分泌IL-4、IL-5、IL-10、IL-13,并介导体液免疫[4]。参与AD发病的细胞因子众多,急性期AD皮损中Th2型细胞因子IL-4、IL-5、IL-13的mRNA水平增高[5],而Th1型细胞因子IL-12、IFN-r水平低。慢性期AD皮损中有大量IFN-r、IL-5、IL-12。说明AD中的细胞因子表达是双相模式:即急性期以Th2型为主,慢性期以Th1型为主[6]。Elias等[3]认为特应性皮炎患者表现为皮肤屏障功能异常,包括渗透屏障和抗微生物屏障的受损。提出特应性皮炎发病的新理论,屏障功能破坏不再是单纯的结果,而是湿疹发病的重要致病因素,并提出了AD外—内—外的发病新模式[7-8]。
AD的基本治疗包括最佳的皮肤护理,常规使用润肤剂,解决皮肤的屏障缺陷和保持皮肤含水量,避免特异性和非特异性的触发因素。外用糖皮质激素是治疗急性发作的主要药物,但不能长期使用。局部外用他克莫司或吡美莫司等calcineurin抑制剂为二线治疗。因此,AD的治疗目前仍是比较困难,开发新的治疗方法是必要的[9]。
透明质酸(HA)是皮肤细胞外基质的主要组成部分。HA在皮肤科的临床应用包括作为一种生物材料、生物工程用途、皮肤填充剂,也可促进伤口愈合、保湿[10]。马齿苋是一种含许多生物活性化合物的草药,具有抗炎、促进溃疡愈合、抗真菌和抗氧化的作用[11],含马齿苋提取物膏药应用于烧伤、皮肤疾病、润肤,可促进伤口愈合,并减少疼痛和炎症。青刺果由于其富含油酸、亚油酸、棕榈酸、硬脂酸、γ-亚麻酸等不饱和脂肪酸及丰富的脂溶性维生素,接近人体皮肤角质层脂质的成分,因此具有保湿和皮肤再生修复作用,同时具有皮肤渗透能力[12]。青刺果的医学护肤品可以补充皮肤角质层水分,帮助皮肤恢复屏障功能,延缓皮肤老化,且耐受性很好[13]。本实验使用含有透明质酸、马齿苋及青刺果油的生物活性贴膜治疗BALB/c小鼠AD模型观察其疗效。
1 材料和方法
1.1 材料 实验动物:雄性SPF级纯系BALB/c小鼠(购自北京维通利华实验动物中心),6周龄。实验开始前放置在SPF实验室中1周,使其适应环境,房间温度保持在(22±2)℃,湿度保持在(50±10)%,照明时间为早8点至晚8点,自由取食。主要试剂和仪器:小鼠炎症因子定量抗体芯片1(Quantibody®Mouse Inflammation Array1、2,4硝基氯苯(DNCB)、4-乙氧基亚甲基-2-苯基恶唑啉-5-酮(OX)、丙酮、小鼠血清IgE ELISA 试剂盒、CK6、CK10、CK14、丝聚合蛋白、兜甲蛋白、刻度盘氏测厚仪、TewameterTM仪。
2 实验方法
2.1 BALB/c脱毛 小鼠双耳及周边毛发均匀涂人用脱毛膏(购自日本株式会社Aquaverite)约1ml,作用5min后,用医用棉签蘸清水清洗干净,小鼠放置适应恢复3d,见图1。

图1 小鼠脱毛后
脱毛膏脱毛3d后的小鼠,未见炎症反应,与正常小鼠耳相似。
2.2 实验分组 将BALA/c小鼠随机分为8组:A正常组15只,B丙酮组15只,模型组75只,模型组造模2周后随机分为C模型组15只,D空白基质组、E空白基质+透明质酸组、F空白基质+透明质酸+马齿苋组、G空白基质+透明质酸+青刺果油组、H空白基质+透明质酸+马齿苋组+青刺果油组各12只。
2.3 BALB/c小鼠模型建立的方法 AD皮损诱导参考Hideki kitagaki[5]等和Eun-Ju Choi[6]等文献并稍加改动。BALB/c小鼠双耳和足垫应用1%的DNCB各20ul致敏,以后每3d1%DNCB双耳20ul,于第7日用1%的OX双耳20ul加强致敏,连续6周。观察皮损变化及搔抓情况,分别于治疗前、治疗1周、治疗2周、治疗3周和治疗4周每组各处死3只小鼠,眼眶取血,鼠耳皮损剪除送组织病理,电镜观察,部分鼠耳皮损-80℃保存,标本全部收齐后待检。
2.4 鼠耳厚度 采用刻度盘式测厚仪测量鼠耳厚度,统一同一部位测小鼠耳廓上缘,每3d测量一次。
2.5 血清总IgE水平测定 眼科镊子眼眶取血后,迅速离心(3 000r/min,20min),取上层血清,立即-80℃冻存待检。标本全部收齐后,应用IgE ELISA Kit检测血清总IgE水平,操作按试剂盒说明书进行,显色终止后立即在酶标仪上测定吸光度(A450)值,制作标准曲线,按曲线换算样品中IgE浓度。
2.6 组织病理HE染色 处死的鼠耳皮损1份,4%中性甲醛固定,皮损脱水、透明、浸蜡,石蜡包埋、切片、脱蜡,苏木精染色5min,伊红染色1min,脱水、中性树胶封片。
2.7 蛋白芯片分析炎症因子 鼠耳皮损1份,d枰称取约40ug,消毒眼科剪刀剪碎皮损,加入含PMSF400ul裂解液,低速电动研磨器冰上充分研磨,4℃离心(14 000r/min,15min),取上层清液,分光光度计测出样本蛋白浓度,所有样品蛋白浓度稀释为同一浓度100ug/ml,应用小鼠炎症因子定量抗体芯片1分析样品,操作按小鼠炎症因子定量抗体芯片1说明书操作,操作完毕采用激光扫描仪Axon GenePix扫描信号,采用Cy3或者绿色通道(激发频率=532nm),PMT=700;采用Genepix 4000B软件提取荧光信号原始数据;采用RayBio QAM-INF-1的数据分析软件来进行数据分析。
2.8 电镜检测板层小体 鼠耳朵皮损立即固定于1%戊二醛电镜液内,4℃保存待检。标本收齐后送昆明医科大学电镜室观察表皮颗粒层内板层小体的变化。
2.9 免疫组化 ① 4%的甲醛溶液固定、石蜡包埋、切片、脱蜡;3%过氧化氢,室温孵育10min;0.01%mol/L枸橼酸钠抗原修复液,高压法抗原修复5min;5%封闭用绵羊血清封闭30min;一抗,37°C孵育1h;二抗,37°C孵育30min。洗涤步骤:以PBS漂洗3次,每次5min。DAB显色,脱水,封片。② 结果判断。
2.10 无创性皮肤生理功能测定 ① 皮损水分含量和TEWL:分别于治疗前、治疗1周、治疗2周、治疗3周和治疗4周测鼠耳皮损水分含量和TEWL,每组每次测10处皮损,所有的检测均在室温为(23~25)℃、湿度为50%~60%的室内进行。② 采用Moisture Checker(日本SCALAR公司)测量皮损水含量;采用Tewameter TM仪(德国Courega+Khazaka公司)测量皮损 TEWL[单位:g/(cm²·h)]。
2.11 统计方法 统计学分析使用SPSS 17.0软件包,计量资料用()表示,行t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 鼠耳皮损情况 连续观察6周,BALB/c鼠丙酮组双耳和正常组无明显变化,模型组双耳1周后明显增厚,出现红斑、鳞屑及血痂,见图2,小鼠出现搔抓。生物活性贴膜治疗组治疗4周后可见淡红斑,无明显的鳞屑及血痂,搔抓不明显,H组尤其明显,见图2。

图2 不同时间不同组小鼠皮损变化
图2中的A、B、C分别表示正常组、丙酮组和模型组。模型鼠鼠耳出现明显的红斑、鳞屑和血痂。正常组和丙酮组无明显变化,模型组可见明显的红斑、鳞屑及血痂,空白基质组治疗效果欠佳,生物活性贴膜治疗组红斑明显变淡,鳞屑、结痂基本消退。14d、21d、28d、35d、42d分别代表治疗前、治疗1周、2周、3周和4周,D为空白基质组,E为空白基质+透明质酸组,F为空白基质+透明质酸+马齿苋组,G为空白基质+透明质酸+青刺果油组,H为空白基质+透明质酸+马齿苋组+青刺果油组。
3.2 鼠耳厚度 模型组鼠耳厚度与正常组和丙酮组比较显著增厚,治疗组耳厚度明显好转,42d时H组与其他各组比较,P<0.05。14d时模型组与正常组和对照组比较,*P<0.05;21d、28d、35d、42d时基质组与模型组比较,#P>0.05;42d时H组与E、F、G组比较,##P<0.05;42d时E、F、G、H组与C、D组比较,P<0.05。见表1。
表1 不同时间不同组鼠耳厚度的比较(,mm)

表1 不同时间不同组鼠耳厚度的比较(,mm)
组别 14d 21d 28d 35d 42d A 组 29.60±1.17 29.70±1.06 29.40±0.97 30.00±1.05 29.83±0.75 B 组 30.30±1.34 30.10±1.37 30.30±0.95 30.10±1.37 29.67±0.82 C 组 59.7±4.35* 53.70±2.50 49.60±2.22 54.50±2.64 53.50±1.87 D 组 50.60±4.30# 45.90±2.30# 51.50±3.21# 52.50±1.05#E 组 48.60±2.95 44.30±2.83 49.40±3.86 50.33±0.82 F 组 47.10±3.03 42.60±2.12 46.30±3.59 49.33±1.21 G 组 47.60±2.07 43.20±2.57 44.70±2.95 47.17±1.47 H 组 46.20±3.94 42.80±2.25 45.10±2.51 44.50±1.87##
3.3 组织病理 HE染色光学显微镜下观察,正常组和丙酮组组织病理相差不大;经1%DNCB和1%OX反复致敏的模型鼠耳组织特点为表皮增厚,真皮毛细血管扩张,可见中性粒细胞、淋巴细胞和少许嗜酸性粒细胞浸润,见图3。治疗后表皮变薄,血管炎扩张减轻,炎症浸润明显减少,H治疗组尤其明显。

图3 不同时间不同组小鼠皮损组织病理变化(HE×40)
3.4 血清总IgE 产生IgE是AD的一个重要特点,应用1%DNCB和1%OX反复致敏BALA/c鼠后引起鼠血清总IgE明显升高,每组数据为处死的3只小鼠IgE的平均值。模型组鼠与正常组和丙酮组比较血清总IgE明显升高,有统计学意义(P<0.05),正常组与丙酮组相比差异无统计学意义(P>0.05),具体见表2。42d时E、F、G、H组与C、D组两两比较,*P<0.05;H组与E、F、G组比较,#P<0.05。
表2 不同时相组别血清总IgE浓度比较(,IU/ml)
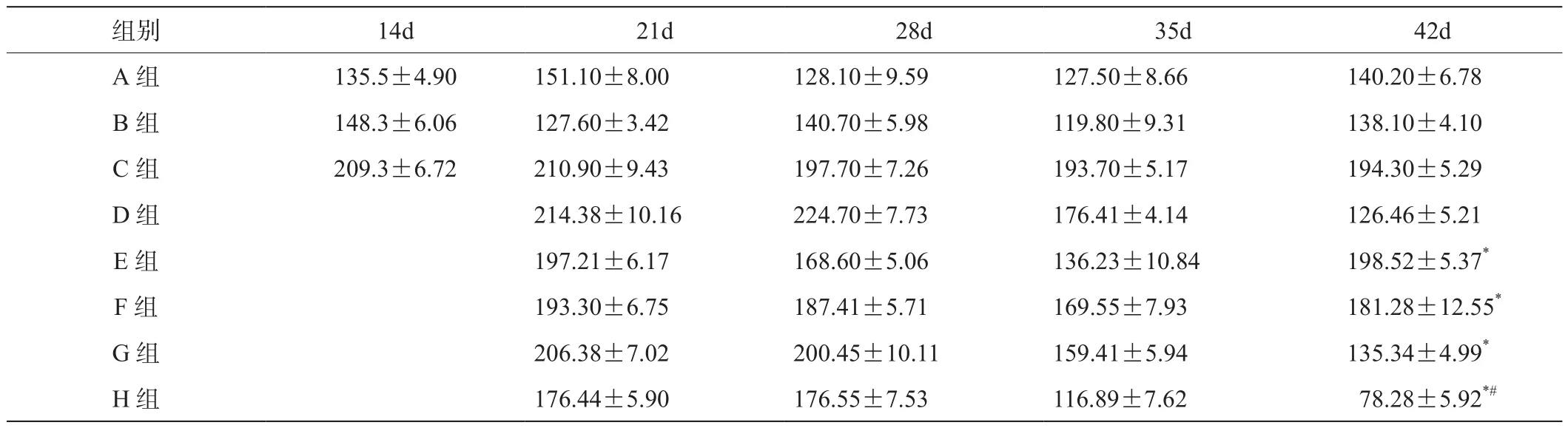
表2 不同时相组别血清总IgE浓度比较(,IU/ml)
组别 14d 21d 28d 35d 42d A 组 135.5±4.90 151.10±8.00 128.10±9.59 127.50±8.66 140.20±6.78 B 组 148.3±6.06 127.60±3.42 140.70±5.98 119.80±9.31 138.10±4.10 C 组 209.3±6.72 210.90±9.43 197.70±7.26 193.70±5.17 194.30±5.29 D 组 214.38±10.16 224.70±7.73 176.41±4.14 126.46±5.21 E 组 197.21±6.17 168.60±5.06 136.23±10.84 198.52±5.37*F 组 193.30±6.75 187.41±5.71 169.55±7.93 181.28±12.55*G 组 206.38±7.02 200.45±10.11 159.41±5.94 135.34±4.99*H 组 176.44±5.90 176.55±7.53 116.89±7.62 78.28±5.92*#
3.5 炎症因子 小鼠炎症因子定量抗体芯片1结果图像见图4,每个样品的一个炎症因子有4个荧光信号。小鼠炎症因子定量抗体芯片1检测造模14d,治疗后2周、44周时皮损内IL-4、IL-5、IL-13、IL-12、IFN-r。应用Genepix 4000B软件提取荧光信号原始数据,每个样品为4个荧光信号数据值。造模14d时IL-4、IL-5、IL-13的4个荧光信号数值,模型组与正常组、丙酮组比较,P<0.05,差异具有统计学意义,而IL-12、IFN-r比较,P>0.05,差异无统计学意义,见表3;治疗2周时IL-4、1L-5、IL-13的荧光信号数值治疗组与基质组、模型组比较,P<0.05,差异具有统计学意义,而IL-12、IFN-r比较,P>0.05,差异无统计学意义,见表4;治疗4周时IL-4、1L-5、IL-13、IL-12、IFN-r的荧光信号数值,治疗组与模型组比较,P<0.05,差异具有统计学意义,而IL-12、IFN-r治疗组与丙酮组比较,P>0.05,差异无统计学意义,见表5。每个样品的4个信号数据值,采用RayBio QAM-INF-1的数据分析软件计算出样品的浓度(4个信号的平均值)并绘制成柱状图,见图5。从柱状图中可看到,造模14d时模型组IL-4、IL-5、IL-13含量增多,IL-12、IFN-r含量减少;治疗后2周和4周皮损中IL-4、IL-5、IL-13含量减少,IL-12、IFN-r含量增加。

图4 小鼠炎症因子定量抗体芯片1结果图像
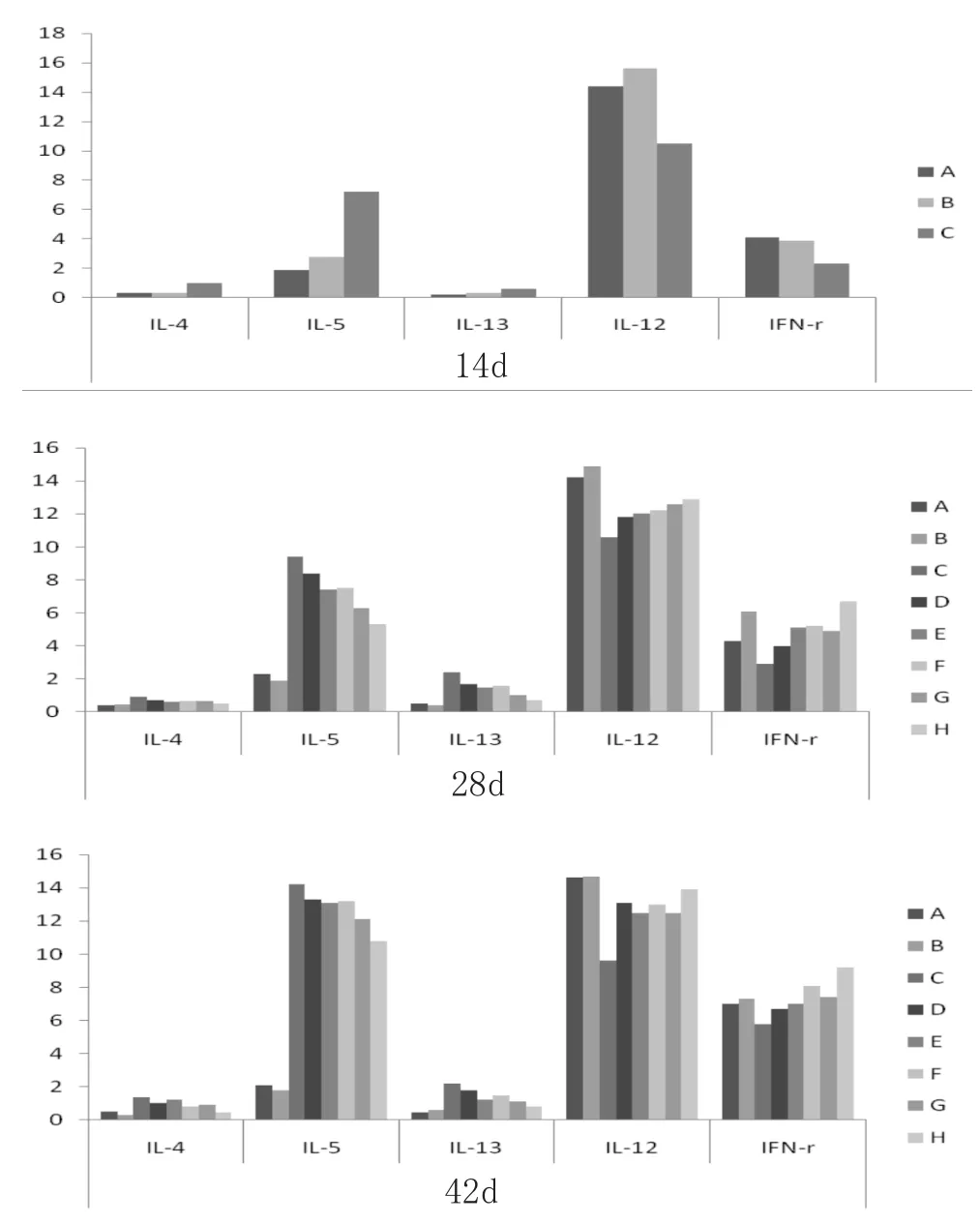
图5 不同时间不同组小鼠皮损炎症因子的浓度(pg/ml)
表3 造模14d时不同组别炎症因子荧光信号值比较(,n=4)
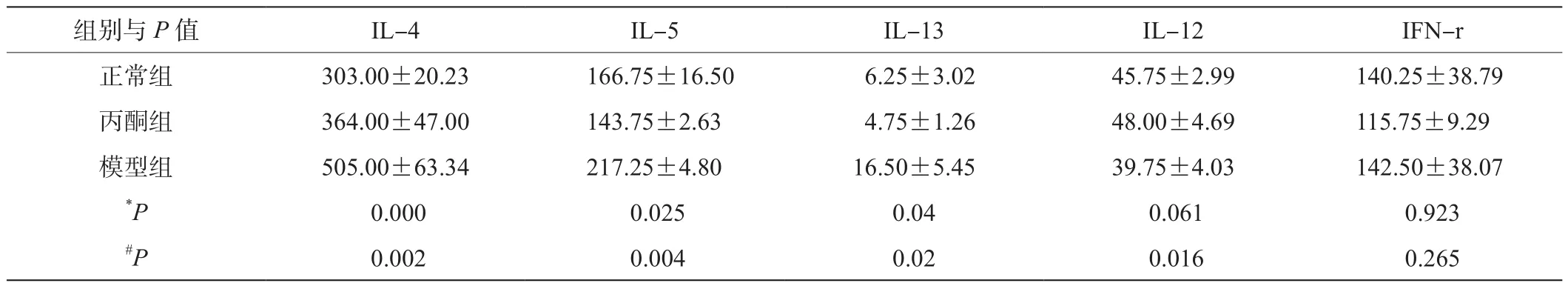
表3 造模14d时不同组别炎症因子荧光信号值比较(,n=4)
注:*P示模型组与正常组比较的P值;#P示模型组与丙酮组比较的P值。
组别与P值 IL-4 IL-5 IL-13 IL-12 IFN-r正常组 303.00±20.23 166.75±16.50 6.25±3.02 45.75±2.99 140.25±38.79丙酮组 364.00±47.00 143.75±2.63 4.75±1.26 48.00±4.69 115.75±9.29模型组 505.00±63.34 217.25±4.80 16.50±5.45 39.75±4.03 142.50±38.07*P 0.000 0.025 0.04 0.061 0.923#P 0.002 0.004 0.02 0.016 0.265
表4 治疗2周后不同组别炎症因子荧光信号值比较(,n=4)
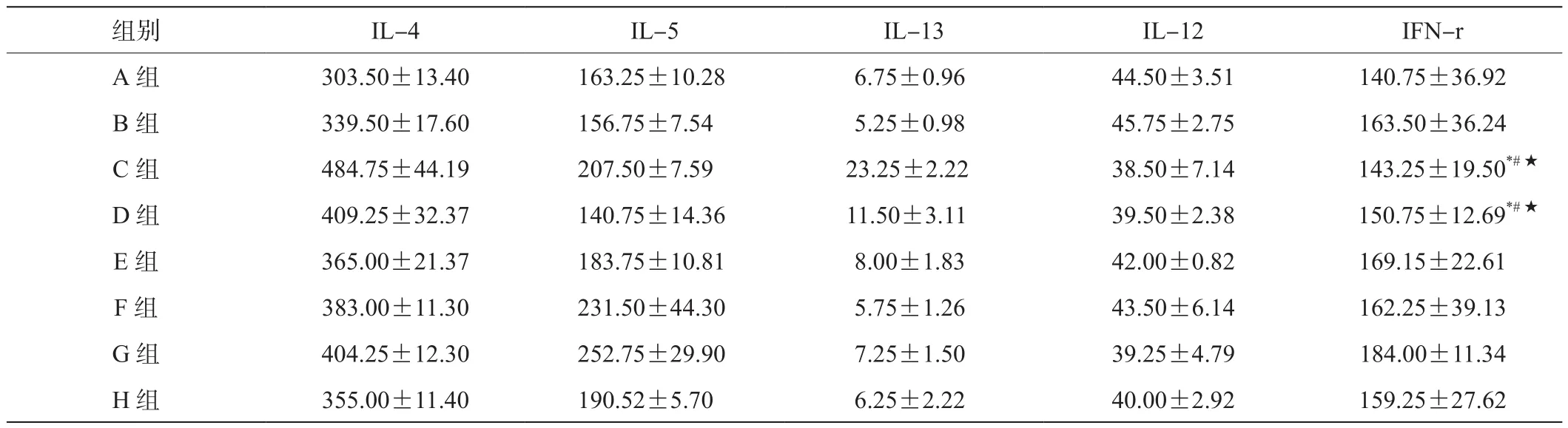
表4 治疗2周后不同组别炎症因子荧光信号值比较(,n=4)
组别 IL-4 IL-5 IL-13 IL-12 IFN-r A 组 303.50±13.40 163.25±10.28 6.75±0.96 44.50±3.51 140.75±36.92 B 组 339.50±17.60 156.75±7.54 5.25±0.98 45.75±2.75 163.50±36.24 C 组 484.75±44.19 207.50±7.59 23.25±2.22 38.50±7.14 143.25±19.50*#★D 组 409.25±32.37 140.75±14.36 11.50±3.11 39.50±2.38 150.75±12.69*#★E 组 365.00±21.37 183.75±10.81 8.00±1.83 42.00±0.82 169.15±22.61 F 组 383.00±11.30 231.50±44.30 5.75±1.26 43.50±6.14 162.25±39.13 G 组 404.25±12.30 252.75±29.90 7.25±1.50 39.25±4.79 184.00±11.34 H 组 355.00±11.40 190.52±5.70 6.25±2.22 40.00±2.92 159.25±27.62
表5 治疗4周后不同组别炎症因子荧光信号值比较(,n=4)
表5 治疗4周后不同组别炎症因子荧光信号值比较(,n=4)
组别 IL-4 IL-5 IL-13 IL-12 IFN-r A 组 313.00±20.23 165.50±11.79 7.75±0.96 46.50±2.65 175.50±10.66 B 组 301.75±16.13 157.00±7.62 9.00±2.16 44.50±3.00 176.75±18.23 C 组 564.50±18.43 258.00±39.03 25.00±4.97 37.50±7.14 136.50±7.94*#★D 组 403.75±52.92 237.50±4.65 21.75±2.99 42.25±2.22 146.50±23.81*#★E 组 425.25±48.66 237.00±14.77 17.25±1.89 45.50±3.31 156.75±14.91 F 组 341.15±38.34 240.00±14.02 18.23±2.65 44.25±3.30 173.59±8.79 G 组 429.50±36.66 232.75±12.00 15.33±3.23 42.75±5.32 161.75±11.16 H 组 325.25±28.66 217.59±9.02 13.11±3.37 43.75±2.87 186.75±12.89
E、F、G、H 组 IL-4与 C、D 组比较,*P< 0.05;E、F、G、H组间比较,P>0.05;E、F、G、H组IL-5与C、D组比较,#P<0.05,组间H与E、F、G组间比较P<0.05。IL-13E、F、G、H与C、D组比较,★P<0.05,E、F、G、H组间比较,P>0.05。A、B、C、D、E、F、G组IL-12比较,P>0.05。A、B、C、D、E、F、G组IFN-r比较,P>0.05。
E、F、G、H组IL-4与C、D组比较,*P<0.05,E组与F、G、H组间比较,P<0.05。E、F、G、H组IL-5与C、D组比较,#P<0.05,组间H与E、F、G组间比较,P<0.05。E、F、G、H组IL-13与C、D组比较,★P<0.05,H组与E、F、G组间比较,P>0.05。A、B、C、D、E、F、G组IL-12比 较,P>0.05。E、F、G、H组 IFN-r与 C、D 组比较,P<0.05,H组与F、G、H组比较,P<0.05。
14d时模型组IL-4、IL-5、IL-13浓度明显升高,IL-12、IFN-r浓度降低;治疗2周和4周后治疗组和基质组的IL-4、IL-5、IL-13浓度明显降低,IL-12、IFN-r浓度升高,H治疗组效果明显。
3.6 板层小体检测 板层小体合成、分泌神经酰胺等细胞间脂质成分,数量及功能决定细胞间脂质含量。本实验发现模型组的板层小体肿胀,明显减少,而治疗组板层小体肿胀减轻,数量增多,H组尤其明显,见图6。A正常组和B丙酮组可见密集的板层小体;模型组部分板层小体出现水肿;治疗后水肿的板层小体水肿减轻、减少。

图6 不同时间不同组小鼠皮损LB变化(HE×30 000)
3.7 免疫组化 42d时免疫组化,正常小鼠filaggrin免疫组化染色主要表达在颗粒层上方,模型组染色增宽,染色强度减弱,治疗组由于颗粒层变薄,染色宽度较模型组窄,染色强度增强;正常小鼠loricrin免疫组化染色局限在颗粒层上方,模型组loricrin数量增加,染色扩展为整个颗粒层,颜色的厚度增加,治疗组厚度染色主要在颗粒层,淡染色颜色较模型组变淡;正常小鼠耳K6不表达,模型组表达在整个基底层。治疗由于皮肤厚度变薄,表达较模型组窄2倍,染色减弱;K10染色在基底层和基底层上方,模型组K10染色都集中在颗粒和上尖尖的层,淡染色变淡,治疗组得到改善;正常小鼠耳K14表达在基底层和基底层上方,模型组表达在整个增宽的表皮层,治疗组表达在基底层,见图7。
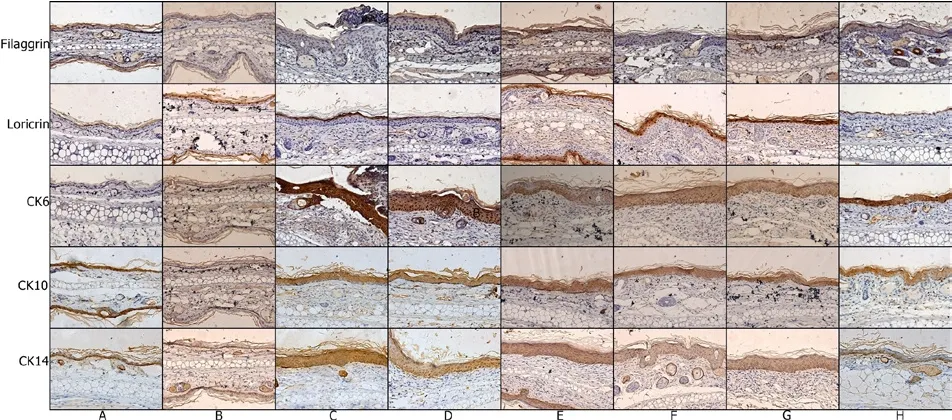
图7 42d时不同组小鼠皮损免疫组化情况
3.8 无创性皮肤生理功能 皮肤屏障功能遭到破坏后,表皮内的水分会经过角质层丢失,使皮肤变得干燥,从而加重某些皮肤病。不同时相组别鼠耳TEWL以及水分含量的比较见表6、表7。
表6 不同时相组别鼠耳TEWL的比较[,g/(cm²·h)]

表6 不同时相组别鼠耳TEWL的比较[,g/(cm²·h)]
注:42d时C组与A、B组比较,*P< 0.05;E、F、G、H组与 C、D组比较,#P <0.05;42d时 H组与 E、F、G组比较,##P<0.05。
组别 14d 21d 28d 35d 42d A 组 7.85±1.06 7.88±1.34 7.98±1.03 8.48±1.03 7.27±0.90*B 组 8.12±0.91 8.60±2.03 8.50±1.10 8.55±1.74 7.82±0.64*C 组 34.93±5.23 28.41±6.71 30.07±4.27 33.58±5.39 31.30±4.61#D 组 20.34±2.76 29.24±3.35 31.25±3.29 30.22±1.72#E 组 19.78±4.63 26.58±5.96 28.39±2.65 31.78±3.14 F 组 19.50±2.35 30.38±5.36 29.83±3.60 24.82±2.82 G 组 18.24±2.50 28.74±3.25 30.72±2.41 22.40±2.39 H 组 16.18±3.10 29.55±4.25 26.42±1.91 17.62±2.74##
表7 不同时相组别鼠耳水分含量的比较(,%)
表7 不同时相组别鼠耳水分含量的比较(,%)
注:42dD、E、F、J、H 组与 C 组比较,*P < 0.05。
组别 14d 21d 28d 35d 42d A 组 29.50±2.15 27.33±2.09 27.92±2.52 29.82±1.43 28.87±1.07 B 组 28.42±1.52 29.42±1.41 27.23±2.24 30.81±1.73 29.08±1.32 C 组 25.89±4.37 29.87±2.22 31.33±0.51 28.93±2.82 29.03±2.12*D 组 32.86±1.86 32.19±1.77 32.01±1.16 31.65±1.08 E 组 29.96±1.45 32.36±1.28 32.93±1.76 30.48±0.65 F 组 32.96±2.28 31.78±1.96 31.89±2.07 31.40±1.08 G 组 31.21±1.66 31.87±1.10 33.25±1.82 32.05±1.65 H 组 32.42±1.76 32.58±1.04 33.29±1.06 31.68±0.92
4 讨论
特应性皮炎是一种慢性、容易反复、以瘙痒为主要特征的炎症性皮肤病,其病因及发病机制不清,目前主要认为是遗传因素、免疫因素及皮肤屏障破坏等因素相互作用而致[14]。新的观点认为免疫调节失衡和皮肤结构异常是AD发病的主要机制,因此恢复皮肤屏障功能并调节免疫失衡是治疗AD的关键;研究结果显示,早期干预可以改善皮损的严重程度并缓解其他靶器官受损情况,比如哮喘等[15]。因此本课题主要探讨含有透明质酸、马齿苋及青刺果油的复合剂对BALB/c小鼠AD模型炎症反应的抑制作用和对皮肤屏障恢复作用[16]。
研究结果显示,AD是以Th2为主导的炎症浸润,伴血清总IgE升高[17]。Th2细胞分泌产生高水平的 IL-4、IL-5、IL-13,而 IFN-r则明显降低[18]。本实验研究显示经生物活性敷料治疗后,治疗组的鼠耳皮损可见淡红斑,未见结痂和血痂,耳廓厚度下降,组织病理改变提示,表皮变薄,炎性细胞浸润减少,真皮血管扩张减轻。血清IgE浓度明显较模型组降低,炎性细胞因子IL-4、IL-5、IL-13较模型组降低,而IL-12、IFN-r升高。表明含透明质酸、马齿苋、青刺果油的复合剂可有效抑制BALB/c鼠AD模型的炎症反应。
表皮最重要的功能是保护和防御功能,其中最关键的是角质层的渗透屏障功能,可阻止水分的蒸发。表皮最外层为角质层,在角质细胞的周围含有丰富的细胞外脂质,主要包括神经酰胺、胆固醇和游离脂肪酸(FFA)。这些表皮脂质及其前体是由角质形成细胞的板层小体(LB)分泌而来[19]。板层小体对于维持正常皮肤屏障功能起到重要作用[20]。研究结果表明,屏障功能受损皮肤中板层小体的数量及脂质合成明显减少,通过治疗恢复皮肤屏障功能后板层小体的结构、数量及分泌功能趋于正常[21]。本研究发现,AD模型组小鼠表皮角质形成细胞中的板层小体出现水肿且数量明显减少,而含透明质酸、马齿苋、青刺果油的复合剂治疗组板层小体水肿明显减少,数量明显增多[22-25]。前期研究结果曾显示,青刺果油具有促进透明质酸及神经酰胺合成和分泌的作用,可能与其改善板层小体结构及功能有关,从而使皮肤屏障功能恢复,TEWL降低。
TEWL是皮肤屏障功能主要的评价指标,通过测定皮肤表面的水蒸气压梯度表明水分散失的情况,反映了皮肤的水通透屏障。当屏障功能受损时,TEWL值增高,当屏障功能得到修复,TEWL值逐渐恢复正常[26]。越来越多的研究者通过测量TEWL来研究疾病的发病机制和药物研究开发,并证实TEWL测量能够评估犬或鼠皮肤屏障功能[25-28]。本研究中,与正常小鼠相比,AD模型小鼠TEML表明升高,而含透明质酸、马齿苋及青刺果油的复合剂治疗组小鼠TEWL则明显降低,提示其皮肤屏障功能恢复。
角质细胞膜中间丝相关蛋白(FLG)Loricrin和Involucrin的交叉链接,构成了表皮的渗透性屏障。中间丝相关蛋白(FLG)是表皮屏障的关键点,研究表明FLG突变是AD的发病机制之一,并与其严重性密切相关。AD患者皮损中FLG的表达及其免疫组化染色强度明显减弱。在本研究中使用含有透明质酸、马齿苋及青刺果油的复合剂治疗AD样小鼠后,取皮肤行免疫组化染色,结果显示,正常小鼠皮肤Filaggrin免疫组化染色主要表达在角质层,AD模型组中FLG阳性细胞层数增加但染色强度明显减弱,而含有透明质酸、马齿苋及青刺果油的复合剂治疗组中小鼠皮肤的FLG表达明显增强。LOR是角化套膜中的一个组件,其主要作用是增强角化套膜结构的主要强化蛋白质[22]。正常小鼠Loricrin位于颗粒层角质形成细胞中,而AD模型组中Loricrin阳性细胞数量及免疫组化染色强度明显增加,治疗组中Loricrin表达及染色强度与正常皮肤相似。正常情况下,表皮角质形成细胞不表达K6,K14表达于具有增殖活力的角质形成细胞中,而K10表达于基底层以上的细胞中。AD模型组中K6表达于基底层以上各层角质形成细胞,且染色强度明显增强,K10及K14阳性细胞层数增加且染色强度增强,这与之前报道的人异位性皮炎皮损免疫组化染色结果相一致。在含有透明质酸、马齿苋及青刺果油的复合剂治疗组中小鼠表皮K6、K10及K14的表达恢复正常,与正常小鼠相似。结果提示,该外用贴膜通过促进角质形成细胞的增殖与分化之间的平衡而调节表皮的新陈代谢。
综上所述,含透明质酸、马齿苋及青刺果油的复合剂通过抑制IgE产生,平衡炎性介质产生及角质形成细胞的增殖与分化,恢复板层小体的结构及功能,从而有效地抑制BALB/c小鼠AD模型的炎症反应并恢复其皮肤屏障功能,为临床治疗AD提供了一种新的方法。
