桐花树胎生发育过程中内源性脱落酸、赤霉素和糖分含量的变化
2021-11-19杨盛昌李文清
杨盛昌,卢 磊,诸 姮,李文清
(1.厦门大学环境与生态学院、滨海湿地生态系统教育部重点实验室,福建 厦门 361102;2.福建省滨海湿地保护与生态恢复工程技术研究中心,福建 厦门 361102)
桐花树(Aegicerascorniculatum)是紫金牛科,桐花树属(Aegiceras)的红树植物,在我国的广东、广西、福建均有大面积的分布。桐花树生长在海岸潮间带,水淹、高盐、缺氧和潮水周期性的冲刷等逆境导致了其形成泌盐、胎生等特殊的适应方式[1]。
所谓胎生,是指种子成熟后不经过休眠或只有短暂的休眠直接在母体上萌发的现象[1-2]。红树植物的胎生可分为两种方式,即显胎生和隐胎生。显胎生的种子在萌发时,胚轴突破果皮之外逐渐延伸长成一个柱状的幼苗,具显胎生现象的红树植物以红树科的红树属(Rhizophora)、秋茄属(Kandelia)和木榄属(Bruguiera)等为主;隐胎生的种子萌发时胚轴并不会突破果皮而一直为果皮所包被,以桐花树属和海榄雌属(Avicennia)红树植物为代表。有关胎生的形态描述很多,如Juncosa(1982、1984)曾研究了美国红树(Rhizophoramangle)和毛瓣木榄(Bruguieraexaristata)的胚胎发生和幼苗形态变化[3-4]。Farrant 等(1993)认为红树属和海榄雌属红树的胎生是跳过成熟干燥期的胚胎发育过程[5]。游学明等(2005)则研究胎生红树植物桐花树大小孢子发生及雌雄配子体发育过程,发现胎生桐花树的大小孢子发生及雌雄配子体发育过程与典型的非胎生陆生植物相似[6]。在红树植物胎生机制的研究方面,Sussex(1975)曾提出美国红树种胚在发育后期不会脱水,无法诱导内源性脱落酸(Abscisic Acid,ABA;化学式C15H20O4)的合成从而导致胎生,并且幼胚离体培养试验也表明幼胚不能吸收外源性ABA[7]。Farnsworth等(1998)则通过比较胎生和非胎生红树植物的内源性ABA含量,证实胎生红树植物成熟种子缺少休眠阶段与其内源性ABA含量低有关[8]。进一步的研究表明,胎生和非胎生红树植物的内源性ABA含量受盐渍环境影响,但在胎生过程中的变化趋势不会改变[9]。Ismial等(2010)认为在大红树(Rhizophoramucronata)的胎生发育过程中,ABA能调控脱水蛋白的特异性表达,其中50 kD的缩水蛋白与胎生的启动相关[10]。胎生过程体现了红树植物从外在形态发育到内在分子调控机制的适应,从分子机理与调控机制角度研究红树植物胎生过程揭示胎生现象的本质对理解红树植物胎生本质具有重要的意义[11]。
在植物生长发育过程中,内源性赤霉素(Gibberellin,GA;化学式C19H22O6)与ABA存在一定的拮抗作用,例如ABA能诱导种子休眠,抑制早萌发生,但GA却使种子休眠解除[12],植物可以通过控制两种激素的相对平衡调节萌发和休眠[13]。GA是广泛存在的一种植物激素,化学结构属于二萜类酸,由四环骨架衍生而得,至少有38种,分别被称为GA1、GA2、GA3……等,其中GA3含量较高,活性较强[14]。红树植物胎生与其内源性ABA含量低有关,那么内源性GA是否参与红树的胎生过程?王洁等(2008)曾采用高效液相色谱法测定了显胎生红树植物木榄(Bruguieragymnorhiza)繁殖体的内源性ABA和GA3含量,发现GA3在木榄的种子形成和萌发早期含量较高,而ABA含量较低,认为高水平GA3与木榄红树植物显胎生现象的发生有关[14]。本研究以隐胎生红树植物桐花树为材料,研究了其在不同胎生发育时期繁殖体的内源性ABA和GA3含量变化,同时测定了受两种生长调节激素直接调控的淀粉和可溶性糖含量的变化,希冀能进一步明确红树植物胎生过程中内源性ABA、GA3含量及其比例的变化规律,并从ABA和GA3的协同调控角度,丰富对红树植物胎生机制的认识。
1 材料与方法
1.1 样品的采集和保存
桐花树的花蕾、种子(未见胚轴萌动)、萌发早期繁殖体(幼胚轴长约为8 mm)、萌发晚期繁殖体(胚轴长约为4.5 cm,外表黄褐色,已成熟,即将脱离母体)采于福建省云霄县漳江口红树林国家级保护区(23°53′—23°56′N,117°24′—117°30′E),时间为2011年4—5月。在桐花树的不同物候期,采取相应材料5份,每份质量约为50 g,用冰盒带回实验室,置于-70 ℃冰箱中保存。
1.2 主要实验仪器
实验用主要仪器包括Agilent 1200 高效液相色谱仪(美国安捷伦科技有限公司)、SDS紫外检测器(美国安捷伦科技有限公司)、Hypersil ODS柱[4.6 mm i.d.(250 mm, 5 μm)](美国赛默飞世尔科技公司)、Thermo紫外分光光度计(美国赛默飞世尔科技公司)、SHZ-3循环水真空泵(上海沪西分析仪器厂有限公司)、RE 52-3旋转蒸发仪(上海沪西分析仪器厂有限公司)等。
1.3 试剂
ABA、GA3标样和聚乙烯聚吡咯烷酮(PVPP)均购自美国Sigma公司,色谱级甲醇购自国药集团,浓硫酸(质量分数为98.3%)、蒽酮以及其他试剂均为国药集团的分析纯级产品。
1.4 分析方法
样品的处理参考文献[14]并略加改进,增加了乙酸乙酯(体积分数为80%)萃取的次数以提高ABA和GA3的回收量。
色谱条件:Hypersil ODS 色谱柱[4.6 mm i.d.(250 mm,5 μm)],流动相为35%(体积分数)的甲醇(含 0.15% 0.1 mol/L H3PO4),其流速为1.0 mL/min, 检测波长分别为 245 nm和 208 nm,用于ABA和GA3含量的测定,进样量均为 20 μL,柱温为30 ℃。
可溶性糖和淀粉含量的测定分别参照李合生(2000)[15]和邹琦(2000)[16]的方法。
每一指标重复测定5次。采用单因素方差分析法(One-way ANOVA)对实验数据进行统计分析。
2 结果与讨论
2.1 ABA和GA3含量的高效液相色谱法测定
采用外标峰面积法测定ABA和GA3含量。用色谱峰面积分别对ABA和GA3含量作线性回归曲线,计算得到的ABA和GA3标准工作曲线方程分别为ABA:y=142 762x+3.260 4(R2=0.994 2,p<0.01);GA3:y=640 35x-60.188(R2=0.992 2,p<0.01)。
2.2 桐花树胎生过程中内源性GA3和ABA含量的变化
桐花树胎生过程中不同繁殖体内源性GA3和ABA含量的变化如图1所示。从花蕾期到种子萌发晚期,内源性GA3含量呈现出先升后降的变化趋势,即从花蕾期到种子期,GA3含量迅速提高,并在种子期达到最高值,为(12.60±0.05)μg/g;然后随种子萌发,GA3含量快速下降,并在种子萌发晚期达到最低值,为(1.97±0.05)μg/g。不同发育时期的ABA含量变化趋势则表现为先降低后升高的趋势,花蕾期ABA含量最高,为(1.86±0.07)μg/g,种子期迅速下降至最低值,为(0.75±0.07)μg/g,种子萌发之后,ABA含量逐渐上升。

图1 桐花树胎生过程中GA3和ABA 含量的变化
桐花树的繁殖体随着胚胎发育进程,GA3/ABA含量比值的变化趋势是先升高后降低(图2)。种子期GA3/ABA含量比值最高,达到47.01,约为花蕾期的18倍。种子萌发早期GA3/ABA含量的比值明显下降,但仍高于花蕾期和种子萌发晚期,花蕾期和种子萌发晚期GA3/ABA含量比值较小且差别不大。
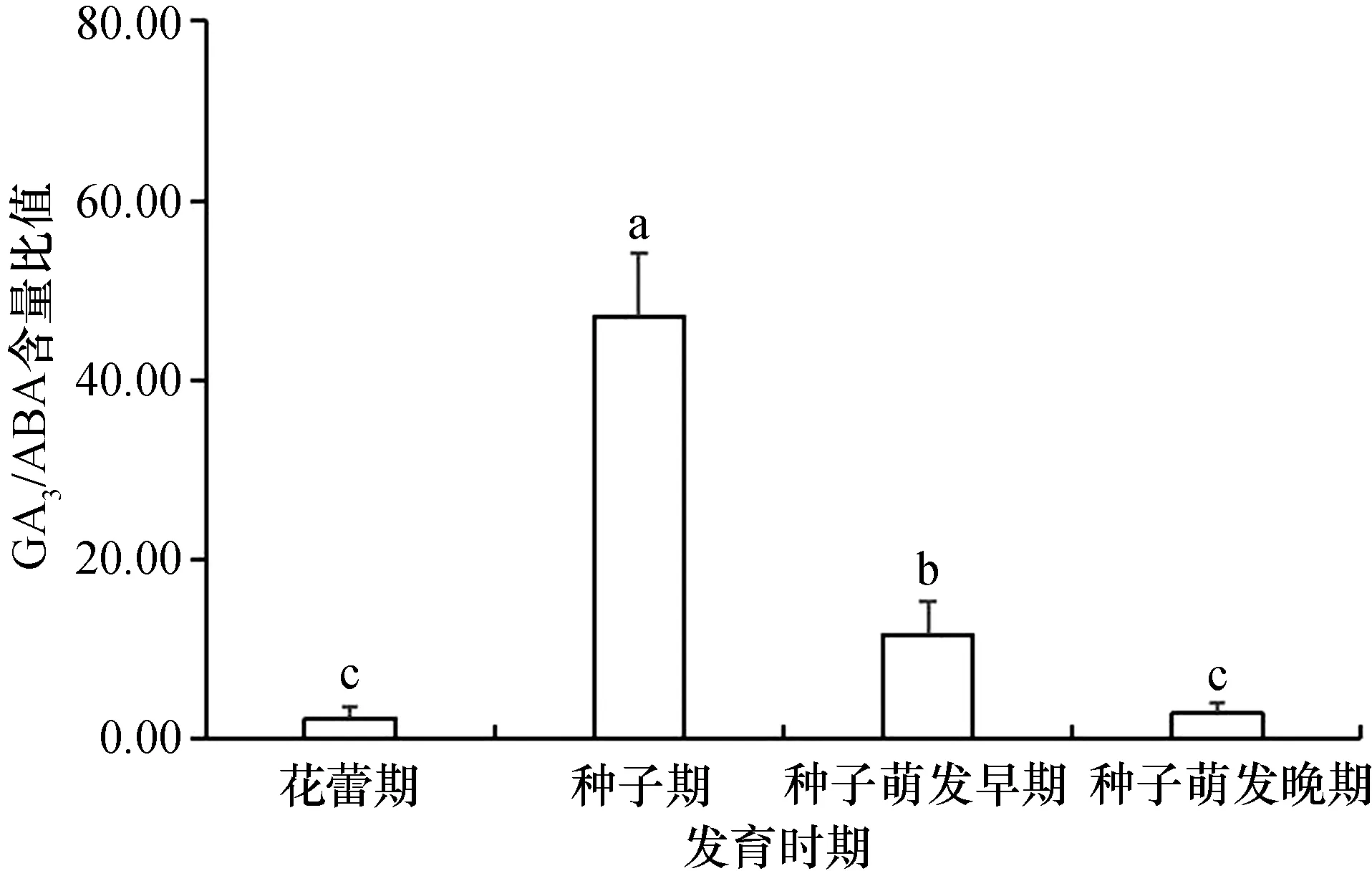
图2 桐花树胎生过程中GA3/ABA含量比值的变化
2.3 桐花树胎生过程中可溶性糖和淀粉含量变化
在不同发育时期,桐花树繁殖体的可溶性糖含量呈先升高后降低的变化趋势(图3)。花蕾期可溶性糖含量最低,为(9.39±2.15)mg/g,种子期提高到(18.10±1.14)mg/g,种子萌发早期可溶性糖含量达到最高值,为(31.20±0.97)mg/g,萌发晚期则下降到与种子期相当的水平。随着胎生发育进程,桐花树繁殖体的淀粉含量呈现逐渐升高的趋势,即花蕾期淀粉含量最低,种子萌发晚期淀粉含量最高,萌发晚期淀粉的含量约为花蕾期的3倍,种子期与萌发早期的淀粉含量相差不大。
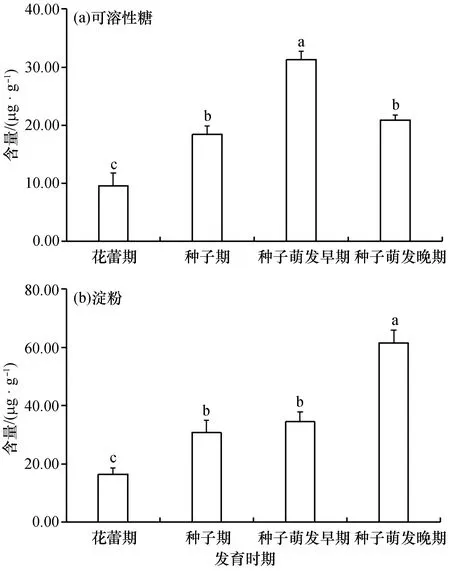
图3 桐花树胎生过程中可溶性糖和淀粉含量的变化
在不同发育时期,桐花树繁殖体的可溶性糖/淀粉含量比值出现波动,从花蕾期到萌发晚期比值呈现先升高后降低的现象(图4)。最高值出现在种子萌发早期,达0.90±0.12,种子萌发晚期降至最低值,为0.33±0.04,花蕾期与种子期的可溶性糖/淀粉含量比值相差不大。
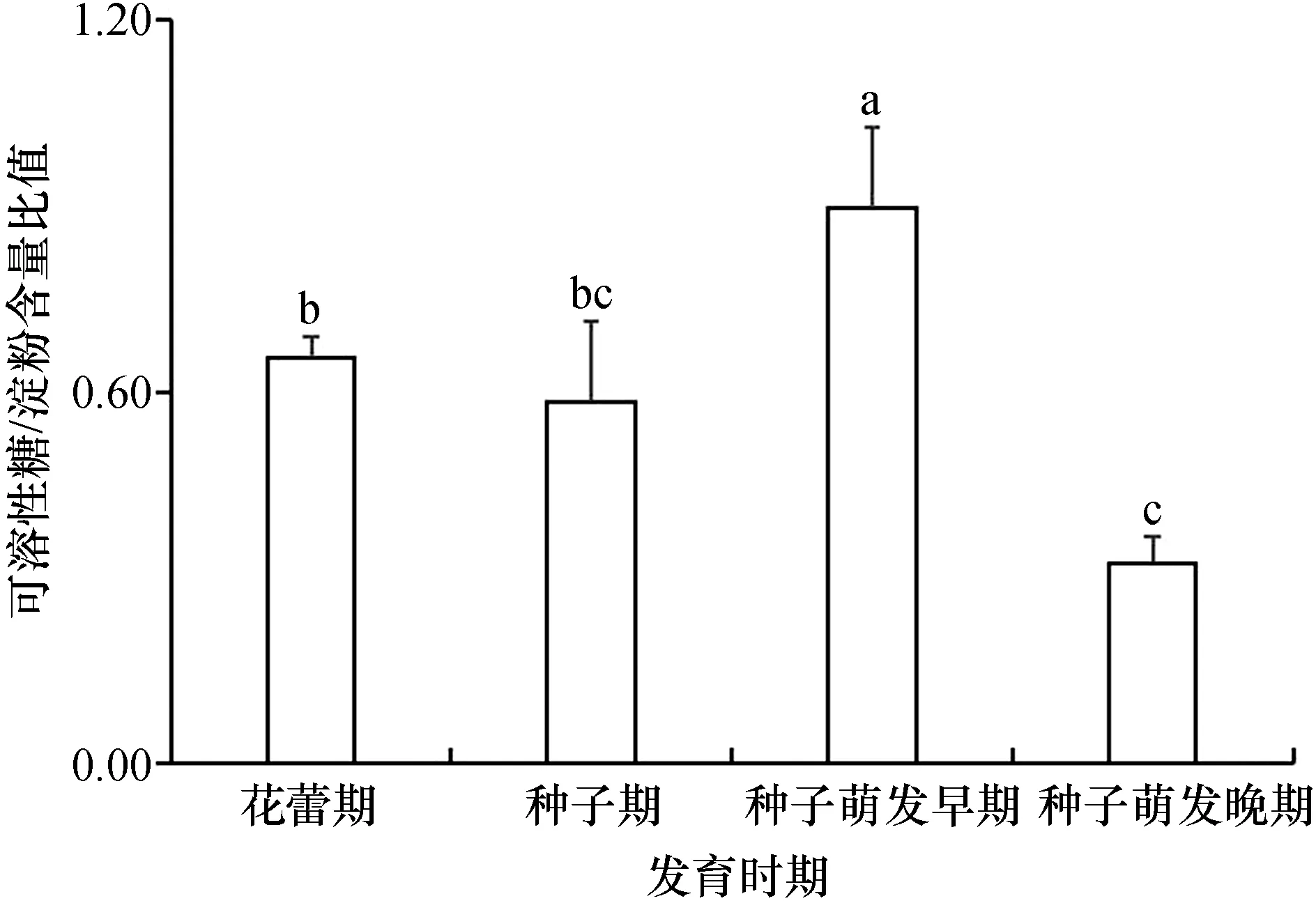
图4 桐花树胎生过程中可溶性糖/淀粉含量比值的变化
2.4 讨论
2.4.1 内源性激素与红树植物胎生的关系 有关红树植物胎生现象与内源性GA3关系的研究较少[14]。Farnsworth(2000)在其综述文章中指出红树内源性GA3可能参与了胎生过程,但未有相关数据的支持[2]。非胎生植物的种子内源性GA3含量通常很低[17-18],而本实验的结果却显示桐花树胎生种子有高含量的内源性GA3,其含量超过了种子形成期和种子萌发后的各个时期。王洁等(2008)对红树植物木榄繁殖体的研究也得到相似的结果[14]。繁殖体内源性GA3含量水平的大幅度变化表明内源性GA3对红树植物种子的胎生可能起到了显著的促进作用。
大量研究结果表明,ABA能够抑制离体种胚体外培养过程中的早萌发生,促进贮藏蛋白质的积累和胚的发育,是导致很多植物种子休眠的原因[16-17]。因此,种子胎生可能是因为种子中缺少ABA或者虽然ABA含量正常但种胚对ABA敏感性较低造成的[2,5-6]。已有研究表明,在高等植物中ABA合成可能是以类胡萝卜素为前体的间接途径,所以类胡萝卜素的生物合成途径中如有一步反应被抑制或从类胡萝卜素向ABA转化受到抑制,都会导致种子中ABA缺乏[2]。本实验研究表明:桐花树繁殖体在整个发育时期的内源性ABA含量都很低,并且波动较小,其中种子期的内源性ABA含量最低,花蕾期内源性ABA含量最高。这种现象在木榄[14]、正红树(Rhizophoraapiculata)和红海榄(Rhizophorastylosa)等红树植物[8]中都有报道。红树植物种子中低水平的内源性ABA难以诱导种子进入休眠状态,因此导致红树植物胎生现象的发生[2,8,14]。
桐花树种子期的GA3/ABA含量比值最大,为花蕾期和种子萌发晚期的18倍。种子萌发早期的GA3/ABA含量比值虽有明显下降,约为种子期的1/4,但仍维持比花蕾期和种子萌发晚期高的含量比值,其意义可能在于维持种子的持续萌发和促进生长。此外,与单一GA3或ABA的含量变化相比,GA3/ABA含量比值的变化幅度更为显著,因此,GA3/ABA的含量比值变化能更为明显地表征红树植物胎生的发生,同时,该含量比值也能反映内源性GA3和ABA对红树植物胎生过程的协同调控作用。
2.4.2 糖分含量与红树植物胎生的关系 植物中的可溶性糖主要包括果糖、葡萄糖等还原性糖和蔗糖。还原性糖是呼吸作用的直接底物,其含量大小可反映植物用于呼吸消耗的同化产物的水平;蔗糖则是植物体内有机物质运输和碳水化合物贮藏、积累的主要形式之一[19]。
通常情况下,植物种子休眠时可溶性糖水平较低,代谢水平低下[12],而本实验结果发现桐花树在种子期仍有较高水平的可溶性糖含量,说明桐花树在种子形成过程中细胞代谢活动旺盛,同时也表明桐花树植物种子缺少休眠期,换言之,桐花树植物种子形成后立即萌发,启动了胎生进程。
种子进入萌发晚期时,桐花树繁殖体的可溶性糖水平出现大幅度下降,这可能是由于可溶性糖转变成了贮存物质淀粉的缘故,从而使生长进入相对的停滞期。淀粉含量在桐花树胎生过程中的上升趋势也与上述判断吻合。种子萌发晚期桐花树繁殖体的淀粉含量达到最高,可以保障成熟胚轴掉落海滩后生长发育所需的物质储备和能量供给,也是红树植物胎生的适应机制之一。
桐花树可溶性糖/淀粉含量比值在种子萌发早期达到最大值,在种子萌发晚期降至最小。这可能是由于种子萌发早期细胞新陈代谢旺盛,淀粉水解为可溶性糖能供生长发育使用;在种子萌发晚期细胞新陈代谢减弱,大量可溶性糖合成淀粉,生长出现短暂停滞,导致了可溶性糖/淀粉含量比值变小。
2.4.3 胎生过程中内源性激素与糖分含量变化的关系 研究认为内源性GA3可能是启动α-淀粉酶合成的植物激素,它可以促进α-淀粉酶在糊粉层细胞中的表达[20]。ABA则起着抑制萌发、诱导休眠的作用,它对种子贮藏物代谢相关的淀粉酶等具有抑制作用[18]。Karine等(2002)研究发现大麦糊粉层中,ABA阻碍α-淀粉酶的积累,而GA则促进α-淀粉酶的表达[15]。
通过比较桐花树繁殖体在不同发育时期的GA3/ABA含量比值和可溶性糖/淀粉含量比值可以发现,花蕾期桐花树的GA3/ABA含量比值很小,可溶性糖/淀粉含量比值也较低;种子期桐花树繁殖体的GA3/ABA含量比值达最高水平,但可溶性糖/淀粉含量比值仍然较小,与花蕾期相差不大,这可能与内源性GA3和ABA协同调控可溶性糖和淀粉含量同步增加有关。种子萌发早期桐花树繁殖体的GA3/ABA含量比值较种子期开始下降,而同期的可溶性糖/淀粉含量比值却达到最大值,说明萌发早期的种子内部积累了更多的可溶性糖,高于同期淀粉含量的增加,这不仅可能与内源性GA3和ABA共同调控了α-淀粉酶基因的表达有关,也可能与可溶性糖被转运至萌发种子的量有所增加等有关。可溶性糖为种子早期的萌发生长提供了充足的能量和结构物质。种子萌发晚期时桐花树繁殖体GA3/ABA含量比值降至较低水平,可溶性糖/淀粉含量比值也相应降至低水平,推测这是由于萌发晚期的繁殖体已经成熟,内源性GA3含量下降,内源性ABA含量提高,可溶性糖向贮藏物质淀粉的转化增加所致。淀粉含量的增加不仅与胎生种子的形态建成有关,也有利于为胎生种子脱离母体后的生长做准备。
2.4.4 内源性激素协同调控桐花树胎生的可能机制 在植物生长发育过程中,内源性ABA和GA3会呈现明显的拮抗作用[12,21]。根据桐花树胎生发育过程中繁殖体的内源性ABA和GA3含量及其比值以及可溶性糖和淀粉含量及其比值的动态变化,我们推测:①桐花树胎生的启动与种子期高水平的GA3和低水平的ABA含量有关;②GA3和ABA通过拮抗作用协同调控了可溶性糖和淀粉含量及其比值的动态变化;③桐花树胎生进程中伴随着可溶性糖和淀粉含量的提高,前者促进了种子胎生早期的细胞代谢活性,后者保障了种子胎生进程中的形态建成,为胎生种子脱离母体后的生长提供了物质储备与能量供给。
红树植物的胎生是一种复杂而有趣的生物学现象,与红树植物适应生境及进化密切相关[1,22-23],但有关其分子机制的研究尚不充分,例如:为什么红树植物种子期具有高水平的GA3和低水平的ABA含量?内源性ABA和GA3的协调作用的靶位点有哪些?调控方式如何等?这些问题仍有待进一步研究。值得一提的是,生长素、乙烯、细胞分裂素等其他植物生长调节物质也可能参与了红树植物胎生发育过程的调控[1-2,8],其作用机制以及相互之间的协调关系也需要进一步阐明。
3 结论
(1)GA3/ABA含量比值变化能明显地表征桐花树植物胎生的发生,同时,该比值也能反映内源性GA3和ABA对桐花树植物胎生过程的协同调控作用。
(2)桐花树在种子期有较高水平的可溶性糖含量;进入萌发晚期时,繁殖体的可溶性糖水平出现大幅度下降,而淀粉含量达到最高,可能是由于可溶性糖转变成了贮存物质淀粉的结果。
(3)α-淀粉酶可以调控可溶性糖和淀粉之间的转化,可能是桐花树繁殖体内源性GA3和ABA综合调控的靶位点。
