黑米中矢车菊色素的提取工艺优化及测定
2021-11-18廖若宇刘新保张春娥孙悦谭梦瑶
廖若宇,刘新保,张春娥*,孙悦,谭梦瑶
(1.宁夏回族自治区粮油产品质量检测中心,银川 750001;2.宁夏大学 化学化工学院,银川 750001)
黑米,是黑稻加工而成的产品,外观呈长椭圆形,素有“黑珍珠”和“世界米中之王”的美誉[1]。与普通白米相比,黑米具有良好的营养价值和功能属性值,因其内部含有大量营养和生物活性成分,如必需氨基酸、功能性脂质、膳食纤维、维生素A和E、部分矿物质、花青素、酚类化合物、生育酚、植物甾醇和植酸等[2-5],故而引起越来越多的科研领域工作者的关注。
花青素,又称花色素,是一种水溶性天然色素,属酚类化合物中的类黄酮类物质[6],存在于植物细胞的液泡中。研究发现,现阶段已知的花青素共有23种[7],其不仅能够赋予植物鲜艳的色彩,而且能够预防动脉粥样硬化、降血糖、降血脂、抗疲劳、抗氧化及改善贫血等作用[8-10],在食品、药品及保健品等多领域均得到广泛应用。作为食品添加剂,可用于饮料、冰糕及果冻等产品的着色,而作为调味品,可用于调味料的着色和增香,如咖喱粉、芥末酱及火锅底料等。因受自身结构及合成途径的限制,花青素在光照、氧化剂、还原剂、防腐剂或铁离子存在的环境中极易分解,致使稳定性大大降低。目前,已有学者对石榴皮[11]、桑葚[12-13]、紫薯[14]及黑豆[15]等植物中花青素的提取纯化方式及功能活性成分进行研究,并且取得了不错的研究成果。
本文选用黑米为原材料,以矢车菊素-3-O-葡萄糖苷为监测指标,农业部标准NY/T 3164-2017《黑米花色苷的测定 高效液相色谱法》[16]为依据,对标准方法中的提取方法及测定条件进行优化,改进后的方法在保证提取率的同时,能够有效减少有毒有害试剂的用量及色素的提取成本,为今后黑米中花青素的提取提供了一种绿色高效的方法。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
LC-20AT 液相色谱仪 岛津国际贸易(上海)有限公司;XPE205 分析天平 梅特勒-托利多公司;SAH-B 水浴恒温振荡器 江苏省金坛市环宇科学仪器厂;XC-300C 超声波清洗机 济宁鑫欣超声电子设备有限公司;GL-20G-C高速冷冻离心机 上海安亭科学仪器厂;Lab Dancer 涡旋器 艾卡仪器设备有限公司;C300A 真空泵 德国Wgiiens公司;HMG-D24 氮吹仪 北京华安麦科生物技术有限公司;COMFORT纯水/超纯水机 德国赛多利斯公司。
1.1.2 材料与试剂
3种黑米产品:市购。
矢车菊素-3-葡萄糖苷标准品(Cy-3-glu):CAS号:7084-24-4,纯度≥95%;95%乙醇(分析纯):安徽安特食品股份有限公司;甲醇(色谱级):赛默飞世尔科技(中国)有限公司;盐酸(优级纯):永飞化学试剂有限公司;甲酸(色谱级):天津市光复精细化工研究所;Sep-Pak Vac 3cc NH2 Cartridges固相萃取柱(500 mg);5 mL一次性注射器:江苏长城医疗器械有限公司;0.45 μm水相滤膜;0.45 μm有机相滤膜。
盐酸溶液[c(HCl)=1 mol/L]:在200 mL容量瓶中加入适量去离子水,再缓慢加入浓盐酸16.67 mL,边加边振摇,待冷却至室温后,定容至200 mL,摇匀。
提取液:95%乙醇和盐酸溶液(1 mol/L)按照体积85+15混合,即取850 mL 95%乙醇和150 mL的盐酸溶液混匀后备用。
流动相A:0.5%的甲酸水溶液,取5 mL甲酸,用去离子水定容至1000 mL,使用前过0.45 μm的水相滤膜,并脱气。
流动相B:0.5%的甲酸甲醇溶液,取5 mL甲酸,用甲醇定容至1000 mL,使用前过0.45 μm的有机相滤膜,并脱气。
试验用水均为去离子水。
1.2 试验方法设计
1.2.1 标准品溶液的配制
1.2.1.1 标准储备液的配制
精确称量2.5 mg矢车菊素-3-葡萄糖苷标准品于25 mL棕色容量瓶中,提取液定容至刻度,即可得到浓度为100 μg/mL的标准储备液。
1.2.1.2 标准曲线点的配制
取1 mL矢车菊素-3-葡萄糖苷标准储备液于10 mL棕色容量瓶中,提取液定容至刻度,得到10 μg/mL的标准中间储备液。再分别从中间储备液中吸取适量溶液于1 mL的进样瓶中,再次用提取液定容,得到浓度分别为1,2,5,10,20,50,100 μg/mL的系列标准工作溶液。
1.2.2 色谱条件确定
色谱柱:Inertsil ODS-SP C18(250 mm×4.6 mm,5 μm),日本岛津公司;检测波长520 nm,柱温:30 ℃,流动相:0.5%的甲酸水溶液和0.5%的甲酸甲醇溶液(45∶55,V/V),流速:1.0 mL/min;进样体积10 μL,等浓度洗脱,分析时间设定为10 min,约6 min左右开始出峰。
1.2.3 样品前处理
准确称量0.50 g(精确至0.01 g)粉碎细度达80~100目且混合均匀的样品,置于50 mL离心管中,向其中加入15.00 mL矢车菊色素提取液,混匀后在80 W功率下超声5 min,随后在70 ℃恒温振荡器上中速振荡25 min,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至50 mL比色管中。再向离心管中加入15.00 mL提取液进行二次提取,涡旋20 s,重复上述操作,合并两次提取液,避光保存待测。
1.2.4 样品净化
先用6 mL甲醇活化净化柱,弃去滤液;再取1 mL待测液上样,弃去样液;随后以5 mL洗脱液(甲醇∶甲酸为1∶1,V/V)洗脱固相萃取柱,收集洗脱液于10 mL小试管中,在45 ℃下氮吹仪上浓缩至干,最后用1 mL提取液复溶,涡旋混合1 min,待样品充分溶解后,过0.22 μm尼龙针式过滤器,待上机分析。
1.2.5 单因素考察及综合因素优化
选取单因素比对法,对试验过程中的黑米粉粗细度、提取方式、提取次数、提取液种类、料液比、水浴振荡提取温度、水浴提取时间、净化柱8个因素分别考察,依据单因素优化出的结果选取料液比、振荡提取时间及水浴振荡提取温度3个因素,采用Box-Behnken设计后续优化试验,响应面因素水平见表1。以测得的黑米样品中的含量为响应值。同时通过Design-Expert 8.0.6分析软件得到二次回归方程和误差分析,确定各因素数值的最优组合并对其进行验证。

表1 响应面试验因素水平表Table 1 The factors and levels of response surface experiment
2 结果分析
2.1 单因素试验结果
2.1.1 黑米粉粗细度对矢车菊素含量的影响
分别对比20,40,60,80,100目及整米6种不同样品对矢车菊色素含量的影响(见图1),样品前处理方法参照1.2.3,测定方法见1.2.2。
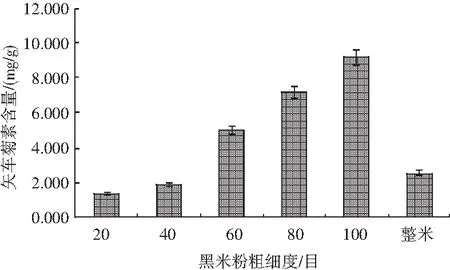
图1 黑米粉粗细度对矢车菊素含量的影响Fig.1 Effect of the particle size of black rice flour on the content of cyanidin
试验发现,样品粉碎后过不同目数的筛网时,随着黑米粉颗粒度越来越细,样品中的色素含量越来越高,并且混匀后的样品颜色与样品颗粒度呈现负相关,即颗粒度越细,混匀后的样品颜色越深。同时在过80目和100目筛网时,有许多肉眼可见的黑色“斑点”存在,从而影响了整个黑米粉的颜色。同样是粉碎细度为100目,直接粉碎后的样品并没有过筛后的颜色深,由此推断在筛不同目数的黑米样品时,小颗粒度的黑米种皮可能落到靠近底层的筛网中,因此黑米中的色素可能主要存在于种皮中。对黑米种皮、碾后黑米两种不同样品中的矢车菊色素含量进行测定,结果见图2。

图2 黑米中色素的分布Fig.2 The distribution of pigment in black rice
由图2可知,黑米中的矢车菊色素确实主要存在于黑米种皮中,而碾后黑米仅含有少量色素。同时通过分析试验数据可得黑米种皮中色素含量是碾后黑米的130倍以上。本着以节约资源为目的,同时考虑到实际操作的便利性,本设计选取直接过锤式旋风磨后细度达100目的样品进行后续试验。
2.1.2 提取方式对矢车菊素含量的影响
分别对比振荡30 min、涡旋15 min、超声30 min及超声加振荡共计30 min(超声5 min,振荡25 min)4种提取方式对色素含量的影响,见图3。

图3 提取方式对矢车菊素含量的影响Fig.3 Effect of extraction methods on the content of cyanidin
样品前处理方法参照1.2.3,测定方法见1.2.2。试验发现,振荡及超声两种提取方式对色素的提取影响基本相近,涡旋提取效果最差,超声加振荡两种方式混合提取后,样品中矢车菊色素含量较高,因此后续试验中均选取超声和振荡两种方式混合提取。
2.1.3 提取次数对矢车菊素含量的影响
对比不同提取次数对矢车菊色素含量的影响,见图4。样品前处理方法参照1.2.3,测定方法见1.2.2。
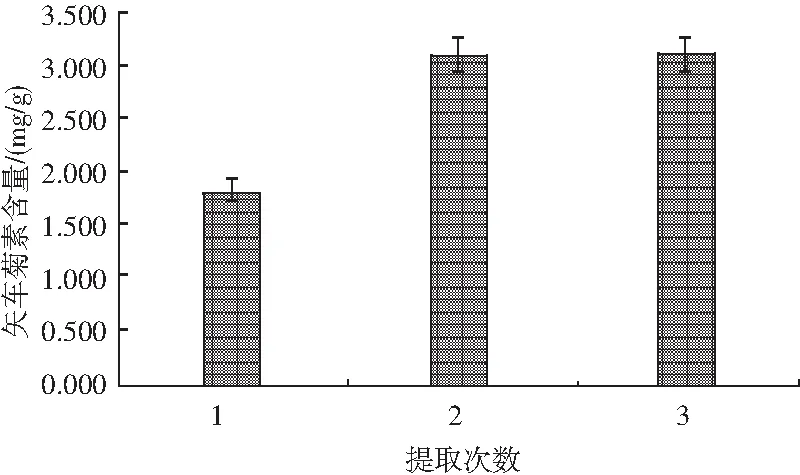
图4 提取次数对矢车菊素含量的影响Fig.4 Effect of extraction times on the content cyanidin
试验发现,当提取次数从1次增加至2次时,色素含量显著提升,但提取3次时色素含量与提取2次差别不大。由此说明在一定范围内增加提取次数能够使样品中色素被充分提取出来,但并不是提取次数越多越好。因此,本试验选取提取2次最佳。
2.1.4 不同提取试剂对矢车菊素含量的影响
通过查阅文献和资料,得知矢车菊色素易溶于甲醇、乙醇及丙酮,可溶于水。由此推断该色素易溶于有机试剂,遂随机选取95%乙醇、二氯甲烷、石油醚、丙酮、正己烷、盐酸与甲醇混合液、盐酸与95%乙醇混合溶液、盐酸与水混合溶液共计8种不同提取试剂提取黑米中的矢车菊色素,见图5。

图5 不同提取试剂对矢车菊素含量的影响Fig.5 Effect of different extraction reagents on the content of cyanidin
称取16份0.50 g样品,置于50 mL离心管中,分别向其中加入15.00 mL不同提取液,每种提取液设置两个平行,混匀后在80 W功率下超声5 min,随后在65 ℃恒温振荡器上中速振荡25 min,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至50 mL比色管中。重复上述操作2次,待上机测试分析。测定结果表明,依据农业标准NY/T 3164-2017《黑米花色苷的测定 高效液相色谱法》中盐酸与甲醇混合液以及盐酸与95%乙醇混合溶液提取效果较好,但考虑提取效果最佳、试剂毒性较小,首选盐酸与95%乙醇混合溶液作为后续试验的提取溶液。
2.1.5 不同料液比对矢车菊素含量的影响
选取盐酸与95%乙醇混合溶液为提取液,以农业标准中的盐酸与甲醇混合液作参考,分别对比不同料液比下黑米中矢车菊色素含量,见图6。

图6 不同料液比对矢车菊素含量的影响Fig.6 Effect of different solid-liquid ratios on the content of cyanidin
称取20份0.50 g样品,置于50 mL离心管中,分别向其中加入10,20,30,40,50 mL的提取液,每个水平设置两个平行,混匀后在80 W功率下超声5 min,随后在65 ℃恒温振荡器上中速振荡25 min,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至体积适量的比色管中。重复上述操作2次,待上机测试分析。结果显示,料液比为0.5∶40时,两种提取液提取色素的效果均优于其他,同时盐酸与95%乙醇混合溶液作为提取液时,效果明显优于标准中提取液的提取效果。因此,本试验选取盐酸与95%乙醇混合溶液作为提取试剂,提取试剂添加量为40 mL。
2.1.6 不同振荡温度对矢车菊素含量的影响
考察不同温度对矢车菊色素含量的影响,见图7。

图7 不同振荡温度对矢车菊素含量的影响Fig.7 Effect of different oscillation temperatures on the content of cyanidin
称取10份0.50 g样品,置于50 mL离心管中,加入20.00 mL提取液,混匀后在80 W功率下超声5 min,随后分别在35,45,55,65,75 ℃恒温振荡器上中速振荡25 min,每个水平两个平行,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至50 mL比色管中。重复上述操作2次,待上机测试分析。结果显示:在温度为65 ℃下,恒温振荡提取黑米中的矢车菊色素效果较好。因此,本试验选择提取温度为65 ℃进行后续试验。
2.1.7 不同提取(超声提取+恒温振荡提取)总时间对矢车菊素含量的影响
考察不同提取总时间对黑米中矢车菊色素含量的影响,见图8。

图8 不同提取总时间对矢车菊素含量的影响Fig.8 Effect of different extraction total time on the content of cyanidin
称取10份0.50 g样品,置于50 mL离心管中,加入20.00 mL提取液,混匀后在80 W功率下超声5 min,随后分别在65 ℃恒温振荡器上中速振荡5,10,15,20,25 min,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至50 mL比色管中。重复上述操作2次,待上机测试分析。结果显示:当超声提取时间固定为5 min,振荡提取时间为5~15 min内,黑米中提取的矢车菊色素含量差别不大,当提取时间增加至20 min时,提取效果略优于其他几个条件。因此,本试验选取总提取时间为25 min,即超声5 min,振荡20 min。
2.1.8 不同净化柱的选择对矢车菊素含量的影响
由于黑米样品中存在矢车菊素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷2种花色苷,本试验测定矢车菊色素时样品基线不稳,猜测可能是芍药色素对其产生了干扰,为避免长时间测定对后续样品产生干扰及污染色谱柱,尝试选择利用固相萃取柱净化样品。称取12份0.50 g样品,置于50 mL离心管中,向其中加入20.00 mL矢车菊色素提取液,混匀后在80 W功率下超声5 min,随后在65 ℃恒温振荡器上中速振荡20 min,静置冷却至室温,然后以4000 r/min离心5 min,转移上清液至50 mL比色管中。重复上述操作2次,按照1.2.4的方法净化样品,分别选取PWAX、Strata、C18、FL、NH2、3cc 6种净化柱净化同一样品,每种净化柱设置两个平行,试验结果见图9。
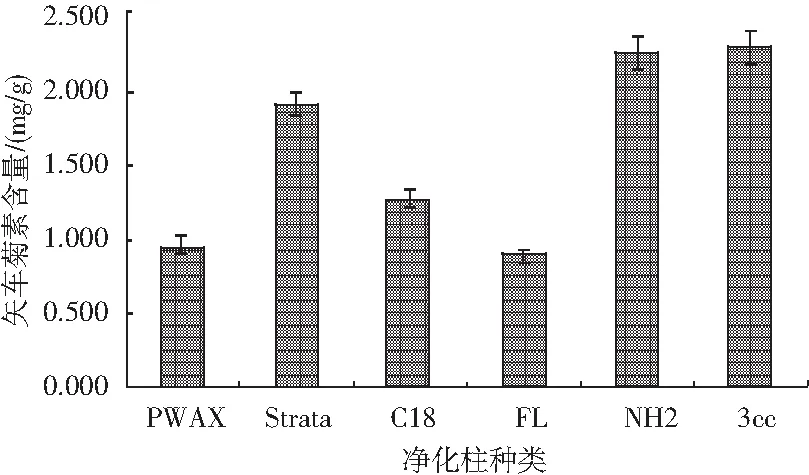
图9 不同净化柱的选择对矢车菊素含量的影响Fig.9 Effect of different purification columns on the content of cyanidin
结果表明,NH2和3cc两种小柱的净化效果明显好于其他种类的净化柱,并且所选择的6种净化柱中,3cc最优。因此,后续试验中选择最佳净化柱3cc。
选取3cc净化柱,活化小柱后,分别添加2%甲酸水及25%氨水甲醇,制造酸性及碱性环境条件,并在此条件下对样品进行净化以测定色素含量,试验结果见图10。

图10 不同酸碱条件下净化柱对黑米中矢车菊素净化效果比对Fig.10 Comparison of purification columns on purification effects of cyanidin in black rice under different acid and alkali conditions
试验发现,在酸性环境中,样品随着上样后样液流出而流失,无法留存于净化柱上,造成样品中色素含量降低。碱性环境与酸性环境类似,但流失量较酸性环境少一些,推测可能是由于色素提取过程中的部分酸与活化净化柱后添加的碱液反应,从而造成色素流失。因此,本试验选取中性条件,即活化固相萃取小柱后直接上样的方式净化样品。
2.2 响应面试验
2.2.1 建立二次回归方程及误差分析
对表2中的数据进行回归拟合得到二次回归方程为:矢车菊素含量=3.60238+0.033800A-0.11970B+9.50000E-3C+4.45000E-4AB-6.85000E-4AC+1.59000E-3BC。

表2 响应面试验设计与结果Table 2 The design and results of response surface test
通过ANOVA进行回归方程误差分析,结果见表3。
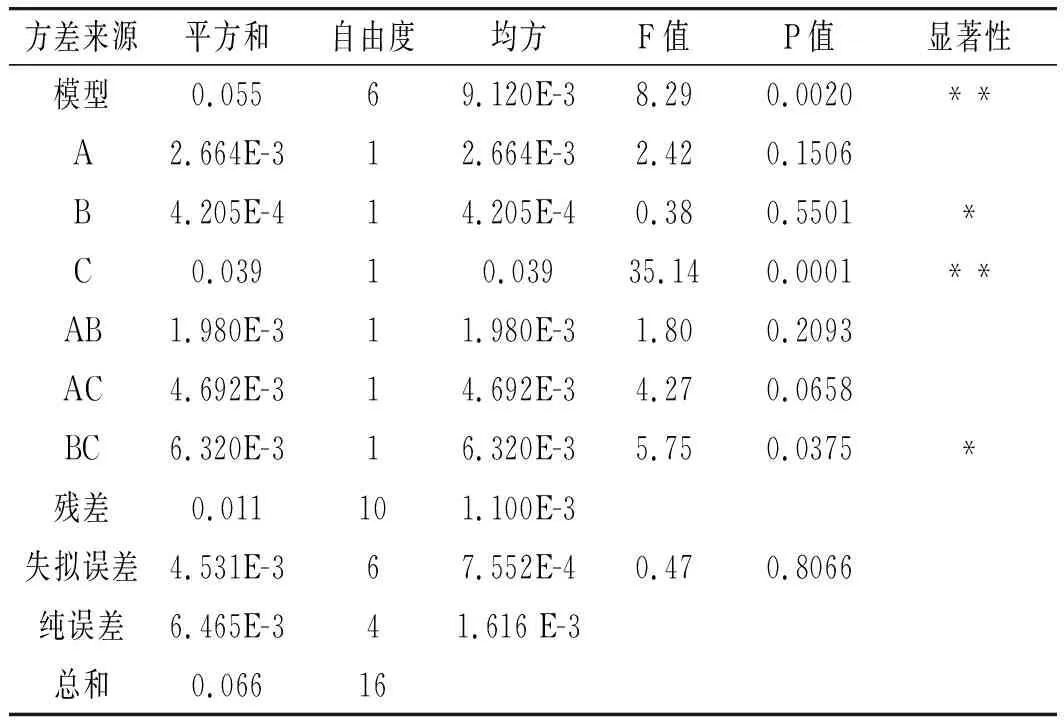
表3 响应面试验方差分析结果Table 3 The variance analysis results of response surface test
由表3可知,该模型回归显著,失拟项不显著,模型CV=0.87%,R2=0.8327,RAdj2=0.7323,其中CV值与模型置信度呈现负相关,而相关系数R2和RAdj2越接近1,模型相关性则越好。本试验中数据表明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,可以用于黑米中矢车菊色素的提取与含量预测。另外,所考察的3个因素中,C对黑米中矢车菊色素提取的影响高度显著;B、BC的影响显著;A、AB、AC的影响不显著,各因素影响从大到小依次为振荡提取时间>料液比>加热温度。
2.2.2 优化组合验证试验
为确定最佳提取方式,使用快速上升法进行优化,得到提取黑米中矢车菊色素的最佳方案为:料液比0.5∶30,振荡提取时间25.00 min,振荡提取加热温度70.00 ℃,预估黑米中矢车菊色素含量为3.967 mg/g。对上述条件进行试验结果的验证,结果见表4。

表4 最优组验证试验Table 4 The validation test of optimal group
由表4可知,最优组矢车菊色素提取含量为3.972 mg/g,达到了理论预测值,同时两者相对误差约为0.005 mg/g,表明响应面软件优化后得出的回归方程有一定的实践指导意义。
2.3 标准曲线的测定

图11 矢车菊色素标准品谱图Fig.11 The spectrum of cyanidin pigment standard sample
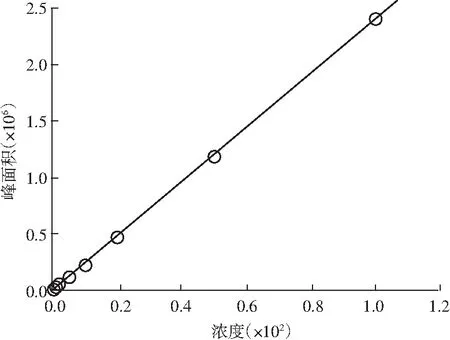
图12 矢车菊色素标准曲线图Fig.12 The standard curve of cyanidin pigment
以1.2.1.2的方法配置各个标准曲线点,以1.2.2 色谱条件上机测定。矢车菊色素标品谱图见图11。以浓度为横坐标,对应的色谱峰面积为纵坐标,绘制标准曲线,建立线性回归方程,见图12。当矢车菊色素在1~100 μg/mL范围内时,浓度与峰面积呈现良好的线性关系,回归方程为f(x)=24040.5x-10797.8,R=0.9999。最低检出限为0.5 μg/mL,定量限为2 μg/mL。
2.4 样品含量测定
随机购买市面上3种不同品牌的黑米样品,对其矢车菊色素含量进行测定,测定结果见表5。
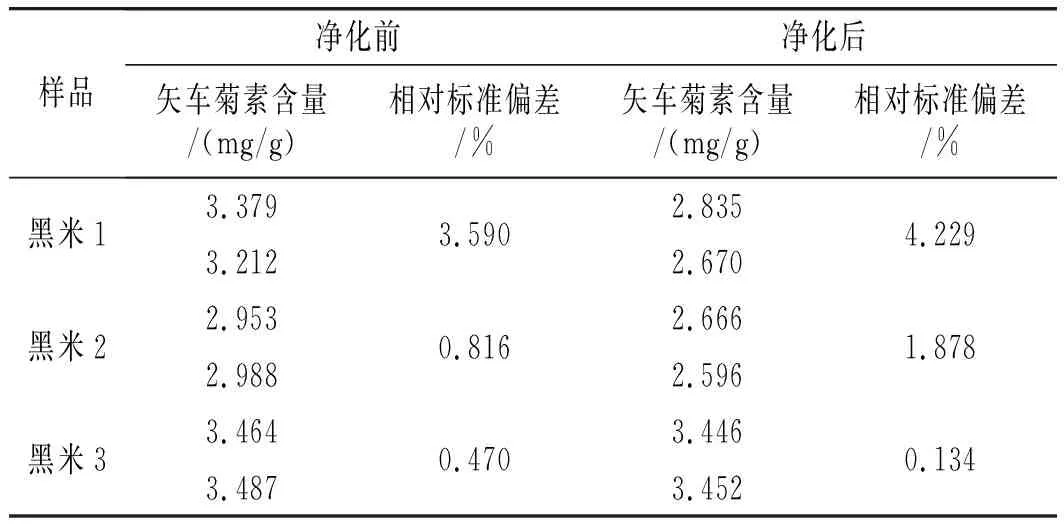
表5 样品中矢车菊色素含量Table 5 The content of cyanidin pigment in samples
由表5可知,3种不同黑米样品,未净化时内部矢车菊色素含量在2.953~3.487 mg/g之间,相对标准偏差为0.470%~3.590%,而经过净化的样品,其矢车菊色素含量在2.596~3.452 mg/g之间,相对标准偏差为0.134%~4.229%,证明经过净化后的样品,矢车菊素含量损失在0.5 mg/g范围内,可根据实际需求,选择是否需要净化样品。
3 结论
本文在传统液相色谱法测定的基础上,结合使用固相萃取小柱净化样品。经验证,相比于农业部标准NY/T 3164-2017《黑米花色苷的测定 高效液相色谱法》,本方法更加绿色环保,在保证提取率的同时,有效减少了有机试剂的污染及提取成本,为黑米中矢车菊色素的提取提供了一种可靠方法。本试验研究得出当料液比为0.5∶15,超声提取时间为5.00 min,振荡提取时间为25.00 min,振荡提取加热温度为70.00 ℃,重复2次提取时,能够有效提取黑米中的矢车菊色素,测得其含量为3.972 mg/g,相对标准偏差为1.54%。同时,利用Sep-Pak Vac 3cc NH2 Cartridges固相萃取柱净化后的样品杂质干扰小、分离度好,能够更加准确地定量出黑米样品中的矢车菊色素含量。综上所述,本文为黑米中天然色素的提取、净化及测定提供了一种新的、快速、可靠的方法。
