不同光照处理甘蓝型油菜幼苗花青素合成的转录组和代谢组分析
2021-11-18滕守连祁丽娟郭童童张生萍妥小云罗玉秀
滕守连,李 番,祁丽娟,郭童童,张生萍,妥小云,罗玉秀
(青海大学a生态环境工程学院,b农林科学院,青海 西宁 810016)
油菜是世界上重要的油料作物之一[1],种类繁多,其中低芥酸油菜的菜用价值近年来备受关注[2],而光照是影响油菜生长、发育和产量的主要环境因素之一[3]。在光照诱导下,油菜内的花青素会在植物器官(组织)内逐渐积累[4],使其颜色发生变化,这是许多植物的共同特征[5-6]。油菜幼苗在强光下会变紫,是由于其花青素物质含量相应提高,因此可作为膳食花青素的潜在来源[2]。
花青素是三大天然色素之一[7-8],也是一种抗氧化剂,具有抵抗癌症和预防心血管疾病的功效[2],主要以花青素苷的形式存在。目前发现的天然花青素苷主要有6种:天竺葵素、矢车菊素、翠雀素、芍药花色素、牵牛花色素和锦葵色素[9-10],其中翠雀素、牵牛花色素和锦葵色素的花色苷衍生物是紫色和深色的来源,而矢车菊素、芍药花色素和天竺葵素衍生物是鲜红色水果中的主要色素[11-12]。目前,对模式植物拟南芥的花青素合成、代谢与调控基因已经较为清楚[13],已克隆的花青素合成基因有黄酮羟化酶(flavonoid 3′-hydroxylase,F3′H)、查尔酮合酶(chalcone synthase,CHS)、查尔酮异构酶(chalcone isomerase,CHI)、黄烷酮羟化酶(flavanone-3-hvdroxylase,F3H)、二氢黄酮还原酶(dihydroflavonol reductase,DFR)、黄酮葡糖基转移酶(flavonoid 3-o-glucosyl-transferase,UF3GT)、花青素合成酶(anlthocyanidin synthase,ANS)基因和转录因子(MYB、bHLH和WD40)[14-18];在小麦、玉米、矮牵牛等高等植物中也克隆了多个与花青素合成相关的基因[19-20]。花青素合成相关基因受环境影响,其中光照是诱导花青素合成的环境因素之一,从拟南芥中已分离出早期光诱导蛋白1(ELIP1)和2(ELIP2)。目前,有关光照诱导植物花朵和果实颜色变化及花青素积累方面的研究较多[21],对植物生殖器官色素的形成机理[22-26]研究较透彻,而有关营养器官花青素合成和积累机理的研究尚未见报道。本研究通过对油菜幼苗转录组和代谢组的分析,筛选出强光和弱光下油菜幼苗中的差异表达基因和差异代谢物,并对花青素合成途径的相关基因进行验证,鉴定出光照诱导油菜幼苗花青素合成的关键基因,以期为光照诱导植物营养器官花青素合成机理研究奠定基础。
1 材料与方法
1.1 材 料
以甘蓝型油菜自交系GLH4为研究材料。RNA提取试剂盒(TaKaRa MiniBEST Universal RNA Extraction Kit)、反转录试剂盒(PrimeScriptTMRT Kit with gDNA Eraser)和荧光定量试剂盒(TB GreenTMPremix Ex TaqTM1)以及试验所用Marker、酶、琼脂糖等试剂,均由TaKaRa(大连)公司提供。引物用Primer5自行设计并由上海生工合成。
1.2 试验设计
选取籽粒饱满的油菜种子种植于花盆中,在人工气候箱中培养,温度设置为10/0 ℃(昼/夜),光周期为16 h光照/8 h黑暗,光照强度300 μmol/(m2·s),相对湿度90%,培养至2叶1心期进行光照诱导试验。设置2个光照处理,分别为300 μmol/(m2·s)弱光处理和700 μmol/(m2·s)强光处理,温度21/17 ℃(昼/夜),相对湿度90%。观察不同光照处理下0,24,48,72和96 h油菜幼苗的表型变化,并分别取处理96 h油菜的第1片真叶,用于转录组分析和代谢组分析;另取强光处理0,4,8,16和96 h的油菜第1片真叶和茎用于荧光定量(RT-qPCR)分析。样品重复3次,每重复取6个单株混样。取样后用干冰存放送测。
1.3 RNA提取及cDNA合成
按照RNA提取试剂盒说明提取不同光照处理96 h油菜幼苗第1片真叶的总RNA,用1.2%琼脂糖检测RNA的完整性及是否存在DNA污染,用NanoPhotometer 分光光度计检测 RNA 浓度(OD260/280和OD260/230)。
按First-Strand cDNA Synthesis Kit试剂盒(TaKaRa)说明将总RNA合成cDNA第一链,用反转录试剂盒进行反转录操作。将1 μL总RNA,2 μL Oligo(dT)18和24 μL RNA free ddH2O混匀,65 ℃水浴5 min,冰浴30 s,12 000 r/min瞬时离心,然后依次加入8 μL 5×R Buffer,2 μL RNA抑制剂,4 μL dNTPs和2 μL M-MVLV,瞬时离心后在PCR仪上于42 ℃孵育60 min,70 ℃灭活10 min。合成的cDNA置-20 ℃冰箱备用。
1.4 转录组测序及分析
cDNA文库构建完成后,使用Agilent 2100对文库的插入片段进行检测,用Illumina HiSeq2000高通量测序平台(武汉迈威代谢生物公司)对cDNA文库进行测序,再将下机数据进行过滤得到高质量的Clean Data,与指定参考基因组进行序列比对,得到Mapped Data,用于可变剪接、新基因挖掘和基因结构优化等分析;根据不同处理基因表达量进行差异表达、差异基因功能注释等分析。采用 FPKM (fragments per kilobase of transcript per million fragments)计算方法估算每个转录本的表达量,若组间表达量差异>2,即差异表达倍数对数的绝对值>1,且P<0.05则视为差异表达基因,并对筛选到的差异基因进行KEGG分析[27]。
1.5 代谢组分析
用处理96 h的油菜第1片真叶为样品,经真空冷冻干燥,用研磨仪(MM 400,Retsch)研磨(30 Hz,15 min)至粉末。取100 mg粉末溶于1.0 mL提取液中,4 ℃冰箱过夜后,10 000g离心10 min,取上清,0.22 μm pore size滤膜过滤,存入进样瓶,用于超高效液相色谱和串联质谱(UPLC-MS/MS)分析[28-29]。液相色谱分析条件为,(1)色谱柱:Waters ACQUITY UPLC HSS T3 C18 1.8 μm,2.1 mm×100 mm;(2)流动相:乙腈-水溶液(体积比5∶9);(3)洗脱梯度:0~11.0 min水/乙腈体积比95∶5,11.0~12.0 min水/乙腈体积比5∶95),12.1~15.0 min水/乙腈体积比95∶5;(4)流速0.4 mL/min,柱温40 ℃,进样量2 μL。质谱条件为:电喷雾离子源(electrospray ionization,ESI)温度500 ℃,质谱电压5 500 V,帘气(curtain gas,CUR)25 psi,碰撞诱导电离 (collision-activated dissociation,CAD)参数设置为高。在三重四级杆(QQQ)中,每个离子对根据优化的去簇电压(declustering potential,DP) 和碰撞能 (collision energy,CE)进行扫描检测。利用软件Analyst 1.6.3处理数据。对原始数据进行过滤、去冗余;参考已有的质谱公共数据库(KNAPSAcK、DB和METLIN等)和基于本地自建代谢物数据库对代谢物进行定性定量分析;利用主成分分析(PCA)和正交偏最小二乘法判别分析((O)PLS-DA)的VIP值和P值来筛选差异代谢物。代谢组分析由武汉迈威代谢生物公司完成。
1.6 荧光定量PCR验证
对涉及转录因子、向光性应激蛋白基因功能的8个花青素合成相关的差异表达基因进行RT-qPCR验证,8个差异表达基因分别是2个转录因子MYB114和bHLH28,2个光诱导因子ELIP1和ELIP2,4个结构基因F3′H、CHS、DFR和黄酮醇合成酶基因(flavonol synthase,FLS)。取强光处理0,4,8,16和96 h的油菜第1片真叶和茎,按照反转录试剂盒说明书将RNA进行反转录。采用 Primer 5设计基因特异性引物,以β-ACT为内参基因。RT-qPCR使用LightCycler®96仪器完成。反应体系:上游引物(20 μmol/L) 4 μL,下游引物(20 μmol/L)4 μL,模板cDNA 2 μL,ddH2O 8 μL;反应程序为:95 ℃预变性 60 s;95 ℃ 30 s,60 ℃ 45 s,72 ℃ 30 s,30个循环。每个基因都进行3次生物学重复和3次技术重复,-2ΔΔCt法计算相对表达量。
2 结果与分析
2.1 不同光照处理甘蓝型油菜幼苗的表型观察
图1显示,油菜幼苗在弱光300 μmol/(m2·s)下培养时,幼苗为绿色;但在强光700 μmol/(m2·s)下培养时,幼苗的子叶、真叶、叶柄和茎颜色随培养时间延长逐渐变紫,且叶片背面变色较正面明显,叶柄和叶脉颜色尤深,说明强光诱导了油菜幼苗中的花青素积累。

图1 不同光照处理甘蓝型油菜幼苗的表型观察Fig.1 Phenotypic observation of Brassica napus seedlings under different light treatments
2.2 不同光照处理油菜幼苗的转录组分析
对经弱光和强光处理96 h的油菜幼苗进行差异基因表达分析,共找到了9 840个表达差异显著的基因(DEGs),其中上调基因5 573个、下调基因4 267个。说明强光诱导一些基因表达的同时,也抑制了部分基因的表达,从而对强光作出应答。
对差异基因进行KEGG功能注释,结果显示,9 840个DEGs被注释到了139个KEGG通路中。其中参与光诱导的差异基因显著富集到20条通路中(图2);注释到代谢途径的差异基因最多,为1 751个;其次为次生代谢物差异基因,为986个;此外,还有植物激素信号转导基因349个,碳代谢基因208个,昼夜节律基因113个。

点越大,表示通路富集的差异基因数量越多;点颜色越红,代表富集越显著Larger point indicates more number of differential genes enriched by pathways;Color shows significance with most significant in red
通过KEGG富集分析发现,油菜幼苗在强光和弱光处理下,花青素生物合成途径有48条差异表达基因。通过序列比对,这48条基因分别归属于10个花青素合成结构基因,分别为3个F3′H、4个CHS、5个CHI、2个F3H、8个DFR、3个ANS、1个UF3GT、6个糖基转移酶(glycosyltransferase,GTs)、5个黄酮醇合成酶(flavonol synthase,FLS)和11个苯丙氨酸酶(phenylalanine ammpnialyase,PAL)基因(表1)。说明在强光诱导下,油菜通过对这些结构基因表达量的调控来控制花青素合成,从而使油菜颜色发生变化。从花青素合成差异基因及关键基因中筛选获得了表达量高度上调的编号为LOC106431192的基因,该转录本的FPKM值之比达49.10,说明片段数目能真实反映转录本表达水平。

表1 不同光照处理油菜幼苗中花青素合成途径关键酶基因的KEGG分析Table 1 KEGG analysis of key enzyme genes of pigmentoglycin biosynthesis pathways Brassica napus seedlings under different light treatments
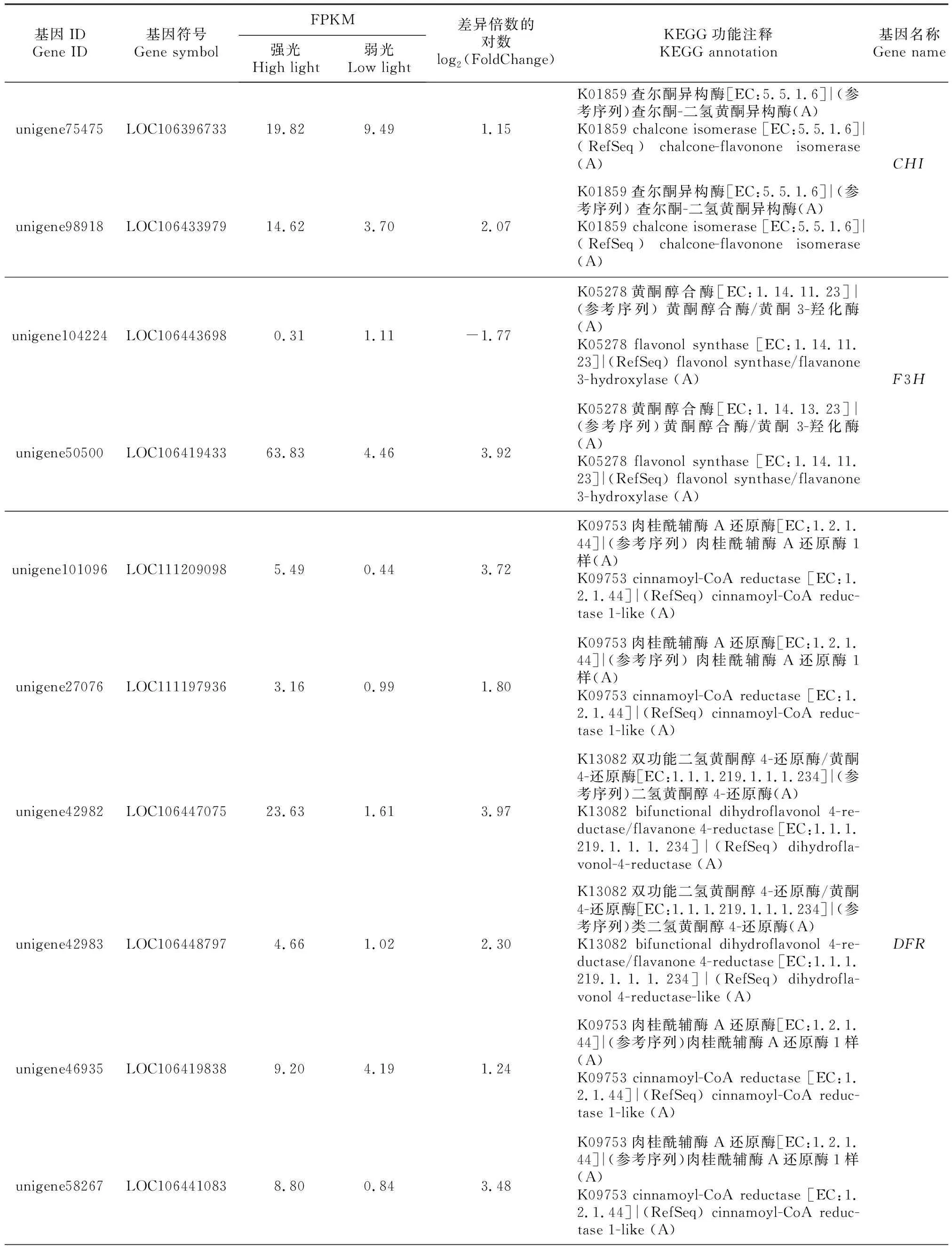
表1(续) Continued table 1

表1(续) Continued table 1

表1(续) Continued table 1

表1(续) Continued table 1
在强光处理油菜幼苗转录组中,多个转录因子表达水平发生了变化(表2),其中参与花青素合成途径的调节基因有MYB、bHLH、WD40[29]。根据基因注释信息,通过Blast数据库比对,本试验中预测和鉴定到228个调节基因,包括编码MYB的基因102个,编码bHLH的85个,编码WD40的41个,多数情况下1个以上的基因编码同一种转录因子,这些基因或许代表不同的基因片段或者来自同一个基因家族,证明花青素相关基因在甘蓝型油菜中存在多个拷贝,花青素合成相关基因受光照诱导调节。

表2 不同光照处理甘蓝型油菜幼苗的差异转录因子Table 2 Differential transcription factors of Brassica napus seedlings under different light treatments
2.3 不同光照处理油菜幼苗的代谢组分析
对经弱光和强光培养96 h的油菜幼苗进行代谢谱差异比较分析,结果(图3)表明,共检测到248个差异代谢物(DMs),其中182代谢物表现为上调,66个代谢物表现为下调。代谢物主要包括黄酮类、糖类、氨基酸及衍生物、脂质和苯丙素。其中黄酮类占比最大(32.66%),其次为氨基酸及其衍生物(14.51%),脂质和苯丙素分别占5.24%和10.08%。
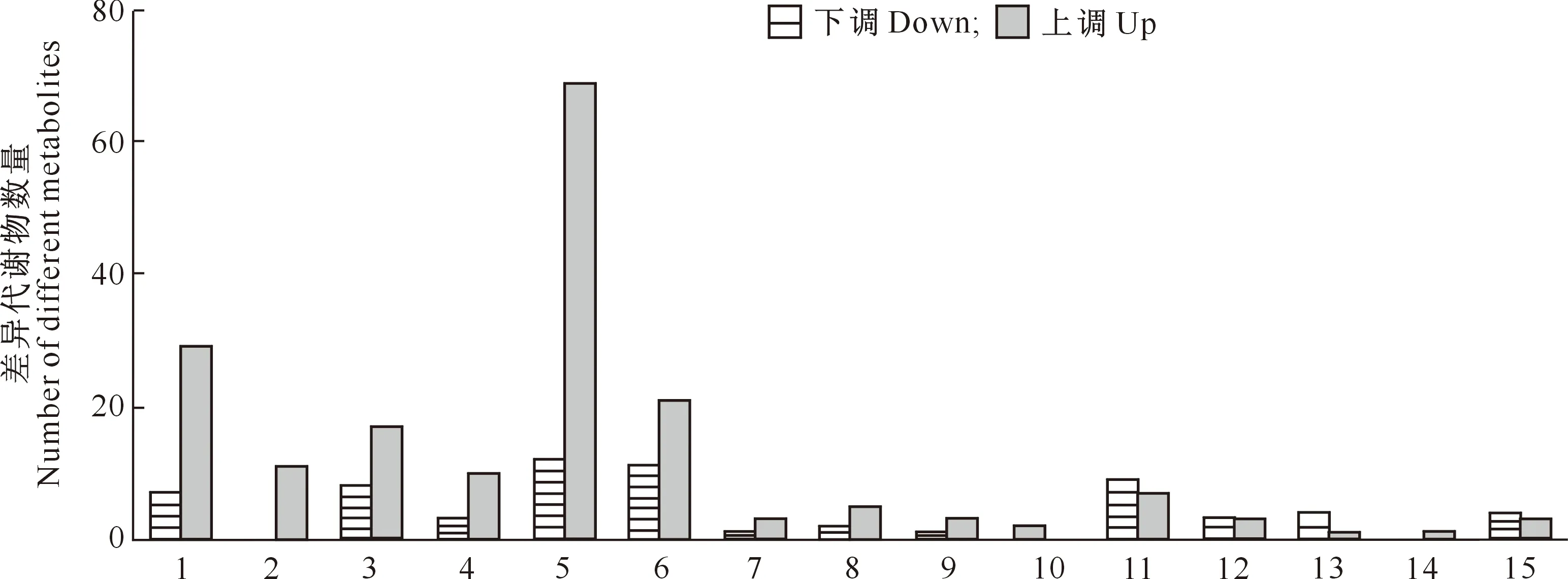
1.氨基酸及衍生物;2.糖类;3.苯丙素;4.脂质;5.黄酮类;6.有机酸及衍生物;7.维生素及衍生物;8.酚胺;9.醇类;10.吲哚及衍生物;11.核苷酸及衍生物;12.生物碱;13.多酚;14.萜类;15.其他1.Amino acid and derivatives;2.Carbohydrates;3.Phenylpropanoids;4.Lipids;5.Flavonoid;6.Organic acids and derivatives;7.Vitamins and derivatives;8.Phenolamides;9.Alcohols;10.Indole derivatives;11.Nucleotide and derivates;12.Alkaloids;13.Polyphenol;14.Terpene;15.Others图3 不同光照处理油菜幼苗差异代谢物数量的分布Fig.3 Quantity analysis of different metabolites in Brassica nupus seedlings under different light treatments
对黄酮类物质的功能注释结果显示,类黄酮代谢途径的81个差异代谢物中包含34个黄酮、21个黄酮醇、9个黄烷酮、 7个花青素苷、7个类黄酮苷、2个原花青和1个异黄酮。7个花青素苷分别为松香花青素 O-己糖苷、花翠素 3-O-葡萄糖苷、矢车菊素、花翠素、芍药色素双葡萄糖苷、牵牛花色素 3-O-葡萄糖和天竺葵素-3-O-葡萄糖苷。其中矢车菊素、花翠素、花翠素 3-O-葡萄糖苷和牵牛花色素 3-O-葡萄糖代谢差异达到极显著水平,说明光诱导油菜幼苗颜色的变化是以上4种花青素苷的积累所致。
2.4 不同光照处理油菜幼苗差异基因和差异代谢物的关联分析
对不同光照处理油菜幼苗的差异基因和差异代谢物进行关联分析,共找到多条共同富集代谢通路,但只有黄酮类代谢途径的差异基因和差异代谢物均达到极显著水平。注释到类黄酮合成途径的81个代谢物与48个差异表达基因显著相关。说明油菜颜色的改变是由于光诱导调控了类黄酮合成途径的多个基因表达发生变化,从而改变了类黄酮化合物的含量所致。花翠素、矢车菊素及其衍生物含量的改变是导致油菜幼苗颜色变化的主要色素。
2.5 强光处理油菜幼苗差异基因的验证
采用RT-qPCR方法,对强光处理油菜幼苗测序中表达数量高且在各条通路中均显著富集的前8个差异基因进行验证,结果(图4)显示,4个结构基因(F3′H、CHS、DFR、FLS)、2个转录因子(MYB114、bHLH28)和2个光诱导因子(ELIP1、ELIP2)在光诱导幼苗茎和叶中的表达量均随诱导时间延长而增高,这与转录组分析结果一致;所检测的基因均受强光影响而表达,光诱导因子(EILP1、EILP2)和转录因子(MYB114)在强光下表达量很高,而4个结构基因(F3′H、CHS、DFR、FLS)和转录因子(bHLH28)虽受光诱导表达,但表达量较低,因此推测EILP1、EILP2和调节因子MYB114为光诱导花青素合成的关键基因。

图4 强光处理下油菜幼苗类黄酮途径差异基因的RT-qPCR验证Fig.4 RT-qPCR validation of differentially expressed genes in flavonoid pathway in Brassica napus seedlings treated with intensive light
3 讨 论
光照是植物生长发育的必要条件,强光处理可以使一些植物营养器官和生殖器官的颜色发生改变[30]。油菜在强光下营养器官(组织)颜色变紫,且随着诱导时间延长,叶片和茎紫色加深,子叶、老叶边缘、叶柄及叶脉尤为明显,这一现象与矮牵牛中的研究结果[31]相一致。由于植物花器官的观赏价值和果实的营养价值,所以针对光照诱导植物生殖器官变化的研究较多,这些研究认为光诱导植物颜色变化主要是由于光照诱导花青素积累所致[32]。植物颜色由组织细胞液泡内的色素组分和含量决定,而常见的色素主要有花青素、生物碱和胡萝卜素3大类,其中花青素是最主要的天然色素[33],是类黄酮合成途径的次生代谢产物。目前对模式植物拟南芥中类黄酮代谢途径及其分子机理的研究较为清楚[34],已从中分离出类黄酮合成途径的多个结构基因和调节基因,且这些基因在高等植物中高度保守[35-36]。
本研究通过筛选不同光照处理下甘蓝型油菜幼苗的差异表达基因和差异代谢物发现,强光处理油菜幼苗茎、叶颜色变紫,且随诱导时间延长,颜色逐渐变深。通过转录组分析检测到986个次生代谢物基因,其中花青素代谢途径的48个差异表达基因达极显著水平。通过序列比对分析,这48个基因与10个花青素合成的结构基因同源,并鉴定出花青素合成途径的228个调节基因属于转录因子MYB、bHLH和WD40,证明花青素合成相关基因在甘蓝型油菜中存在多个拷贝,且受光诱导调节。通过代谢组分析,从油菜幼苗的第1片真叶中检测出了248个差异代谢物,其中类黄酮代谢途径代谢物81个,不同光照处理油菜幼苗类黄酮途径代谢物差异极显著,证明类黄酮代谢途径受光照诱导调控,油菜颜色变化是由于光照诱导其花青素积累所致,光照诱导油菜颜色的变化主要是由于光照诱导花青素合成基因ANS表达上调,使油菜矢车菊素、翠雀素和牵牛素含量增加所致。对转录组分析鉴定出的表达数量高且在各条目和通路中显著富集的前8个差异基因进行RT-qPCR验证,结果与转录组分析结果一致,这些基因受光照诱导表达,其中结构基因(F3′H、CHS、DFR、FLS)和调节基因bHLH28表达量较低,为组成型表达,而调节基因MYB114、光诱导因子ELIP1和ELIP2表达量较高,为特异性表达,其表达特征与强光下油菜幼苗表型变化一致,MYB114是光诱导花青苷合成的调节基因[37-38]。光诱导因子ELIP1和ELIP2在光诱导下表达量急剧升高,可能在花青苷合成中起到了关键作用,这2个基因的具体功能有待进一步研究。
