青稞条纹病LAMP检测体系的建立
2021-11-18胡章薇张学飞刘耀霞闫佳会郭青云
胡章薇,杨 帆,张学飞,刘耀霞,闫佳会,侯 璐,郭青云,姚 强
(青海大学 农林科学院,青海省农业有害生物综合治理重点实验室/农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016)
青稞是青藏高原最具特色的农作物,在藏族同胞的食物结构中占有不可替代的地位,同时青稞也是饲料和酿造业等农产品加工业的重要原料。青藏高原青稞总播种面积约35万hm2,产量约100万t,分别占青藏高原整个粮食作物种植面积的43%和总产量的38%[1],青稞产业的发展对于保障青藏高原粮食安全和社会稳定具有重大意义。由麦类核腔菌(Pyrenophoragraminea(Rabenk.) Ito et Kurib.)引起的青稞条纹病,是青稞生产上最重要的种传系统性病害,麦类核腔菌侵染青稞后,在感病植株叶片上沿叶脉方向出现黄色或褐色状条纹,感病植株因发育不良而产生不育穗,进而影响青稞产量和品质。青藏高原青稞条纹病每年造成的产量损失约为10%,发病严重的田块甚至高达25%[2]。带菌种子是该病害唯一的初侵染源,收获后病原菌也会继续潜伏在青稞种子里,并加重翌年条纹病的再侵染为害[3-5]。目前青稞生产用种55%以上依靠农户自留种,青稞产区统一供种及外购率仅占30%~45%,以粮代种除导致新品种快速混杂、种性退化之外,还造成了条纹病为害逐年加重。研究表明,控制该病害的有效方法为药剂拌种,或在病害发生初期及时拔除病株,建立无病留种田[6-7]。因此,检测青稞种子是否带菌,再根据种子带菌量进行播前药剂处理,严把健康良种关口,是预防该种传病害的有效措施。
目前国内外青稞条纹病菌的检测方法主要有组织分离法[8]、基于ITS-rDNA序列区间的PCR法[9]、利用特异性引物进行实时荧光定量PCR法[10-12]。其中组织分离法程序繁琐、周期长;基于ITS-rDNA序列区间的PCR法仅有1对引物,识别区域有限,因此特异性较低;利用特异性引物进行实时荧光定量PCR可以弥补以上缺点,但所需仪器昂贵,操作人员需要专业培训才可操作,难以在基层生产中推广应用。因此,开发一种操作简便、用时短、检出效率高且不需要复杂仪器设备的快速检测方法迫在眉睫。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)运用4条特异性引物,可以识别靶序列的6个区域,在65 ℃左右的恒温条件下反应15~60 min,可以达到106~109拷贝数,扩增结果在指示剂染色下还可直接肉眼观察判断[13],已广泛应用于动植物病毒及细菌的检测[14-16]。因此,本研究以青稞条纹病ITS-rDNA序列区间作为靶序列,设计并筛选特异性引物,以钙黄绿素及SYBR Green Ⅰ作为反应指示剂,建立和优化青稞条纹病LAMP检测体系,并分析其特异性及灵敏性,以期为有效开展青稞种子带菌检测及青稞条纹病有效控制提供参考。
1 材料与方法
1.1 材料、试剂与仪器
供试菌株:青稞条纹病菌(Pyrenophoragraminea)采自青海省青稞主产区典型的条纹病发病叶片,经实验室分离纯化得到条纹病菌株;选用青稞上常见的病原菌大麦坚黑粉菌(Ustilagohordei)、裸黑粉菌(Ustilagonuda)、禾生指葡孢霉(Dactylobotrysgraminicola)、细链格孢菌(Alternariaalternata)和禾谷镰孢菌(Fusariumgraminearum)作为对比菌,所有病原菌均通过ITS-PCR扩增检测,以上病原菌均由青海省农业有害生物综合治理重点实验室提供。
供试青稞品种:肚里黄、柴青1号、1141、北青9号和昆仑15,均由青海省农林科学院作物所提供;健康无菌的昆仑18由青海省农业有害生物综合治理重点实验室提供。
检测试剂:DNA-LAMP扩增试剂盒、荧光目视检测试剂盒,购于日本荣研化学株式会社;DNA提取试剂盒HP Fungal DNA Kit,购于Omega Bio-Tek科技有限公司;裂解液Lysis Buffer for Microorganism to Direct PCR,购于宝生物工程(大连)有限公司;SYBR Green Ⅰ(10 000×),购于北京索莱宝科技有限公司。
仪器:TissueLyser Ⅱ组织研磨仪,购于凯杰企业管理(上海)有限公司;NanoDrop One微量核酸蛋白测定仪和sorvall ST 16R高速冷冻离心机,购于赛默飞世尔科技(中国)有限公司;ABI 7500实时荧光定量仪、PCR仪、BIO-RAD电泳仪和凝胶成像仪,购于爱普拜斯应用生物系统贸易(上海)有限公司。
1.2 试验方法
1.2.1 引物设计 根据实验室前期分离的79株条纹病菌菌株得到有效的麦类核腔菌ITS序列,用MEGA软件进行序列分析,利用PrimerExplore V5设计出5组引物。用于设计引物的ITS序列片段见图1,引物信息见表1,引物由生工生物工程(上海)股份有限公司合成。

引物用不同颜色标注,箭头方向表示引物序列的方向Primers are shown in different colors and arrows show directions of primers

表1 用于麦类核腔菌LAMP检测的引物信息Table 1 Primers used for loop-mediated isothermal amplification of Pyrenophora graminea
表1(续) Continued table 1
1.2.2 病原菌基因组DNA的提取 依照DNA提取试剂盒HP Fungal DNA Kit说明书提取病原菌DNA,获得的总DNA经2%琼脂糖凝胶电泳检测其质量,同时将DNA稀释10倍后保存于-20 ℃冰箱。
1.2.3 LAMP反应体系的引物序列筛选 LAMP扩增反应体系:2×反应缓冲液(RM)12.5 μL,FIP和BIP各40 pmol/L,F3和B3各10 pmol/L,LB 20 pmol/L,Bst DNA聚合酶1 μL,钙黄绿素溶液(FD)1 μL,DNA模板2 μL,最后用无菌去离子水补足至25 μL。混合物置于ABI 7500实时荧光定量仪上,60~65 ℃反应70 min。LAMP反应时会产生焦磷酸镁,钙黄绿素可与其镁离子结合发射荧光,每分钟采集1次荧光信号并绘制曲线。反应结束后根据扩增曲线判断反应结果,扩增曲线呈“S”型为阳性,扩增曲线呈直线为阴性。反应前体系中加入钙黄绿素,反应后观察反应体系颜色变化情况,荧光呈绿色为阳性,呈浅橘色为阴性。
1.2.4 LAMP反应体系的最适温度筛选 筛选出引物组后,对反应温度进行优化。以麦类核腔菌基因组DNA为模板,设置温度为60,61,62,63,64和65 ℃ 6个梯度,筛选LAMP反应体系最适温度。反应结果判断同1.2.3节。
全面落实“三步走”战略,伴随各项业务指标稳步增长,医院进入“用顺境加速发展”的阶段。学科发展如何更进一步,温秀玲表示人才培养、平台搭建至关重要。
1.2.5 LAMP反应体系的特异性检测 分别以麦类核腔菌(P.graminea)、大麦坚黑粉菌(U.hordei)、裸黑粉菌(U.nuda)、禾生指葡孢霉(D.graminicola)、细链格孢(A.alternata)和禾谷镰孢菌(F.graminearum)基因组DNA为模板进行LAMP反应,以ddH2O作为阴性对照,反应结果判断同1.2.3节。为进一步验证该体系的特异性以及染料SYBR Green Ⅰ的适用性,另选取29个不同采样地的条纹病菌株基因组DNA,进行LAMP反应体系的特异性检测,具体方法同上。
1.2.6 LAMP反应体系的灵敏度检测 以麦类核腔菌基因组DNA为模板,用NanoDrop One微量核酸蛋白浓度测定仪测得DNA原液稀释液的质量浓度为310 pg/μL。用ddH2O进行10倍梯度稀释,使其质量浓度依次为310,31,3.1,0.31,0.031和0.003 1 pg/μL,分别取2 μL DNA稀释液添加至反应体系,以ddH2O作为阴性对照,每个梯度重复3次,结果判定方法同1.2.3节。同时与常规PCR比较其最低检测量,评估其灵敏度。
1.2.7 青稞种子带菌率检测 (1)田间发病调查。将肚里黄、柴青1号、1141、北青9号和昆仑15等5个青稞品种于2019年3月下旬在青海西宁试验田播种,每个品种种植面积20 m2,采用等行距条播,行长2.0 m,行距0.3 m,每行播种量6 g,在灌浆期(7月上旬)调查青稞条纹病田间发病情况,8月下旬收获晾晒后常温储存备用。
(2)青稞种子条纹菌DNA的制备。 参考吸水纸培养法[17],使青稞种子中微生物得到富集,再以裂解液裂解青稞种子及微生物细胞,得到种子及微生物的混合DNA 裂解液。将混合DNA裂解液作为模板,添加至LAMP反应体系,以麦类核腔菌基因组DNA和ddH2O分别作为阳性对照和阴性对照,并在反应体系中加入30 μL矿物油避免气溶胶污染。
(3)青稞种子带菌率检测。得到最佳反应条件后,为降低成本,以SYBR Green Ⅰ 代替钙黄绿素作为显色剂。反应前加入0.5 μL SYBR Green Ⅰ 于PCR管顶盖,反应结束后混匀,反应液呈荧光绿为阳性,记为被麦类核腔菌感染的种子,即带菌种子;呈橘色为阴性,记为未被麦类核腔菌感染的种子,即未带菌种子。
种子带菌率=带菌种子数/检测种子总数×100%。
2 结果与分析
2.1 LAMP反应体系的引物序列筛选
以麦类核腔菌基因组DNA为模板,65 ℃反应70 min,特异性引物筛选结果(图2)表明,引物组2 LAMP扩增曲线呈“S”型,同时可见其反应溶液变为荧光绿色。其他引物组及阴性对照扩增曲线为直线,且反应体系呈浅橘色,因此选用引物组2为 LAMP扩增引物,DNA模板质量浓度为3.1 ng/μL。
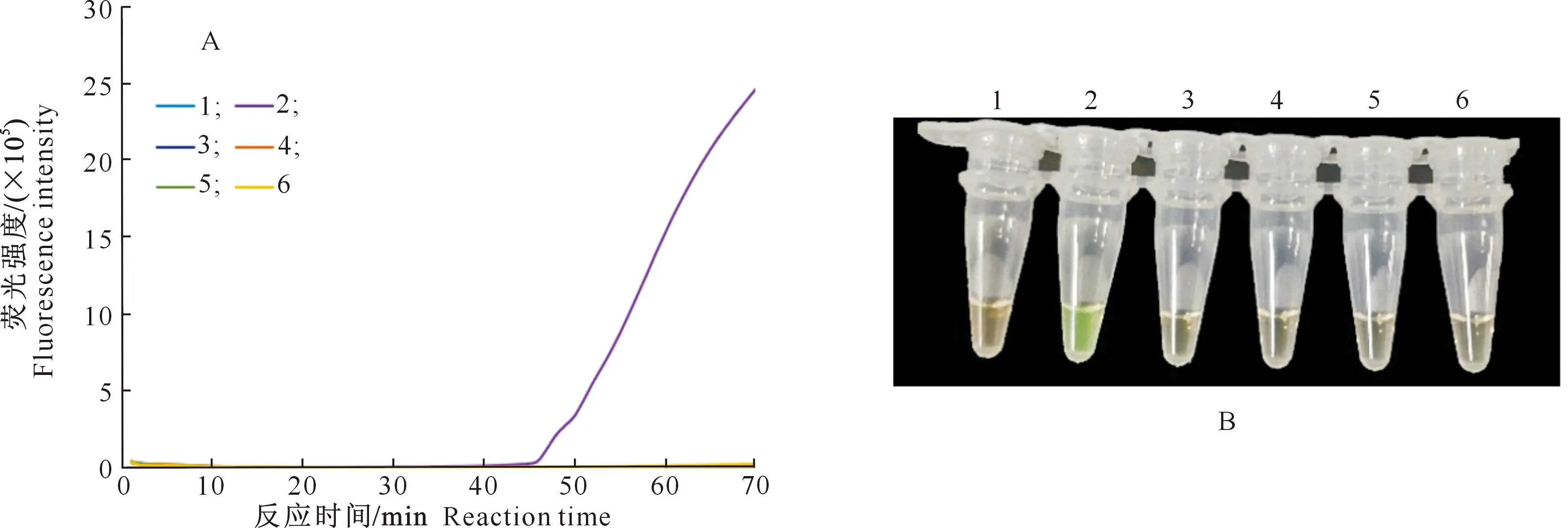
A.引物扩增曲线;B.LAMP扩增产物目视图。1~5.引物组1到引物组5;6.阴性对照A.Amplification of primers;B.Visual assessment of LAMP products.1-5.Primers sets 1 to 5,respectively;6.Negative control图2 青稞条纹病LAMP引物的扩增结果Fig.2 LAMP primers for identification of Pyrenophora graminea
2.2 LAMP反应体系的最适温度筛选
由图3可知,在各设置温度下扩增曲线均呈“S”型,反应溶液均呈现荧光绿色,证明该引物组的反应条件较为宽松。其中62,63和64 ℃出峰时间无明显差别,均在25 min左右就出现“S”型扩增曲线;61和65 ℃扩增曲线于27 min左右出现;60 ℃的扩增曲线出现最晚,在30 min左右。为保证反应的稳定性,选择63 ℃为最佳反应温度。

A.不同温度扩增曲线;B.不同温度LAMP扩增产物目视图。1~6.温度分别为 60,61,62,63,64和65 ℃A.Amplification with different temperatures;B.Visual assessment of amplification reaction of different temperatures.1-6.60,61,62,63,64 and 65 ℃,respectively图3 不同温度条件下的LAMP扩增结果Fig.3 LAMP detection with different amplification temperatures
2.3 LAMP反应体系的特异性
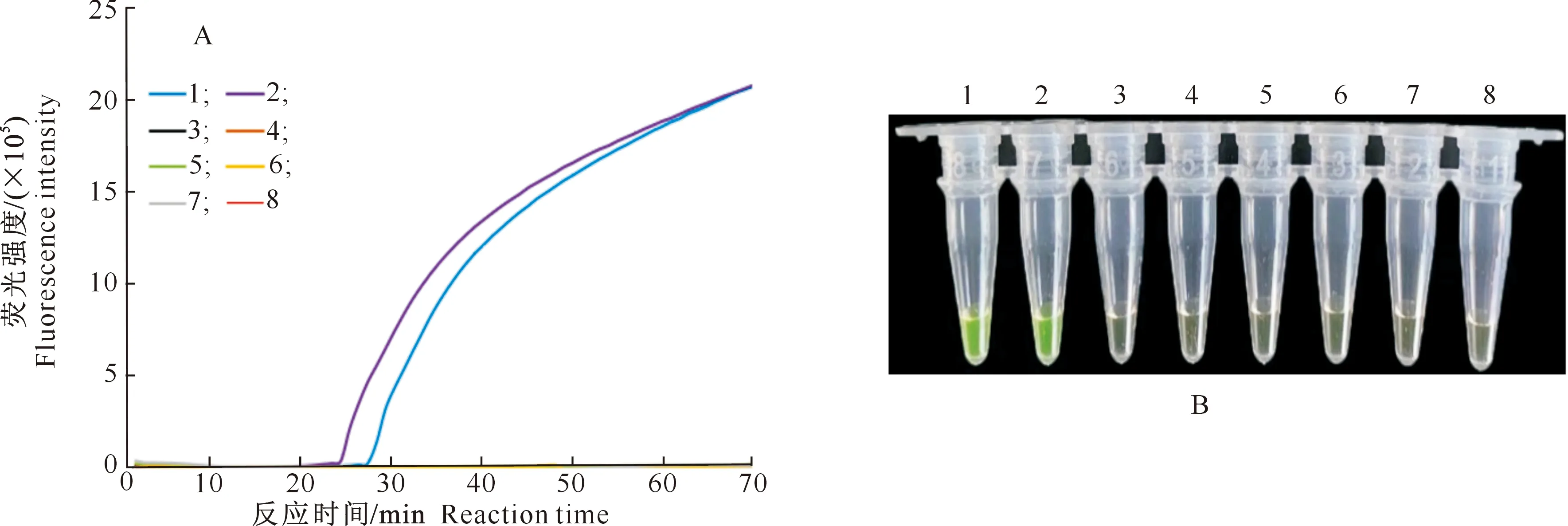
A.不同病原菌扩增曲线;B.不同病原菌LAMP扩增产物目视图。1~2.麦类核腔菌;3~7.依次为大麦坚黑粉菌、裸黑粉菌、禾生指葡孢霉、细链格孢和禾谷镰孢菌;8.阴性对照A.Amplification with different strains;B.Visual assessment of amplification reaction of different strains.1-2.Pyrenophora graminea;3-7.Ustilago hordei,Ustilago nuda,Dactylobotrys graminicola,Alternaria alternata and Fusarium graminearum;8.Negative control图4 LAMP反应的特异性检测结果Fig.4 Specificity test results of LAMP method
在其他反应条件不变的情况下,选取29个不同采样点的麦类核腔菌菌株DNA溶液,以SYBR Green Ⅰ代替钙黄绿素作为显色剂,以有扩增反应的2株麦类核腔菌作为阳性对照,ddH2O作为阴性对照,反应结果如图5所示。由图5可以看出,不同采样点的麦类核腔菌菌株反应体系均呈荧光绿色,阴性对照呈橘色,表明该检测技术能有效检测不同地区的麦类核腔菌,且SYBR Green Ⅰ可以代替钙黄绿素作为显色剂。

1~2.阳性对照;3~31.不同采样点的麦类核腔菌菌株;32.阴性对照1-2.Positive control;3-31.Strains of Pyrenophora graminea from different areas;32.Negative control图5 不同采样点麦类核腔菌LAMP扩增反应的目视图Fig.5 LAMP amplification of Pyrenophora graminea from different locations
2.4 LAMP反应体系的灵敏度
由图6-A可见,随着麦类核腔菌基因组DNA质量浓度的降低,LAMP反应出峰的时间延长;当麦类核腔菌基因组DNA质量浓度降到0.31 pg/μL以下后,扩增曲线为直线。由图6-B可见,反应结束后, DNA质量浓度为0.31 pg/μL以下的试验组反应液呈浅橘色,DNA质量浓度为 0.31 pg/μL及以上的试验组反应液颜色为荧光绿,表明LAMP检测最低限度为0.31 pg/μL。
将常规PCR产物用2%的琼脂糖凝胶进行电泳检测,模板质量浓度为0.003 1 ng/μL(即3.1 pg/μL)时,无特异性条带出现;模板质量浓度为0.031 ng/μL(即31 pg/μL)时,仅有微弱条带出现(图7)。对比可知,本研究建立的LAMP检测方法比常规PCR技术灵敏度高100倍。

A.不同质量浓度DNA的扩增曲线;B.不同质量浓度DNA的LAMP扩增产物目视图。1~6.DNA质量浓度依次为310,31,3.1,0.31,0.031和0.003 1 pg/μL;7.阴性对照 A.Amplification with different DNA concentrations;B.Visual assessment of amplification reaction of different DNA concentration.1-6.DNA concentrations of 310,31,3.1,0.31,0.031 and 0.003 1 pg/μL,respectively;7.Negative control
2.5 青稞种子的带菌率
乳熟期对5个青稞品种进行条纹病发病情况调查,结果如表2所示。由表2可知,肚里黄、柴青1号、1141、北青9号和昆仑15的发病株率分别为25%,12%,82%,45%和9%。
对5个待测青稞品种分别随机选取22粒种子提取DNA,其LAMP检测结果如表2所示。由表2可知,肚里黄、柴青1号、1141、北青9号和昆仑15种子的带菌率分别为68.18%,72.73%,100%,77.27%和68.18%。
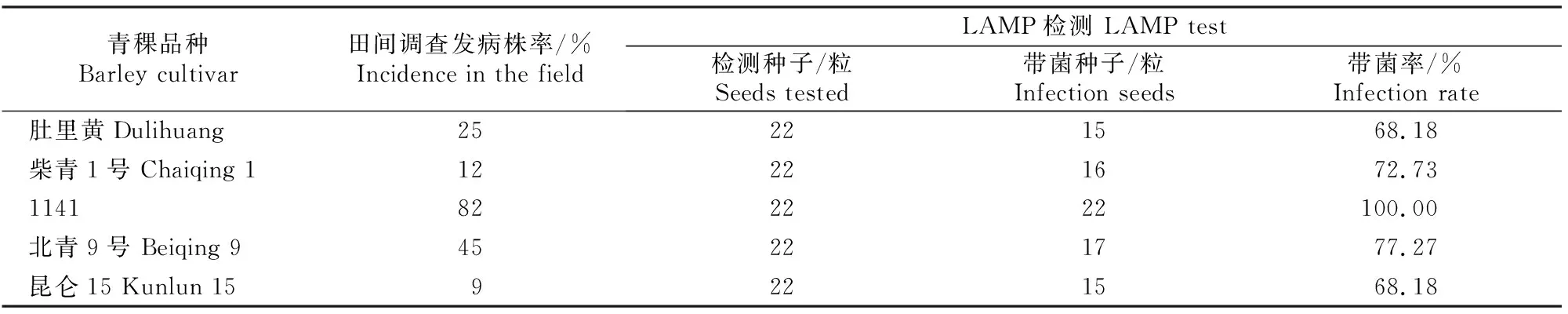
表2 青稞种子带菌率的LAMP检测结果Table 2 LAMP test results of conventional cultivated cultivars of barley
3 讨 论
本研究针对青稞条纹病发生严重且有逐年恶化趋势这一科学问题,开发青稞条纹病菌快速检测技术体系。通过青稞条纹病菌的ITS-rDNA序列区间设计了5组引物,从中筛选获得1组有效引物,并经过优化反应体系温度,建立了高效检测该病原菌的LAMP技术体系。在63 ℃反应70 min,该检测方法对麦类核腔菌具有良好的特异性,其最低检测限为0.31 pg/μL。田间调查发病株率及抽查种子带菌率的检测结果表明,建立的青稞条纹病LAMP检测体系可以检测青稞种子是否带菌,进而实时指导药剂拌种,从源头上防控病害。
真菌ITS-rDNA序列拥有相对丰富的信息,ITS-rDNA序列分析在真菌分子生物学鉴定中比较常用[18]。环介导等温扩增技术,凭借其特异性强、灵敏度高、反应时间短、检测成本低和操作简单等特性,已广泛应用于植物保护、临床、食品安全等领域,其灵敏度均能达到pg级水平[19]。前人研究表明,该检测技术对DNA模板质量要求低,可从发病组织中提取的包含有寄主植物、病原菌和其他腐生微生物的DNA中直接检出目标病原菌[20-21]。本研究基于麦类核腔菌ITS-rDNA序列区间,设计了5组引物,其中引物组2具有良好的特异性,在反应结束后根据反应颜色变化及扩增曲线可以直接判断检测结果,无需开盖电泳,保证了试验环境不被气溶胶污染;同时,建立的青稞条纹病LAMP检测体系,无需复杂仪器,检测特异性强,灵敏度达到fg级别。杜然[22]建立的油菜黑胫病和油菜茎基溃疡病LAMP检测体系,其灵敏度分别为112和696 fg;Zhou等[23]通过LAMP-LFD技术检测油菜茎基溃疡病菌(Leptosphaeriamaculans),其最低检测限为114 fg;赵媛媛等[24]建立了由强雄腐霉(Pythiumarrhenomanes)引起的玉米茎腐病的检测体系,最低检测限为10 pg;黄雯等[25]建立的植物青枯菌(Ralstoniasolanacearum)LAMP检测体系,其灵敏度为1.42 pg,比普通PCR高10倍。本研究建立的青稞条纹病LAMP检测体系,其灵敏度与杜然[22]和Zhou等[23]的研究相当,比赵媛媛等[24]和黄雯等[25]设计的引物检测灵敏度高。
曾丹丹等[26]应用水洗法得到大豆种子表面的病原菌;袁咏天等[27]研究表明,超声水洗法用于检测水稻恶苗病较为可行。但青稞条纹病病原菌主要以菌丝形态潜伏于种子中,无法水洗得到。目前大豆、水稻及西瓜等种传病害一般采用LAMP技术进行检测[26-29],但青稞条纹病因其含菌量较低,容易漏检,因此本研究将青稞种子中微生物经富集后检测,较大幅度提高了检测的准确率。本研究中5个青稞品种采用LAMP检测的种子带菌率均高于田间检测的发病率,这与蔺瑞明等[3]的研究结果一致,其中1141为高感品种,带菌率为100%;肚里黄和北青9号2个品种也较田间检测的带菌率高,可能是样本量较小,也可能是田间发病后病原菌再侵染导致种子带菌量更高所致;昆仑15和柴青1号的田间发病株率分别为9%和12%,而其种子带菌率分别高达68.18%和72.73%,与田间发病株率的明显差异也可能与品种的抗性有关。
本研究建立的青稞条纹病菌LMAP检测体系的灵敏度可达到fg级,是常规PCR检测技术的100倍,且LAMP体系对DNA质量要求不高,可在生产上开展种子带菌量检测和评估,并对指导青稞条纹病防控提供有效的技术支撑。本研究使用的裂解液价格较高,为了今后在基层青稞良种检测中推广该检测体系,还需要对提取种子DNA的方法[30]继续进行简化和优化。研究表明,SDS简化法和NaOH裂解法[31]等快速提取DNA的方法可以满足病原菌LAMP检测体系的要求。同时,也可参考国际种子检测协会的推荐,使用富集油菜种子中带菌量的吸水纸培养法[17]对富集方法进行优化。因此,后续将开展带菌种子DNA快速提取及种子带菌量富集方法的建立与优化研究,并与本研究的LAMP检测体系相结合,从而真正提高检测体系的便捷度和检测能力,便于及时指导带菌种子的药剂拌种处理,达到从源头控制病害的目的,不仅为开展青稞农药减量增效行动提供技术支撑,也为全面提升农牧业绿色发展水平提供技术保障。
