西瓜渗调蛋白ClOsm基因克隆及其编码蛋白的抑菌活性
2021-11-18黄小忠徐晓燕
黄小忠,韦 湘,徐晓燕
(江苏农林职业技术学院 茶与食品科技学院,江苏 句容 212400)
西瓜是重要的经济作物之一,我国是西瓜生产与消费的第一大国。据世界粮农组织(FAO)统计,2018年我国西瓜种植面积149.91万hm2,总产量6 280.38 万t,分别占世界西瓜种植面积和总产量的46.25%和60.43%。西瓜枯萎病由尖孢镰刀菌西瓜专化型侵染引起,严重制约西瓜生产,为害严重时可减产80%以上甚至绝收[1]。西瓜蔓枯病由瓜类黑腐球壳菌侵染引起,主要为害瓜蔓、叶片和果实,引起叶蔓枯死和果实腐烂[2]。西瓜白粉病主要为害叶片,以生长中后期受害较重,造成叶片干枯,植株早衰[3]。西瓜生长发育过程中枯萎病、蔓枯病和白粉病等病害的发生,降低了西瓜产量和品质。因此,挖掘抗病相关基因并应用于其抗病育种是提高西瓜品种抗病性的根本途径。
病程相关蛋白(pathogenesis-related proteins,PRs)是寄主与病原物互作过程中诱导产生的一类蛋白,不仅在受侵染的组织中积累,在整个植株中均有表达[4]。目前已鉴定出17个不同的PRs蛋白家族,如具有β-1,3葡聚糖酶活性的PR-2、具有几丁质酶活性的PR-3和类甜蛋白家族PR-5等,其中许多具有抗真菌活性[5]。PR-5蛋白包括类甜蛋白(thaumatin-like proteins,TLP)和渗调蛋白(osmotin),是PRs蛋白中非常重要的蛋白之一。研究证明,PR-5蛋白不仅能诱导真菌细胞程序性死亡,抑制真菌侵染,还能诱导植物细胞的程序性死亡,激活植物防卫反应信号途径,增强植物的抗逆境能力[5]。体外抑菌试验证明,PR-5蛋白能够抑制尖孢镰刀菌(Fusariumoxysporum)、腐皮镰刀菌(Fusariumsolani)、轮枝菌(Verticilliumdahliae)等多种植物病原菌的孢子萌发和菌丝生长[6-9]。用LePR5重组蛋白处理后,番茄黑腐病发病率比对照降低了49%[7]。PR-5蛋白因其显著的抑菌活性,已被广泛应用于植物抗真菌基因工程研究[8-11]。目前已经从小麦[12]、大豆[13]、罗勒[6]、荔枝[14]、香蕉[15]、樱桃番茄[7]等多种植物中克隆到PR-5基因。大量研究表明,PR-5基因在土豆[10]、烟草[8]、栎树[11]、拟南芥[9]等植物中的过量表达均显著提高了转基因植株的抗真菌能力。总之,尽管已经从多个物种中克隆了PR-5基因并开展了相关功能研究,但从西瓜中克隆和分析PR-5的研究并不多,只有Zhang等[16]报道了体外重组西瓜TLP蛋白的抑菌活性。因此,开展西瓜PR-5抗病基因挖掘,对其进行深入的表达和功能分析很有必要。
笔者前期运用蛋白质双向电泳结合质谱鉴定技术,分析了枯萎病菌侵染下西瓜根系的差异表达蛋白,发现枯萎病菌侵染后有1个渗调蛋白的丰度显著提高(数据另文发表)。在此基础上,本研究利用RT-PCR技术,克隆该渗调蛋白基因,命名为ClOsm,采用荧光定量PCR技术分析ClOsm基因在西瓜不同器官及病原菌侵染下的表达特征,利用原核表达技术体外表达并纯化ClOsm蛋白,研究其对病原菌生长的抑制活性,以期为通过基因工程技术创制西瓜抗病材料奠定基础。
1 材料与方法
1.1 试验材料
供试西瓜(Citrulluslanatus(Thunb.) Matsum. et Nakai)品种为8424,种子购于上海惠和种苗有限责任公司。将西瓜种子浸于55 ℃热水中并不断搅动,水温自然降低至25 ℃左右后继续浸种6~8 h。然后将种子置于28~30 ℃恒温箱中催芽24 h,种子露白后播种于无菌育苗钵中,置于25~30 ℃、光照/黑暗时间为16 h/8 h、相对湿度70%的人工气候箱中培养。取培养15 d的幼苗,取西瓜根、茎、叶,用于组织表达分析和病原菌侵染处理。
枯萎病菌、蔓枯病菌、白粉病菌、茄病镰刀菌和轮枝镰刀菌分别置于PDA平板上,25 ℃恒温气候箱中培养。以上菌株均由江苏省农业科学院植保所提供。
1.2 病原菌侵染
取15 d的西瓜幼苗,用刀片进行伤根处理。取枯萎病菌菌块接种于100 mL土豆葡萄糖液体培养基中,25 ℃、200 r/min振荡培养7 d,用血球记数法稀释至孢子液浓度为5×106个/mL。采用浸根接种法进行植株侵染,分别于侵染后0(CK),12,24,48,120,168 h取西瓜根系组织,液氮速冻后,-80 ℃保存备用。
1.3 ClOsm基因的克隆与序列分析
根据蛋白质双向电泳分析中获得的部分渗调蛋白序列信息,搜索西瓜基因组数据库(http://cucurbitgenomics.org/),获得该渗调蛋白基因的全序列,采用PrimerPremier 5软件设计特异引物,以西瓜枯萎病菌侵染12 h的西瓜根系组织cDNA为模板进行扩增。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火40 s,72 ℃延伸1 min,共30个循环;72 ℃再保温10 min。对PCR产物进行割胶回收并纯化,再连接pGEM-T easy载体转化大肠杆菌DH5α感受态细胞进行蓝白斑筛选,阳性克隆送南京擎科生物公司测序。采用Clustal X (ver 2.2)软件进行多重氨基酸序列比对分析,采用GeneDOC(ver 2.7)软件编辑序列,采用MEGA 5.0软件构建系统进化树。
1.4 ClOsm基因表达特性的RT-PCR分析
以西瓜根、茎、叶各器官的cDNA为模板,进行ClOsm基因在各器官中的表达模式分析。以西瓜枯萎病菌侵染不同时间的西瓜根系组织cDNA为模板,进行ClOsm基因的诱导表达分析。采用SuperReal PreMix (SYBR Green,TianGen,China)荧光定量PCR试剂和ABI PRISM7300实时定量PCR仪进行表达分析,反应体系与程序参照试剂说明。以西瓜18S rRNA基因(GenBank登录号AB490410)为内参。采用2-ΔΔCT法[17]分析基因的相对表达量。每样品设3个重复,试验重复3次。
1.5 原核表达载体构建
以西瓜叶片cDNA为模板,用带有NcoⅠ和XhoⅠ酶切位点的ClOsm引物进行PCR扩增,得到ClOsm基因编码区。分别将ClOsm基因与带有His标签的pET-28a(+)载体进行NcoⅠ与XhoⅠ双酶切,采用同源重组的方法将ClOsm基因片段连接到pET-28a(+)载体上,经琼脂糖电泳进行胶回收(按试剂盒步骤进行),过程中去掉ClOsm基因的信号肽。16 ℃连接过夜,连接产物转化到DH5α感受态细胞中,37 ℃培养14 h后在氨苄青霉素抗性平板上挑取白色菌落,经菌落PCR初步鉴定阳性克隆,再用NcoⅠ与XhoⅠ双酶切鉴定,交由上海三优生物医药公司测序,测序正确的质粒即为pET-28a(+)-ClOsm,得到His-ClOsm,以His为阴性对照。采用冻融法将pET-28a(+)-ClOsm重组质粒转入大肠杆菌原核表达菌株Trans BL21(DE3) pLysS中,用于ClOsm重组蛋白的体外诱导表达。
1.6 ClOsm重组蛋白的体外诱导表达及纯化
挑取His-ClOsm单克隆接种到适量氨苄青霉素抗性2×YT培养基中,200 r/min、37 ℃振荡培养至菌液OD600为0.6左右。加入终浓度为1 mmol/L的IPTG,16 ℃培养14 h诱导融合蛋白表达。7 000 r/min离心10 min收集菌体,PLB buffer重悬后超声裂解。裂解液过Ni柱纯化,分别用低浓度咪唑洗涤和高浓度咪唑洗脱,SDS-PAGE检测纯化蛋白。
1.7 His-ClOsm融合蛋白的体外抑菌活性检测
配制含50 μmol/L His-ClOsm的PDA培养基平板,用5 mm打孔器分别打取枯萎病菌、蔓枯病菌、白粉病菌、茄病镰刀菌和轮枝镰刀菌菌块,分别置于PDA平板中央,28 ℃培养4 d后观察His-ClOsm对病菌生长的抑制情况。以不含His-ClOsm蛋白的PDA平板为对照。
1.8 数据分析
试验数据利用SPSS 16.0的Student’t-test进行差异显著性分析。
2 结果与分析
2.1 ClOsm基因克隆及序列分析
以西瓜根系cDNA为模板进行PCR扩增,得到1条特异的长768 bp的产物(图1),经克隆和测序后获得基因序列,命名为ClOsm(GenBank登录号为MF445019)。ClOsm基因ORF包含768个碱基,编码255个氨基酸,预测分子质量为27.52 ku,等电点为7.78。

M.DL2000 DNA Marker;1.ClOsm基因的扩增产物;2.阴性对照M.DL2000 DNA Marker;1.PCR product of ClOsm gene;2.Negative control图1 西瓜ClOsm基因的PCR扩增Fig.1 Cloning of ClOsm from watermelon
将ClOsm基因编码蛋白与已知的植物类甜蛋白(TLP)氨基酸序列进行多重序列比对,发现ClOsm基因编码蛋白含有TLP蛋白家族特有的16个半胱氨酸保守域(图2)。利用MEGA 5.0软件进一步分析ClOsm蛋白与其他植物TLP 蛋白的亲缘关系,结果如图3所示。由图3可以看出,不同植物的TLP 系统进化关系具有明显的种属特征,且进化树分为两类,一类为Thaumatin类型,另一类为osmotin类型。ClOsm蛋白与葫芦科作物冬瓜BhOsm蛋白的亲缘关系最近,相似度达95%,而BhOsm为osmotin类型[18],故将ClOsm蛋白归为osmotin类型。

*为16个TLP蛋白保守的半胱氨酸残基。ClOsm.西瓜(MF445019);BhOsm.冬瓜(AAD53089.1);CsOsm.黄瓜(XP_004150181.1);CmOsm.甜瓜(XP_008457495.1);CjTLP.柠檬(BAI63297.1);CcTLP.克莱门柚(XP_006424795.1)* indicate the conserved 16 cysteine residues.ClOsm.Citrullus lanatus (MF445019);BhOsm.Benincasa hispida (AAD53089.1);CsOsm.Cucumis sativus (XP_004150181.1);CmOsm.Cucumis melo (XP_008457495.1);CjTLP.Citrus jambhiri (BAI63297.1);CcTLP.Citrus clementina (XP_006424795.1)图2 ClOsm氨基酸序列与其他植物TLP蛋白氨基酸序列的多重比对Fig.2 Multi-alignment of deduced TLP proteins of watermelon with other plant species

数字表示bootstrap重复1 000次的置信度。标尺为氨基酸置换概率Numbers show the confidence level of bootstrap replication 1 000.The scale bar means changes of amino acids图3 ClOsm与其他植物TLP蛋白的系统进化树Fig.3 Phylogenetic tree of ClOsm with TLPs from other plants
2.2 ClOsm基因的表达特性
由图4-A可见,ClOsm基因在西瓜根、茎、叶各组织中都有表达,其中在根中表达量最高,茎中略低,而在叶中表达量最低。
由图4-B可见,西瓜枯萎病菌侵染后ClOsm基因表达被诱导。接种120 h时ClOsm基因的表达量达到最高,为未接种对照CK的1.39倍(P<0.05); 168 h时表达量有所下降,但仍高于对照CK,为对照CK表达量的1.19倍。

A.ClOsm基因在西瓜不同组织中的表达;B.ClOsm基因在西瓜根系枯萎病菌侵染不同时间的诱导表达A.Expression of ClOsm gene in different watermelon tissues;B.Expression of ClOsm gene in watermelon roots under Fusarium oxysporum inoculation图4 ClOsm基因的表达特性Fig.4 Expression profile of ClOsm gene
2.3 His-ClOsm融合蛋白的诱导表达及纯化
采用同源重组的方法将ClOsm基因片段连接到pET-28a(+)载体上,获得重组质粒pET-28a(+)-ClOsm,其经双酶切后得到1条长约750 bp的条带(图5-A),与预期大小一致,结合测序验证结果表明,原核表达载体pET-28a(+)-ClOsm已成功构建。用重组质粒pET-28a(+)-ClOsm转化大肠杆菌原核表达菌株Trans BL21(DE3) pLysS后,用IPTG诱导重组蛋白的表达,根据重组蛋白序列预测ClOsm蛋白的分子质量为26.1 ku。SDS-PAGE鉴定结果显示,诱导蛋白His-ClOsm分子质量大小约为26 ku,与理论分子质量一致,且样品纯度大于90%(图5-B)。
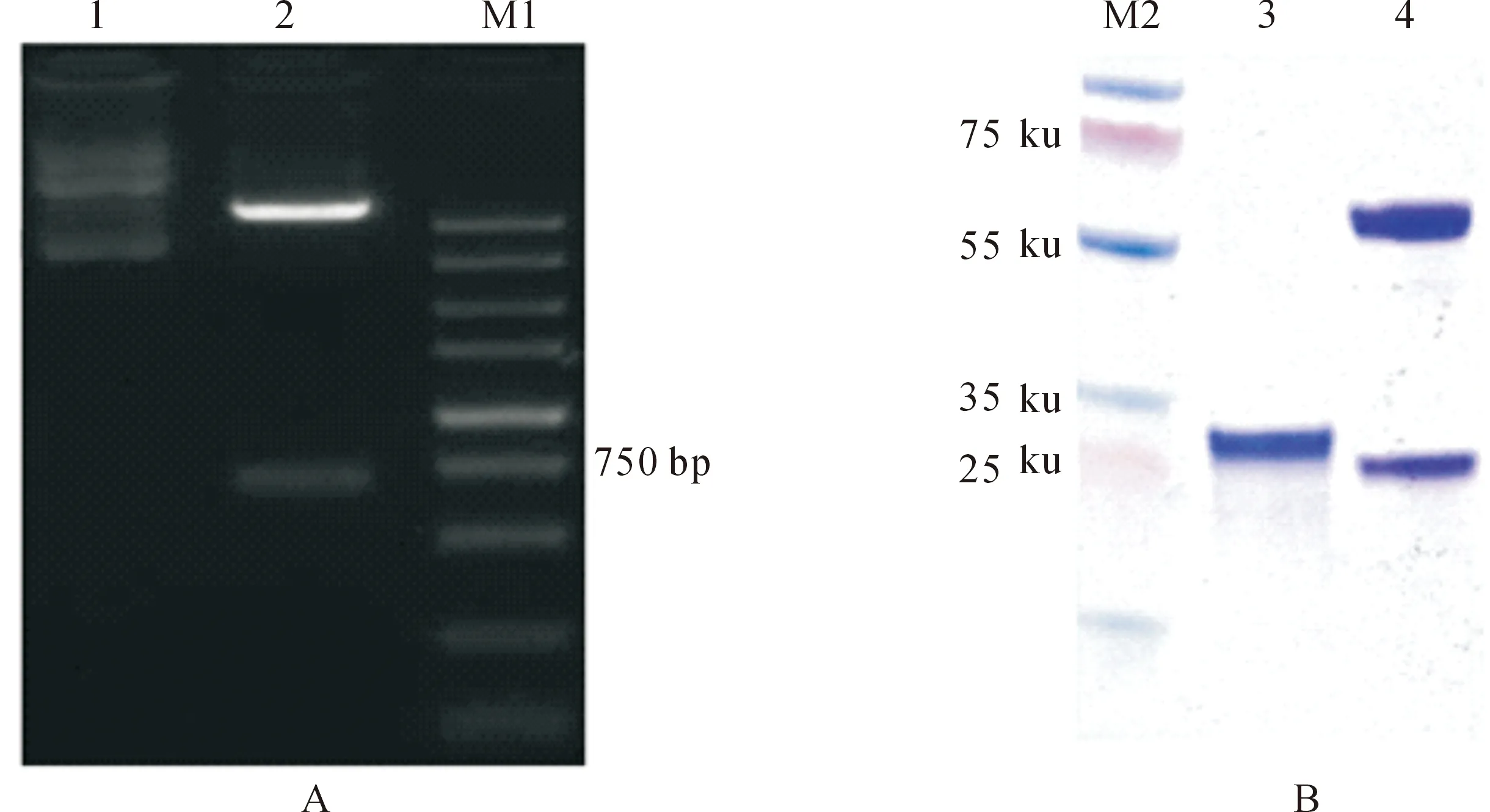
A.pET-28a(+)-ClOsm原核表达载体酶切验证:1.未酶切的pET-28a(+)-ClOsm质粒;2.酶切后的pET-28a(+)-ClOsm质粒;M1.DNA Marker。B.纯化的His-ClOsm融合蛋白:M2.低分子量蛋白Marker;3.纯化的His-ClOsm蛋白;4.阳性对照A.Recombinant plasmid digested by Nco Ⅰ and Xho Ⅰ:1.pET-28a(+)-ClOsm plasmid;2.pET-28a(+)-ClOsm plasmid digested by Nco Ⅰ and Xho Ⅰ;M1.DNA Marker.B.Purified recombinant His-ClOsm protein:M2.Low molecular weight protein Marker;3.Purified His-ClOsm protein;4.Positive control图5 His-ClOsm融合蛋白的诱导表达Fig.5 Induction and purification of recombinant His-ClOsm protein
2.4 His-ClOsm融合蛋白的体外抑菌活性
由表1可见,对照PDA平板上菌丝能够正常生长,而His-ClOsm融合蛋白处理的PDA平板上,西瓜枯萎病菌、蔓枯病菌、白粉病菌、茄病镰刀菌和轮枝镰刀菌等5种病原菌的生长均受到抑制,抑制率分别为70.2%,60.8%,65.3%,55.4%和46.6%。

表1 His-ClOsm重组蛋白对病原真菌的抑菌活性Table 1 Antifungal activity of recombinant His-ClOsm protein
3 讨 论
植物受到生物或非生物胁迫时,病程相关蛋白5(PR-5)在植物组织内迅速表达并积累,从而快速提高植物抗性。本研究从西瓜中克隆到PR5蛋白基因ClOsm,其氨基酸序列具有典型的PR5蛋白保守结构域,系统进化分析发现ClOsm与PR5蛋白家族中的osmotin类型蛋白聚为一类,表明ClOsm属于osmotin蛋白类型;组织特异性表达结果表明,ClOsm基因在根中表达量最高,其次是茎和叶。这与张宏一等[19]的研究结果一致,而与尚姝婷等[20]在花中表达量最高的研究结果不同。osm基因在花中高表达可能与其促进花的减数分裂[21]有关。渗调蛋白在植物中普遍存在,其表达受多种胁迫因素诱导[22]。osm过量表达提高了植株对盐胁迫[22]、干旱[20,23-24]、低温和病害[25]的抗性。本研究中,西瓜被枯萎病菌侵染后,ClOsm基因的表达受到枯萎病菌的诱导,在侵染后120 h表达量最高,与王树军等[14]的研究结果一致,说明ClOsm基因可能在西瓜响应枯萎病菌侵染过程中发挥作用。
已有大量的体外抑菌试验证明,抗真菌活性是PR-5蛋白的主要生理功能之一。如牛心朴子草类甜蛋白CkTLP对植物病原真菌尖孢镰刀菌(Fusariumoxysporum)、轮枝菌(Verticilliumdahliae)、丝核菌(Rhizoctoniasolani)、葡萄孢菌(Botrytiscinerea)和腐烂病菌(Valsamali)有抑制作用[26]。花生AdTLP重组蛋白对尖孢镰刀菌、腐皮镰刀菌(Fusariumsolani)和葡萄孢菌的孢子萌发以及丝核菌的菌丝生长有抑制作用[8]。Wang等[27]从美洲黑杨×欧美杨中分离到的类甜蛋白PeTLP能够抑制根霉菌(Rhizopussp.)菌丝体生长和黑曲霉菌(Aspergillusniger)、桔青霉菌(Penicilliumcitrinum)的孢子萌发。TLP蛋白的抗真菌活性可能与其具有β-1,3-葡聚糖酶活性有关。β-1,3-葡聚糖是真菌细胞壁的主要成分,葡聚糖酶活性可以使TLPs结合并降解真菌细胞壁。但是并非所有的TLPs都具有抗菌活性,如大麦TLPs蛋白HvPR5b、Pr22-1和Pr22-2[28]及橡胶osmotin-like蛋白[29]不能抑制真菌生长。本研究中的体外抑菌试验结果表明,ClOsm对枯萎病菌、蔓枯病菌、白粉病菌、茄病镰刀菌和轮枝镰刀菌等西瓜常见病原菌都有很好的抑制作用,提示ClOsm可能在西瓜抗病方面发挥一定作用。
有关植物PR-5蛋白的抑菌机制研究目前仍处于探索阶段。有研究认为,PR-5蛋白能引起病原菌细胞膜通透性改变,在菌体细胞膜上产生小孔,使得细胞内容物外渗,从而导致菌体死亡[30]。也有研究认为,PR-5蛋白对病原菌的识别与病原菌细胞壁或细胞膜的表面成分有关,如Permatin蛋白通过与真菌细胞膜上的特异性磷脂成分相互作用,引起细胞膜裂解破碎致菌体死亡[31]。不同基因可以增强或抑制PR-5蛋白的抑菌作用。如酵母细胞壁糖蛋白的PIR家族能抑制PR-5蛋白的活性,而糖蛋白上的磷酸化甘露聚糖则能增强PR-5蛋白对菌体的毒性[32]。为进一步明确西瓜ClOsm基因的抑菌功能,后续拟采用农杆菌介导法获得ClOsm基因过量表达的植株,并对其进行组织病理学观察及抗病性分析,以明确ClOsm基因调控西瓜抗枯萎病的机制。
