甘氨酸、脯氨酸及羟脯氨酸介导胶原蛋白代谢研究进展
2021-11-18王正阳郝亭亭梁云安史庆超毕保良
荣 华,王正阳,郝亭亭,梁云安,史庆超,毕保良
(1云南农业大学 动物科学技术学院,云南 昆明 650201;2云南省高校高原渔业资源保护与可持续利用重点实验室,云南 昆明 650201;3云南临沧水产技术推广站,云南 临沧 677000;4内江师范学院 长江上游鱼类资源保护与利用四川省重点实验室,四川 内江641112)
胶原蛋白中含有多种人体必需的氨基酸,其代谢副产物参与重要的生命活动,在细胞营养物质的吸收转运、细胞分裂增殖及免疫、抗癌等方面均发挥着重要作用[1]。胶原蛋白被认为是保健食品中最富有营养的原料,可以改善大脑功能,维持正常内分泌状态,调节免疫功能[2]。随着生活水平的提高,人们对天然保健食品的需求量与日俱增。目前,食品和制药工业中使用的胶原蛋白大都来自于动物机体自身合成,人工合成的胶原蛋白往往分子单一且成本高[3]。提高动物自身胶原蛋白产量显得尤为重要,某些营养素或者细胞因子能否促进胶原蛋白沉积这一问题随之成为了研究热点。许多研究表明,外源添加脯氨酸(Pro)、羟脯氨酸(Hyp)、维生素C、谷氨酰胺和α-酮戊二酸对动物机体胶原蛋白沉积具有一定影响[4-8]。笔者前期研究也发现,饲料中添加Pro和Hyp可以显著促进黄姑鱼胶原蛋白沉积[9-12]。但现有的研究大多数集中于胶原蛋白沉积的表型性状上,鲜有对胶原蛋白沉积机理的相关研究报道。在正常生理状态下,胶原蛋白沉积受到哪些信号通路的调控,以及其信号传递路径、关键节点和关键基因功能等也未知,使胶原蛋白的研究和生产受到一定限制。本研究结合胶原蛋白代谢及其调控的最新进展,综述了甘氨酸(Gly)、Pro和Hyp对胶原蛋白代谢的影响及其可能的分子机制,以期为胶原蛋白代谢的营养调控研究提供新的思路和方法。
1 胶原蛋白代谢
胶原蛋白是一簇具有三重螺旋结构且白色透明、无分支的原纤维细胞外基质蛋白,也是一组自然产生的在动物体内最丰富的蛋白质(约占哺乳动物总蛋白量的30%)[13]。胶原蛋白家族种类繁多,结构复杂,功能多样,主要存在于脊椎动物的肉和结缔组织中,是与各组织、器官功能有关的结构蛋白质,发挥着支撑器官、保护机体的功能[14]。近年来,胶原蛋白的结构和功能得到了广泛的研究,已明确其由3 条 α多肽链组成,在氨基酸残基的相互作用下,以同一轴为中心,以右手螺旋方式形成稳定的三股螺旋结构。每一条α多肽链都是左手螺旋构型,构成α多肽链的前胶原分子由1个短的非螺旋N端肽(氨基末端前肽)、1个三重肽组成的螺旋中心和1个短的非螺旋C端肽(羧基端前肽)组成[15]。胶原蛋白的功能与其三重螺旋结构密不可分,这种三重螺旋结构非常稳定,并且具有低免疫原性和良好的生物相容性,有抗氧化性和抗微生物活性,因能抗高血压,参与免疫调节、降脂,影响皮肤、骨骼和关节健康等而受到学者们的广泛关注[16-19]。胶原蛋白也常被用作生物活性材料,如细胞支架、生长因子、创面敷料、软组织增强剂、膳食补充剂等,在烧伤、眼角膜疾病、美容、矫形、硬组织修复、创面止血等医药卫生领域的应用也十分广泛[20-25]。
胶原蛋白的三重螺旋结构以三肽形式(Gly-Pro-Y和Gly-X-Hyp,其中X和Y可以是任意的氨基酸)重复构建,Gly、Pro和Hyp共占胶原蛋白总氨基酸的57%[5]。胶原蛋白的合成是在成纤维细胞中由氨基酸(主要是Gly和Pro)通过正常的细胞内蛋白合成途径形成的,包括氨基酸的活化,肽链形成起始、延伸、终止和翻译后修饰。这个肽链的起始过程发生在核糖体上,核糖体上新合成的胶原蛋白前导链被称为原胶原[26]。原胶原进入到粗面内质网(RER)中进一步修饰。修饰后的原胶原复合物进入高尔基体,用于进一步加工,产生大的电子致密团聚体。在高尔基体内,原胶原被包装成膜结合的囊泡,由成纤维细胞通过胞外分泌进入细胞外空间。在细胞外空间,前胶原的前肽(N端和C端氨基酸序列)在成熟过程中均被细胞外酶(原胶原肽酶)裂解,并通过赖氨酸(分子间键合)在2条三螺旋链之间形成交联,最后变成成熟的胶原蛋白[27]。图1展示了原胶原转化为成熟胶原蛋白的翻译后修饰过程。
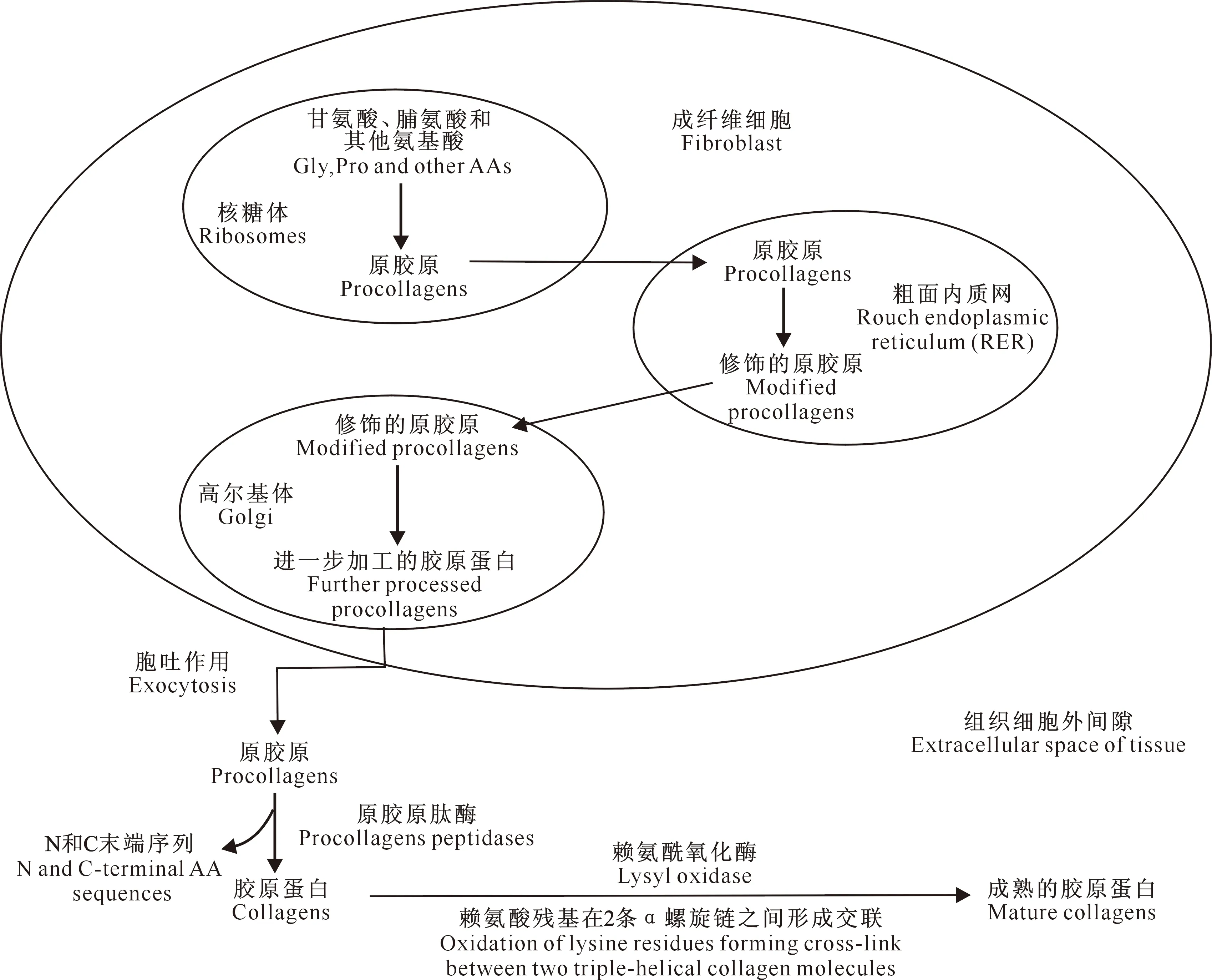
图1 原胶原蛋白翻译后的修饰过程Fig.1 Post-translational modification of procollagens
胶原蛋白的分解涉及体外降解和内源性生物降解两种降解过程。胶原蛋白的体外降解是胶原蛋白体外提取、分离、纯化等过程中操作不当所致,在实际生产中可以设法避免;胶原蛋白生物降解是由基质金属蛋白酶(MMPs)降解肽链开始的,当组织中检测到胶原碎片时,说明MMPs已开始降解胶原分子。MMPs是一类通过肽键水解蛋白质的蛋白酶,也是一种依赖锌的肽链内切酶,属于金属蛋白酶超家族成员。研究发现,通过促进金属蛋白酶组织抑制剂(TIMPs)表达可以抑制MMPs的活性,降低胶原蛋白降解,促进胶原蛋白沉积的增加,但过度抑制MMPs的活性却是病理状态下(肿瘤发生和转移)机体组织发生纤维化的主要原因,因此维持MMPs活化和抑制的良好平衡是生理(发育和组织修复)发生纤维化的重要组成部分[28]。
在正常生理状态下,胶原蛋白的合成和分解代谢时刻处于动态平衡中,两者相互促进和制约,共同维持机体健康。目前,关于胶原蛋白的代谢虽有少量报道研究,但都集中在医学中病理状态下组织过度纤维化过程(肿瘤)的研究方面[29-32],对机体正常生理发育中涉及的胶原蛋白代谢研究还处在初步阶段。
2 Gly、Pro和Hyp对胶原蛋白代谢的影响
胶原蛋白富含Gly、Pro和Hyp,特别是自然界中几乎无游离的Hyp存在,其只存在于胶原蛋白中,是胶原蛋白生物合成及形成稳定三重螺旋结构所必需的。鉴于此,近年来,关于Gly、Pro和Hyp与胶原蛋白代谢的关系引起学者的广泛关注,并通过胶原蛋白的营养干预试验,发现在饲料中添加Gly、Pro和Hyp对小鼠[33]、大鼠[34]、猪[35]、家禽[36]和许多鱼类[9-12,37]的生长和胶原蛋白沉积具有一定影响。
2.1 Gly和Pro对胶原蛋白代谢的影响
一般认为,Gly为哺乳动物(包括人类、猪和啮齿动物)和鱼类的“营养上不重要的氨基酸”,因为其在动物体内存在内源性合成途径,所以Gly未被考虑添加在动物的饮食配方中[38]。然而,越来越多的证据表明,动物内源性合成的Gly数量较为有限,如胆碱加苏氨酸合成的Gly占幼猪所需Gly的比例≤6%,饲粮中丝氨酸合成的Gly占总Gly合成的比例≤7%,尚无法满足包括蛋白质(特别是胶原蛋白)、谷胱甘肽和血红素的合成等在内的自身代谢需求[5,26]。Wang等[39]指出,虽然Gly轻度缺乏不足以对生存造成威胁,但长期缺乏可能导致生长不佳、胶原蛋白代谢异常、免疫反应受损等,对动物健康和营养代谢产生严重不利影响。和Gly一样,在传统上Pro也被认为是可有可无的氨基酸,因为所有动物都可以通过精氨酸酶、鸟氨酸氨基转移酶和吡咯啉-5-羧酸酯从精氨酸(Arg)合成Pro,但不同物种之间的合成速率差异很大(如哺乳动物>鸟类>鱼类)[40]。进一步的研究发现,Arg合成Pro的比率不足以满足动物最佳生长和结缔组织修复的需要[30,41-42]。
鉴于Gly和Pro都是胶原蛋白合成的底物,在胶原蛋白合成过程中至关重要,因此不少学者对Gly和Pro在胶原蛋白代谢中的作用展开了一系列研究。Li等[43]报道,植物源饲料中Gly含量低,Hyp含量少或无,Pro含量相对较低。Hou等[40]发现,典型的以玉米和大豆为基础的饮食最多只能为30日龄的仔猪生长提供所需的48% Gly和60% Pro。因此,在饲粮中添加胶原前体氨基酸,如质量分数1% Pro[41]和0.65% Gly[44],可以提高仔猪的质量和胶原产量。Ospina-Rojas等[45]研究报道,在17%的粗蛋白饮食中,补充质量分数0.3% Gly可以提高饲料效率,增加35日龄肉鸡的脂肪吸收、黏液分泌和胶原蛋白沉积;同样,以18%的粗蛋白为基础,补充质量分数0.2% Gly可以提高5~21日龄肉鸡的氮保有率,并促进骨骼肌生长和全身胶原蛋白沉积[46]。笔者前期在鱼类的研究中也发现了类似现象,Pro可以促进浅色黄姑鱼鱼鳔胶原蛋白的沉积,其促进作用呈现剂量效应,在粗蛋白含量47%的基础饲料中,添加 14.88 g/kg Pro对鱼鳔胶原沉积的促进效果最好[12]。综上所述,外源性添加Gly和Pro对动物机体胶原蛋白沉积具有一定的促进作用,并呈现出剂量效应,同时受到动物种类、生长阶段、日粮组成、环境等因素的共同影响。
2.2 Hyp对胶原蛋白代谢的影响
与Gly和Pro不同,Hyp不是合成胶原蛋白的底物,但其对维持胶原蛋白的三维螺旋结构是必需的,且能够增强胶原蛋白的热稳定性,并抑制蛋白质凝集和纤维化的发生[47]。20世纪初,研究者发现Pro是酪蛋白酸水解物的组成部分,之后发现,4-羟脯氨酸(4-羟基吡咯烷-2-羧酸,4-Hyp)是明胶酸水解产物,且4-Hyp也是胶原蛋白的主要组成成分[5]。20世纪60年代的研究表明,Hyp残基是由新合成的胶原蛋白中的Pro翻译后羟基化形成的[41]。这个羟化反应发生在胶原蛋白的粗面内质网上,主要依赖原酰4-羟化酶(prolyl 4-hydroxylase,P4H)或原酰3-羟化酶(prolyl 3-hydroxylase,P3H)在氧气、铁离子、维生素C和α酮戊二酸等的帮助下,分别生成4-Hyp或3-Hyp。4-Hyp和3-Hyp在基质金属蛋白酶(MMPs)降解细胞外成熟胶原蛋白过程中被释放,其中4-Hyp占主导,胶原蛋白中4-Hyp与3-Hyp的比值约为100∶1[5]。在整个胶原蛋白代谢过程中,从Pro生成Hyp需要消耗大量的能量,每生成1 mol Hyp要消耗6 mol ATP,其中4 mol ATP参与胶原蛋白合成,2 mol ATP用于胶原蛋白降解(图 2)。相比之下,通过肝脏尿素循环移除1 mol NH3只需要3.25 mol ATP,因此,通过胶原蛋白代谢产生Hyp被公认为高能源消耗途径[5,34]。

图2 Gly和Pro参与的胶原蛋白代谢过程(伴随能量代谢)Fig.2 Gly and Pro participation in collagen metabolism process (with energy metabolism)
由于Hyp内源性合成需要消耗巨大能量,因此直接在饮食中提供Hyp具有节约能量、促进动物生长及健康的作用。Hou等[48]报道,在膳食中添加适量的Hyp可以对动物的生长、肌肉结构和胶原蛋白含量产生影响。植物蛋白中Hyp含量极低,在以植物蛋白为基础的膳食中,添加质量分数0.28%的晶体Hyp,可以增加鲑鱼的质量和胶原蛋白沉积[49]。Liu等[37]报道,在膳食中添加Hyp可显著提高大菱鲆肌肉胶原含量。Zhang等[6]也认为,随着饮食中Hyp的增多,大菱鲆肌肉中的胶原蛋白总量显著增加。Kousoulaki等[50]研究Hyp在胶原蛋白代谢中的潜在作用时发现,膳食Hyp可显著增加胶原蛋白和交联浓度,改善动物组织硬度和肉质。笔者近期也对Hyp代谢开展了相关研究,发现饲料中添加Hyp可以显著促进黄姑鱼鱼鳔中的胶原蛋白沉积,在饲料干物质中粗蛋白质量分数为42%时,从鱼鳔总胶原蛋白含量中估算出的最佳膳食Hyp添加量为9.7 g/kg[9-10]。
综上所述,在饮食中提供适量的Gly、Pro和Hyp对动物的生长、健康及胶原蛋白代谢至关重要。Gly和Pro是胶原蛋白合成的必需底物,而Hyp是胶原蛋白合成后的羟基产物,但三者在促进胶原蛋白沉积过程的作用及其在细胞内的转运,以及是否作为信号分子调控胶原蛋白代谢等,都有待进一步深入研究。
3 Gly、Pro和Hyp影响胶原蛋白代谢的可能机制
蛋白质代谢归根结底是从基因转录开始的,一般来说,基因的转录活性又受到许多顺-反式调控元件和细胞因子构成的信号通路的调控。近年来,纤维发生信号通路引起了人们的广泛兴趣,有研究发现,胶原蛋白代谢受TGF-β/Smads、PI3K/Akt、MAPK、Wnt等信号通路的调控[51]。随着研究的深入,发现胶原蛋白代谢的调控通路错综复杂。
3.1 TGF-β/Smads信号通路
转化生长因子(TGF-β)/Smads信号通路是调控纤维发生的经典途径,主要参与细胞外基质(extracellular matrix,ECM)胶原蛋白的沉积[52-56]。TGF-β是一种能够调节多种类型细胞生长、分化和功能的多功能细胞因子,其对间充质细胞的主要作用是刺激ECM的沉积,TGF-β可诱导成肌成纤维细胞分化,增加Ⅰ、Ⅲ、Ⅵ、Ⅶ和Ⅹ型胶原的表达,导致ECM中胶原蛋白沉积[52]。TGF-β的活化及信号转导开始于配体二聚体与2个Ⅱ型TGF-β受体(TGF-βRⅡ)结合,然后募集2个Ⅰ型受体(TGF-βRⅠ)使之磷酸化,构成具有丝氨酸-苏氨酸激酶活性的异源复合物,随之激活下游信号传导途径。TGF-βRⅡ被认为是用来确定配体特异性的物质,若无TGF-βRⅡ的帮助,TGF-βRⅠ单独不能结合TGF-β,TGF-βRⅡ也不能单独传递信号,经激活后,TGF-βRⅠ对细胞内Smads转录因子表现出更高的激酶活性[57]。被激活的TGF-βRⅠ募集并磷酸化Smad2和Smad3,然后与Smad4缔合形成易位复合物进入细胞核;在细胞核中,易位的异源复合物通过其他转录因子(例如Sp1)与靶基因结合,并与CBP/p300协同促进基因表达。同时,由Smad7、Smurf、ERK和c-Ski/SnoN介导的负反馈系统抑制TGF-β信号转导,各类调节因子及正负反馈系统协同调节靶基因的转录(图 3)[31]。目前Smad存在8种亚型(Smad1~Smad8),其中Smad7是一种抑制型Smad,其表达由TGF-β1诱导,可干扰Smad2和Smad3的磷酸化,导致Smad2/3/4复合物不能顺利形成,从而抑制成纤维细胞中COL1A2启动子的活性,而当Smad7介导的对COL1A2启动子的抑制作用受损时,可能导致成纤维细胞胶原蛋白的异常生成[58-59]。
细胞因子通过与靶细胞上的特异性受体结合,激活一系列信号转导分子来完成信号转导的使命,通过相互作用、相互影响构成一个复杂的细胞因子网络,对网络上的特定因子进行干扰(抑制或激活)时,会导致整个网络发生一定的改变,从而影响机体功能及细胞的发育、分化和成熟。在对TGF-β/Smads信号通路的研究中发现,将各种干扰剂如积雪草皂苷(Asiaticoside)[53]、β-拉帕醌(β-Lapachone)[52]、α-硫辛酸(α-Lipoic acid)[60]等,作用于通路中特定配体后,整个信号通路效应发生变化,致使机体合成胶原蛋白的能力发生相应变化。其中,积雪草皂苷具有较强的伤口愈合能力,并能减少疤痕的形成(胶原的过度沉积),主要是因为积雪草皂苷降低了TGF-βRⅠ和TGF-βRⅡ的转录和翻译水平,增加了Smad7蛋白和mRNA的表达,而积雪草皂苷对Smad2、Smad3、Smad4的表达及Smad2和Smad3的磷酸化无影响[53];β-拉帕醌能刺激Ⅰ型胶原蛋白在人类皮肤成纤维细胞中的表达,促进基质胶原蛋白的合成和伤口愈合,其对胶原蛋白合成的促进作用主要通过激活TGF-βRⅠ激酶,并依赖Smad信号级联反应来实现[52];α-硫辛酸通过激活Smad信号促进人类真皮成纤维细胞Ⅰ型胶原的合成,它除了能够磷酸化Smad2和Smad3以外,还上调脯氨酸-4-羟化酶基因的表达,表明α-硫辛酸可以同时介导胶原蛋白翻译后修饰机制[60]。
笔者在研究Pro介导的胶原蛋白代谢可能涉及的信号通路时发现,在饲料中添加Pro可以促进黄姑鱼胶原蛋白沉积[11];通过qRT-PCR和聚类分析发现,Pro促进鱼鳔胶原蛋白合成可能依赖于TGF-β/Smads信号通路,且Smad2和TGF-βRⅠ起到关键作用[12]。用特异性干扰剂SIS3和Oxymatrine对TGF-β/Smads信号通路进行干扰后发现,SIS3和Oxymatrine抑制了Smad2的活性,最终Pro介导的胶原蛋白的合成显著减少[61],进一步阐明Pro促进胶原蛋白沉积与TGF-β/Smads信号通路有关,且Smad2等因子在其中起着关键作用。通过比较转录组分析、DEGs分析、KEGG通路富集分析结果发现,细胞外基质-受体相互作用(ECM-receptor interaction)、DNA复制(DNA replication)和细胞周期(cell cycle)等7个途径为Pro介导胶原蛋白代谢的潜在信号通路,而且结缔组织生长因子(CTGF)和组织抑制因子2(TIMP2)在其中扮演着重要角色[11]。
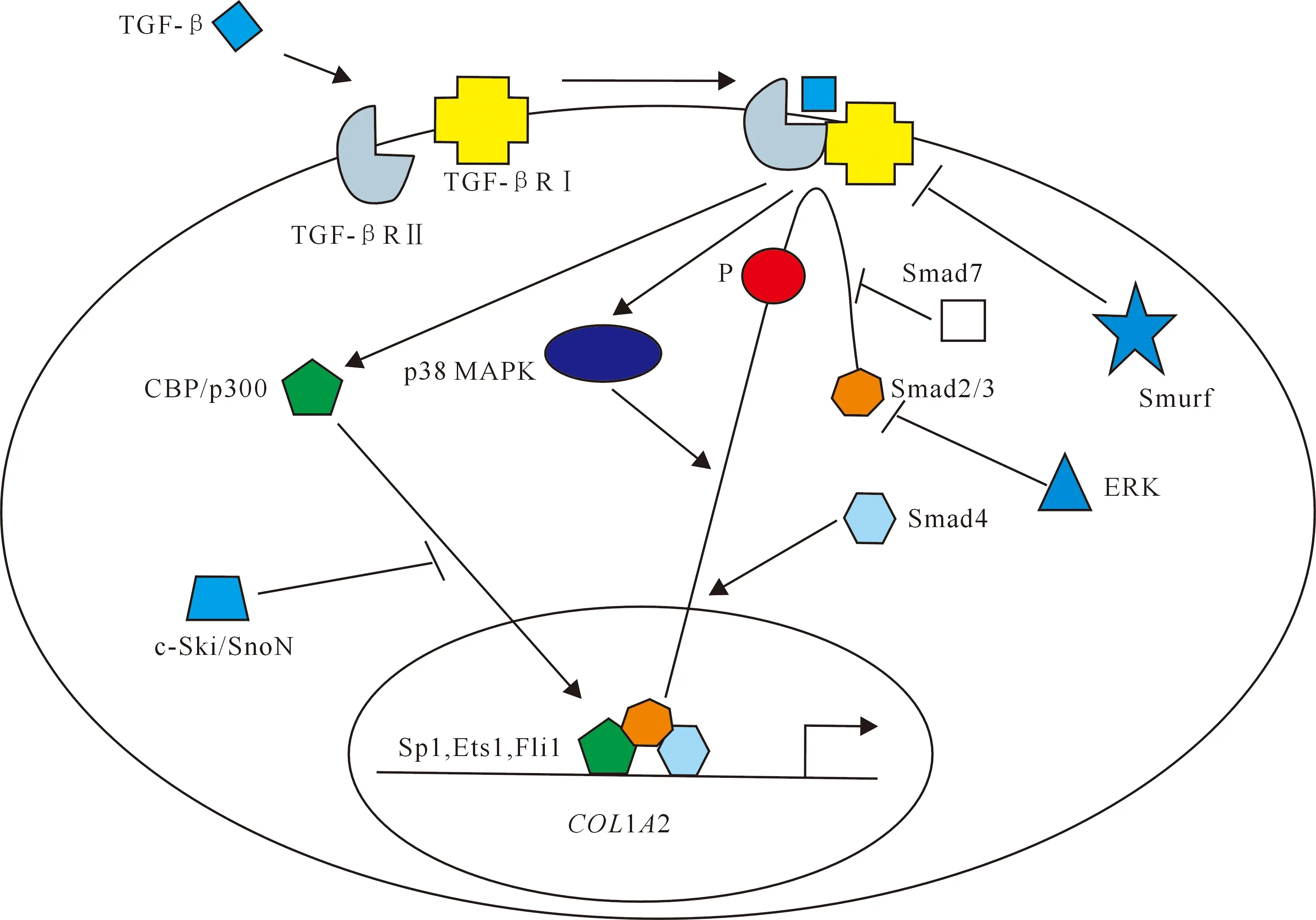
TGF-β.转化生长因子;TGF-βRⅠ.转化生长因子Ⅰ型受体;TGF-βRⅡ.转化生长因子Ⅱ型受体;CBP/p300.组蛋白乙酰转移酶中一种重要的大分子蛋白;MAPK.丝裂原活化蛋白激酶;Smad2/3/4/7.皮肤生长因子同系物蛋白2/3/4/7;Smurf.一种阻尼因子;ERK.细胞外信号调节激酶;c-Ski/SnoN.原癌基因家族成员;Sp1、Ets1、Fli1.Ⅰ型胶原蛋白启动子区细胞因子的结合位点;COL1A2.Ⅰ型胶原蛋白α2基因TGF-β.Transforming growth factor β;TGF-βRⅠ.Transforming growth factor β receptorⅠ;TGF-βRⅡ.Transforming growth factor β receptorⅡ;CBP/p300.An important macromolecular protein in histone acetyltransferase;MAPK.Mitogen activated protein kinases;Smad2/3/4/7.Mothers against decapentaplegic homolog 2/3/4/7;Smurf.A damping factor;ERK.Extracellular signal-regulated kinase;c-Ski/SnoN.Ski-related novel gene;Sp1,Ets1,Fli1.Binding sites of cytokines in the promoter region of collagen typeⅠ;COL1A2.Collagen,typeⅠ,alpha 2 gene图3 TGF-β信号级联示意图Fig.3 Schematic representation of TGF-β signaling cascade
3.2 其他信号通路
在组织纤维化的发生中,经典的TGF-β/Smads通路并不是唯一的信号传递途径,且TGF-β的胞内信号传递在不同细胞中启用不同信号通路。TGF-β下游的信号传导分子,除了经典的Smad2/3之外,还存在其他一些非Smad通路,如MAPK通路、AKT/PIK3通路[51]等。在哺乳动物中研究发现,雷帕霉素信号通路(mammalian target of rapamycin,mTOR)可以通过URI(unconventional prefold in PRB5 interactor)对一些与细胞生长相关的重要基因的转录进行调控,其中包括TGF-βⅠ基因[62]。mTOR通路为经典的氨基酸信号感应转导通路,介导了氨基酸调控基因表达及蛋白质合成,例如支链氨基酸能够通过中性氨基酸转运体(sodium-coupled neutral amino acid transporter2,SNAT2)决定胞内氨基酸浓度并诱导mTORC1信号通路对蛋白质合成进行调控[63]。目前越来越多研究表明,氨基酸转运载体/受体在mTOR通路响应氨基酸信号过程中起重要作用[64]。质子辅助氨基酸转运体(proton-asisted amino acid transporter,PAT)是重要的氨基酸转运载体,如PAT1和PAT4是介导氨基酸感应与mTORC1活化的调节子[65]。笔者近期研究也发现,在饲料中添加Hyp和Pro可上调黄姑鱼肌肉组织中mTOR通路相关基因表达,促进机体生长,并伴随胶原蛋白沉积的增加[66-67],由此推测mTOR和TGF-β/Smads通路在氨基酸促进胶原蛋白代谢过程中必定存在某种关联。众所周知,在机体细胞的生命活动中,各细胞之间依靠多种细胞因子来传导信息,如基质原胶原分泌细胞的活化可以通过血小板、单核细胞、T淋巴细胞或成纤维细胞浸润产生的各种细胞因子来调节, 包括TGF-β、CTGF、IL-1/IL-6、PDGF、EGF和TNF-a在内的多种细胞因子等[68-70]。综上表明,调控胶原蛋白代谢的信号传导通路错综复杂,针对不同的细胞类型、不同的作用方式等,信号通路之间的互作可以表现出不同的效果。
4 展 望
氨基酸作为蛋白质合成的前体分子,在胶原蛋白代谢过程中起着至关重要的作用,Gly、Pro和Hyp能够显著促进胶原蛋白的沉积,且TGF-β/Smads信号通路在Gly、Pro和Hyp介导的胶原蛋白代谢过程中发挥着重要作用。但在细胞感受氨基酸信号并传递到COL1A2的过程中,TGF-β/Smads信号通路可能不是唯一的介导氨基酸促进胶原蛋白代谢的调控通路,还有其他通路参与,如参与氨基酸信号感应转导的mTOR通路,然而目前尚无直接证据证明mTOR通路参与了胶原蛋白代谢的调控。因此,氨基酸转运载体/受体在氨基酸促进胶原蛋白沉积过程中的作用,以及mTOR与TGF-β/Smads通路之间的关联等问题都值得进一步研究。另外,胶原蛋白代谢受到多个信号通路的共同调控,深入探讨各通路之间的互作,筛选通路中关键基因并验证其功能将成为后续研究的重点。
