昆明裂腹鱼溃疡病病原菌分离鉴定及药物敏感性
2021-11-18张桓桥商宝娣周贤君张效平李小义
张桓桥,商宝娣,赵 凤,周贤君,张效平,李小义,孔 杰,杨 星,陶 莎
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省水产研究所,贵阳 550025;3.贵州省特种水产工程技术中心,贵阳 550025;4.贵阳市水产技术推广站,贵阳 550025)
昆明裂腹鱼(Schizothoraxgrahami)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)裂腹鱼属(Schizothorax),是我国特有的高原鱼类,仅分布于西南地区,在贵州主要分布于金沙江下游干支流、乌江上游和南、北盘江之上游支流中[1]。昆明裂腹鱼肉质鲜美、营养丰富,为高档食用鱼,是贵州省重要的经济土著鱼类之一[2,3]。水利工程建设以及自然栖息生境破坏导致野生昆明裂腹鱼种群数量受到严重影响,2015年昆明裂腹鱼被《中国脊椎动物红色名录》列为濒危物种(endangered,EN)[4]。近年来,贵州省不断加大对昆明裂腹鱼开发利用的研究,主要集中在分子遗传、人工繁殖和胚胎及幼鱼发育等方面[5-8],目前已实现全人工繁殖技术的突破,并在毕节市、贵阳市、安顺市与铜仁市等多地进行推广养殖,取得了明显的经济、社会、生态效益。
然而随着昆明裂腹鱼养殖规模的扩大、养殖水体环境的恶化与病原微生物的滋生传播,昆明裂腹鱼疾病频发给经济造成了巨大损失。2012年起,流行病学调查发现毕节、江口等地多个养殖场流水养殖的昆明裂腹鱼背鳍前后出现皮肤破裂、肌肉溃烂,根据其发病特征,称为“溃疡病”。患病鱼主要症状为游动无力、食欲减弱且反应迟钝;头部、背鳍部出现灰白色斑块后发生溃烂,溃烂部位均较深甚至至腔;剖检后发现肝脏发白或发黄,胆囊透亮,肠道无内容物等。该疾病一年四季持续发生,感染率可达90%,虽然死亡率不高,但是由于病鱼体表损伤严重,病程较长,难治愈,成为昆明裂腹鱼养殖推广中的一大瓶颈。
本研究于2020年9月,自患病昆明裂腹鱼体表溃烂处、肝脏与肾脏均分离获得形态大小一致的菌落,随机选取肾脏分离细菌(BL61C)作为试验菌。采用形态学观察、生理生化特性鉴定及16S rDNA、dnaJ、cpn60等基因的序列分析进行病原鉴定,通过回归感染确定其致病性,以K-B纸片扩散法进行药敏试验测定该菌药物敏感性,以期为昆明裂腹鱼的溃疡病诊断及临床治疗提供基础资料。
1 材料与方法
1.1 试验鱼及药品
患病昆明裂腹鱼取自贵州省毕节市某养殖场,体重(256.3±58.02)g,发病水温(16±2)℃。回归感染试验所用昆明裂腹鱼购于毕节市另一未发病养殖场,试验用鱼体色正常、体表无损伤、活力较好,平均体重(250±10)g,暂养7 d后用于试验。LB固体培养基、LB液体培养基、MH固体培养基、生理生化鉴定管及药敏纸片购自杭州微生物试剂有限公司;PCR相关制品购自Takara生物技术有限公司;引物合成和DNA测序于上海生工生物工程股份有限公司进行。
1.2 细菌分离
取具典型特征患病鱼,75%酒精擦拭病鱼体表后,在无菌条件下,自病鱼体表溃烂处、肝脏与肾脏划取部分组织,在LB固体培养基上划线接种,置于28 ℃生化培养箱中过夜培养。观察菌落生长情况,挑取形态特征一致的菌落进行纯化培养。选取纯化后的单克隆菌落转接至LB液体培养基中,在28℃生物摇床中振荡过夜后,于-80℃保存备用。
1.3 细菌的形态学观察及生理生化鉴定
纯化菌株划线接种于LB平板上,28℃过夜培养,观察菌落的生长特性和菌落形态。参照《常见细菌系统鉴定手册》[9],采用细菌微量生化鉴定管对待测菌株进行各项生化指标的测定。
1.4 16S rDNA、dnaJ、cpn60基因序列测定及系统发育分析
1.4.1 基因的PCR扩增
将纯化菌株BL61C接种于LB液体培养基中,28 ℃、180 r/min过夜培养,经4 000 r/min、5 min离心集菌。在收集到的菌体中加入10 μL ddH2O使其重新悬浮,经99 ℃裂解后离心,取上清作为PCR模板。应用细菌16S rDNA基因通用引物进行PCR扩增,扩增条件为:94℃,5 min;94℃,45 s;55℃,45 s;72℃,90 s;35个循环;72℃再延伸10 min。参照李伟杰等[10]方法进行dnaJ、cpn60基因的扩增,扩增条件均为94℃,3 min;94℃,30 s、55℃,30 s;72℃,1 min;35个循环;72℃,7 min。各基因扩增所用引物序列见表1。

表1 PCR引物序列Tab.1 PCR primers
1.4.2 序列分析
PCR产物经1.0%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序,测序结果利用SeqMan、BioEdit等分析软件拼接整理。结果上传至NCBI网站进行BLATS检索,选取与目的基因同源性较高的基因,利用MEGA5.05分析软件中的邻接法(Neighbor-Joining,NJ)构建系统发育树,系统树各分支的置信度由Bootstrap1 000次循环检验。
1.5 回归感染试验
将纯化菌株BL61C接种于LB液体培养基中,28 ℃、180 r/min过夜培养。培养好的菌液经4 000 r/min、10 min离心集菌,菌体以无菌PBS缓冲液漂洗三次并重悬,据麦氏比浊法调节菌悬液浓度分别为1.0×105、1.0×106、1.0×107、1.0×108和1.0×109CFU/mL。将暂养7 d后的健康昆明裂腹鱼随机分为6组,每组10尾,每尾腹腔注射对应浓度菌悬液200 μL,阴性对照组注射200 μL 无菌PBS缓冲液,每组3个重复。将回归感染后的鱼置于水族箱(长600 mm×宽350 mm×高200 mm)中养殖,水温保持在(16±2)℃,溶解氧保持在(6.5±1) mg/L,2 d换水一次且每次不超过原体积的1/3,不投喂饵料,试验周期为10 d。每24 h观察记录一次鱼的发病症状和死亡情况,并对刚死亡的试验鱼进行细菌分离鉴定。通过SPSS 23.0软件计算半数致死浓度(LC50)。
1.6 药物敏感试验
选取15类43种常用抗生素,采用纸片扩散法(K-B法)测定菌株BL61C的药物敏感性。将纯化菌株BL61C接种于LB液体培养基中,28 ℃、180 r/min过夜培养后,调整菌悬液浓度为1.0×107CFU/mL,取400 μL菌液均匀涂布于MH培养基中,重复三次。待菌液吸收后,用镊子将待测药敏纸片贴于培养基表面,于28 ℃培养24 h后,测量抑菌圈直径(结果保留一位小数),据产品说明书判定药敏结果。
2 结果
2.1 患病昆明裂腹鱼症状及分离菌形态
观察发现,病鱼头部、背鳍基部出现溃烂,溃烂部位均较深(图1);剖检后发现肝脏发白或发黄,胆囊透亮,肠道无内容物。在无菌条件下自体表溃烂处、肝脏与肾脏处分离病原菌,在LB固体培养基上28 ℃培养24 h。分离菌株菌落形态大小一致,为表面光滑、边缘整齐、中央隆起的直径约1~2 mm的灰白色圆形菌落。从各组织分离菌中随机挑取10株菌落进行纯化培养,纯化培养后菌落形态大小也基本一致。随机选取从肾脏分离的细菌作为试验菌,编号为BL61C。
2.2 细菌生理生化鉴定
分离菌株BL61C的主要理化特性为具有动力性,β-半乳糖苷酶、葡磷胨水、枸橼酸盐与葡萄糖发酵阳性;不发酵木糖、鼠李糖、山梨醇等;硫化氢、尿素阴性(表2)。初步确定分离菌株BL61C为维氏气单胞菌。
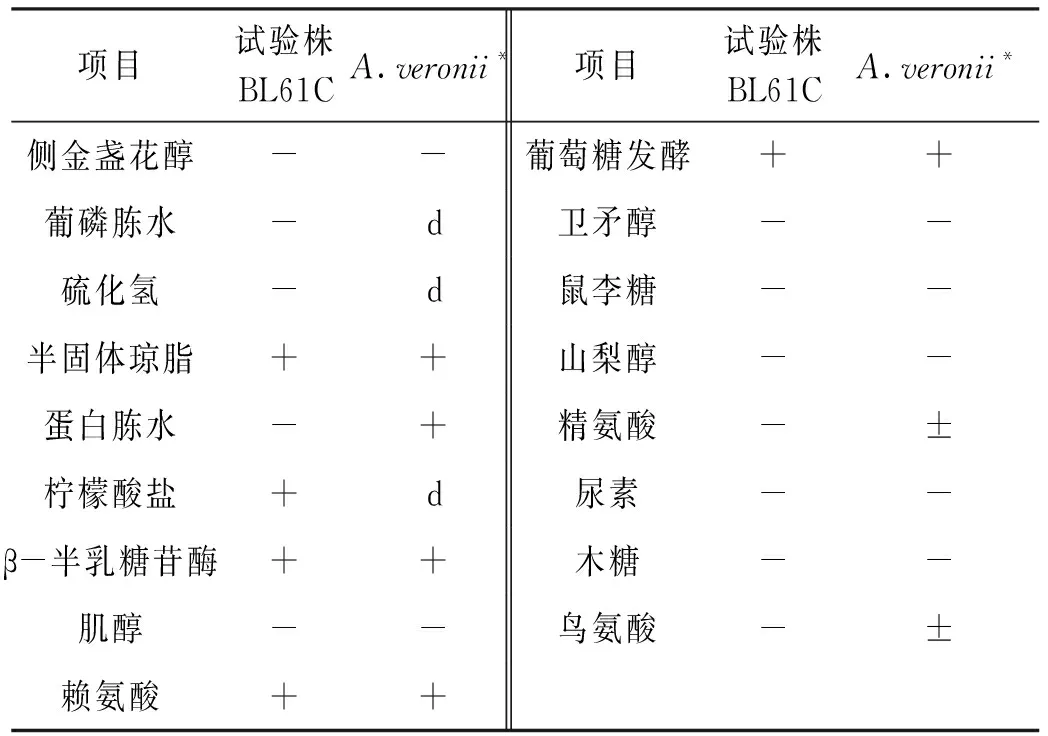
表2 菌株BL61C的生理生化特性鉴定结果Tab.2 Identification results of biochemical characteristics of strain BL61C
2.3 分子鉴定
扩增得到菌株BL61C的16S rDNA、dnaJ、cpn60序列长度分别为1 401 bp、883 bp和700 bp,目的序列提交GenBank核酸序列数据库,获得登录号分别为MW517563、MW541161、MW541162。将目的序列在NCBI数据库中进行BLAST比对,取与目的序列同源性较高的序列通过MEGA5.05邻接法(Neighbor-joining,NJ)建立系统发育树,结果均显示菌株BL61C与A.veronii聚为一支(图2-4),由Bootstrap1 000给出的置信度分别为100、92和92,基本确定菌株BL61C为A.veronii。
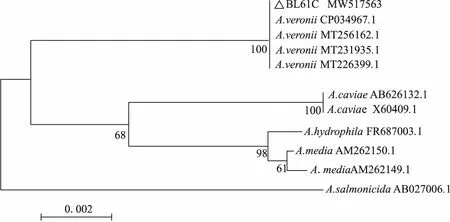
图2 菌株BL61C基于16S rDNA序列的NJ系统发育树Fig.2 NJ phylogenetic tree of BL61C based on 16S rDNA sequences

图3 菌株BL61C基于dnaJ序列的NJ系统发育树Fig.3 NJ phylogenetic tree of BL61C based on dnaJ sequences
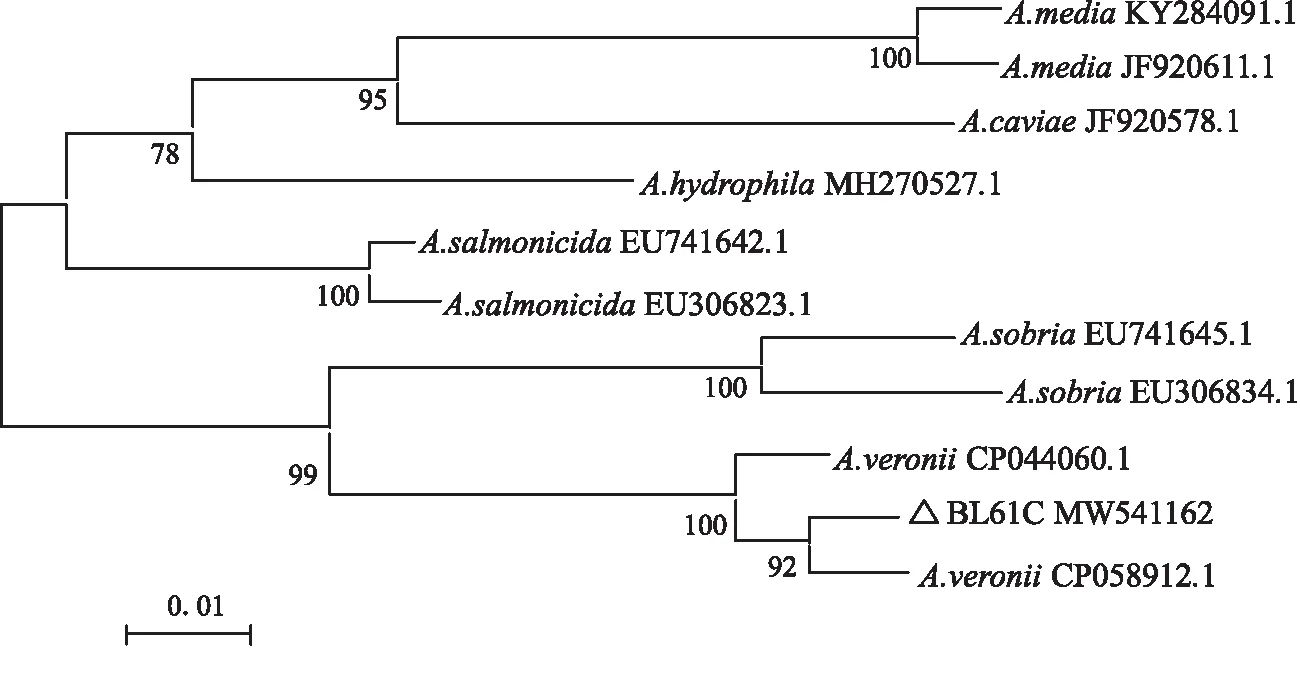
图4 菌株BL61C基于cpn60序列的NJ系统发育树Fig.4 NJ phylogenetic tree of BL61C based on cpn60 sequences
2.4 回归感染试验
以不同浓度的菌悬液回归感染健康昆明裂腹鱼后,除阴性对照组以外,各分组呈现不同程度的死亡情况。按菌悬液浓度从高到低,1.0×109CFU/mL浓度组注射第12 h产生死亡,5 d累计死亡率达100%;其余4组10 d累计死亡率分别为76.67%、46.67%、33.33%、10.00%(表3);经计算获得菌株BL61C对昆明裂腹鱼的LC50值为5.09×107CFU/mL。除急性死亡试验鱼以外,其余试验鱼在感染后可见游动缓慢;1 d时试验鱼后背鳍基部前后出现灰白色斑块,有溃烂前兆;2 d后试验鱼灰白色斑块发生破裂,出现溃疡;临床症状与自然病例相似。对回归感染后患病昆明裂腹鱼进行病原菌的再分离,经16S rDNA鉴定发现,再分离菌与回归感染菌属同种细菌,证实菌株BL61C为昆明裂腹鱼溃疡病的致病菌。

表3 菌株BL61C回感试验结果Tab.3 Artificial infection test of BL61C
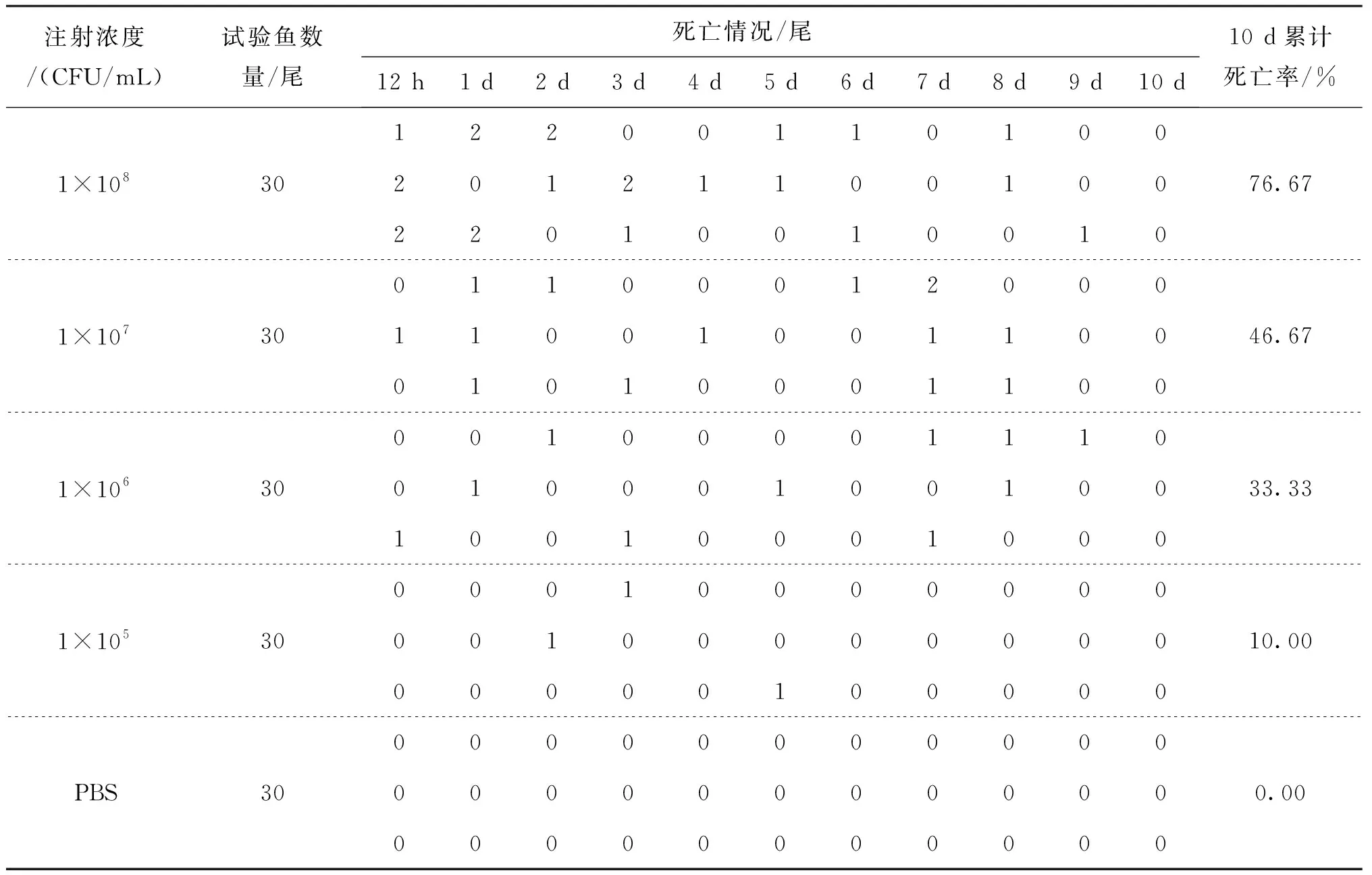
续表3
2.5 药敏试验
菌株BL61C药物敏感性见表4。结果显示该菌对大观霉素、阿奇霉素、氧氟沙星、氯霉素、氟苯尼考、头孢他啶、头孢克肟和头孢噻肟8种药物敏感;对庆大霉素、链霉素、妥布霉素、新霉素、卡那霉素、丁胺卡那、红霉素、诺氟沙星、恩诺沙星、环丙沙星、头孢噻吩、头孢哌酮、复方新诺明、甲氧苄胺嘧啶与克林霉素15种药物中敏;对克拉霉素、制霉菌素、四环素20种药物耐药。对氨基糖苷类、喹诺酮类与酰胺醇类3类药物均表现为中敏或敏感;对四环素类、糖肽类、香豆素类等7类均耐药。

表4 分离株药物敏感性结果Tab.4 The results of drug sensitivity of isolates

续表4
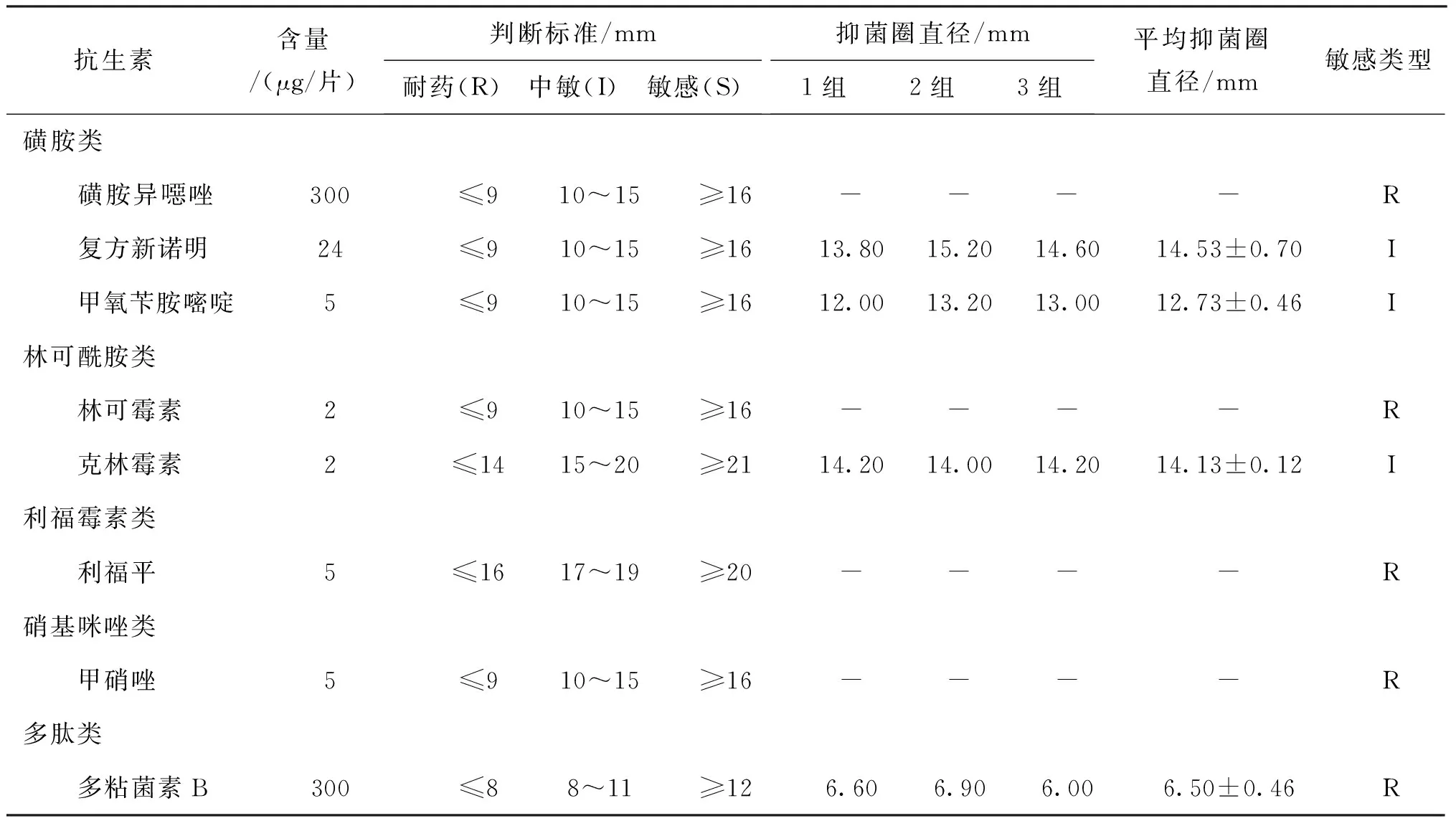
续表4
3 讨论
3.1 维氏气单胞菌的致病性
维氏气单胞菌(Aeromonasveronii)隶属于弧菌科(Vibronaceae)气单胞菌属(Aeromonas),亦被称为维罗纳气单胞菌、凡隆气单胞菌和维隆气单胞菌,广泛分布于自然界的土壤和水体中。维氏气单胞菌感染力极强,可感染达氏鲟(Acipenserdabryanus)[11]、斑点叉尾鮰(Ictaluruspunetaus)[12]、中华绒螯蟹(Eriocheirsinensis)[13]、大刺鳅(Mastacembelusarmatus)[14]、克氏原螯虾(Procambarusclarkii)[15]等多种重要的水产经济动物。水产动物感染维氏气单胞菌常表现出行动缓慢、摄食减少、体表溃烂、表皮出血且剖检后可见腹腔积水、内脏出血或肝脏肿大与肠道炎症等症状,严重时甚至造成死亡[16-18]。昆明裂腹鱼感染维氏气单胞菌后的症状以体表溃烂为主,与感染虹鳟(Oncorhynchusmykiss)[19]、大口黑鲈(Micropterussalmoides)[20]后症状相似,但发病条件不同,这可能与环境因子、宿主抵抗力、菌株毒力等因素存在联系,其流行规律与致病机理还有待进一步研究。
3.2 维氏气单胞菌的药物敏感性
在水产养殖过程中,为减少病害造成的损失抗生素被大量使用,但抗生素的误用以及滥用容易诱导产生一系列携带抗生素抗性基因的耐药菌株增加防治难度,同时药物残留等问题也给人类的公共卫生安全造成严重威胁,探究病原菌的药物敏感性对有效使用抗生素具有重要意义[21-22]。维氏气单胞菌的药物敏感性已有较多研究报道,不同地域、不同品种因养殖模式、用药习惯等的不同药敏结果不尽相同[23-27]。本研究用15类43种抗生素对贵州省毕节市某养殖场昆明裂腹鱼源维氏气单胞菌进行体外抑菌试验,结果表明分离菌对大观霉素、阿奇霉素、氧氟沙星、氯霉素、氟苯尼考、头孢他啶、头孢克肟、头孢噻肟8种药物敏感;对庆大霉素、链霉素、妥布霉素等15种药物中敏;对克拉霉素、制霉菌素、四环素等20种药物耐药,与其他研究分离的维氏气单胞菌药物敏感性均存在一定差异。因此,在水产动物病害防治中不能依据经验主观地选择治疗药物,而应根据药敏试验结果科学、合理地用药。
