多指标正交试验法优选红参水提工艺研究
2021-11-18陈丹燕余欣彤彭帮贵王瑜婷陈江平
陈丹燕,余欣彤,彭帮贵,王瑜婷,汪 梅,陈江平,魏 梅
(广东一方制药有限公司 广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
红参为五加科植物人参PanaxginsengC.A.Mey.的栽培品经蒸制后的干燥根和根茎[1],始载于《本草纲目》[2]。具有大补元气、复脉固脱、益气摄血的功效,用于体虚欲脱、肢冷脉微、气不摄血、崩漏下血等症[1]。红参的主要产区为辽宁抚顺、吉林靖宇、吉林集安等[3],化学成分主要有皂苷类、多糖类、生物碱类、多炔类、萜烯类等,其中皂苷类成分为主要活性物质[4]。现代研究表明,人参皂苷Rg1、Re、Rb1具有良好的抗氧化、抗肿瘤、抗衰老等药用效果[5-6],2020版《中国药典》亦将人参皂苷Rg1、Re、Rb1的含量限度作为红参的质量控制指标。
有文献[7-9]报道红参中人参皂苷的提取工艺研究,但其工艺以乙醇回流为主,研究内容多以红参药材化学成分和质量控制为主,未见多指标综合评价红参水提工艺的报道。本研究以水为提取溶剂,以浸泡时间、提取次数、提取时间和加水量为影响因素设计L9(34)正交试验,结合归一化法对人参皂苷Rg1、Rb1、Re含量和干膏得率进行数据处理,确定干膏得率,人参皂苷Rg1、Rb1、Re含量的权重系数分别为0.4、0.2、0.2、0.2,计算综合评分,优选出最佳水提工艺,为红参传统制剂产品的工业化生产提供参考。
1 仪器与试药
1.1 仪器
Waters Arc型高效液相色谱仪(美国Waters公司);ME204E型万分之一天平,XP26型百万分之一天平(瑞士梅特勒-托利多公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);Milli-Q Direct型超纯水系统(德国Merck公司);RE-3000型旋转蒸发器(上海亚荣生化仪器厂);SHZ-D(Ш)型循环水式真空泵(巩义市予华仪器有限责任公司);HWS-28型电热恒温水浴锅(上海一恒科学仪器有限公司);DHG-9146A型电热恒温鼓风干燥箱(上海精宏试验设备有限公司)。
1.2 试药
人参皂苷Rg1(批号为110703-201933,纯度为93.4%),人参皂苷Rb1(批号为110704-202028,纯度为93.1%),人参皂苷Re(批号为110754-201827,纯度为93.4%),均购自中国食品药品检定研究院。乙腈、甲醇为色谱纯(德国Merck公司),水为超纯水,其余试剂均为分析纯。红参药材(批号为G2006008)产地为吉林,经广东一方制药有限公司魏梅主任药师鉴定为五加科植物人参PanaxginsengC.A.Mey.的栽培品经蒸制后的干燥根和根茎,样品存放于广东一方制药有限公司。
2 方法与结果
2.1 浸膏粉制备
取红参饮片12份,每份约100 g,按正交试验设计进行回流提取,滤过,分别合并每组试验的水提液,取水提液减压浓缩至适量,浓缩液置于真空干燥箱内烘干,研细,得红参浸膏粉,称定重量,备用。
2.2 干膏得率测定
精密吸取红参水提液25 mL,置已干燥至恒重的蒸发皿中,水浴蒸干,并转移至105 ℃烘箱干燥3 h,取出,置干燥器中冷却30 min,称定重量,计算干膏得率=(M1-M0)V/25m,M1为干膏与蒸发皿总质量,M0为空蒸发皿总质量,V为水提液总体积,m为提取饮片质量。
2.3 人参皂苷Rg1、Rb1、Re含量测定
2.3.1 色谱条件[10]色谱柱:Agilent ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱,0~35 min时19% A,35~55 min时19% A→29% A,55~70 min时29% A,70~100 min时29% A→40% A;检测波长:203 nm;柱温:30 ℃;流速:0.8 mL/min;柱温:30 ℃;进样量:10 μL。
2.3.2 对照品溶液制备 取人参皂苷Rg1对照品、人参皂苷Re对照品及人参皂苷Rb1对照品适量,精密称定,置25 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,配制成含人参皂苷Rg1405.430 7 μg/mL、人参皂苷Re 310.685 8 μg/mL、人参皂苷Rb1404.985 0 μg/mL的混合对照品贮备液。
2.3.3 供试品溶液制备 取浸膏粉约1 g,精密称定,置索氏提取器中,加三氯甲烷适量,加热回流1 h。药渣挥干溶剂,将药渣连同滤纸筒一起转移到具塞锥形瓶中,精密加入水饱和正丁醇50 mL,密塞,放置过夜,称定重量,超声处理(功率250 W,频率50 kHz)30 min,放冷,再称定重量,用水饱和正丁醇补足重量,摇匀,滤过。精密吸取续滤液25 mL,置蒸发皿中蒸干,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.3.4 专属性考察 分别精密吸取“2.3.2”项下混合对照品溶液和供试品溶液、空白溶剂适量,按“2.3.1”项下色谱条件进样测定。如图1所示空白溶剂色谱图中,在人参皂苷Rg1、Re、Rb1的出峰位置无吸收峰;供试品溶液色谱中,在与对照品溶液色谱相同保留时间处有相应色谱峰,表明该方法专属性良好。

1.人参皂苷Rg1;2.人参皂苷Re;3.人参皂苷Rb1;A.空白溶剂;B.混合对照品溶液;C.供试品溶液。
2.3.5 线性考察 分别精密吸取“2.3.2”项下对照品储备液0.5 mL、1.0 mL、1.5 mL、3.0 mL、5.0 mL、10.0 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,配制成不同质量浓度的混合对照品溶液。按“2.3.1”项下色谱条件进样测定,记录人参皂苷Rg1、Re、Rb1的峰面积,以溶液质量浓度(X)为横坐标,峰面积(Y)为纵坐标进行线性回归,绘制标准曲线。结果见表1。

表1 线性关系考察结果
2.3.6 精密度考察 精密吸取“2.3.2”项下混合对照品溶液,按“2.3.1”项下色谱条件连续进样6次,计算人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1峰面积的RSD分别为0.99%、0.97%%、0.83%(n=6),表明仪器精密度良好。
2.3.7 重复性考察 取同一浸膏粉适量,按“2.3.2”项下方法平行制备6份供试品溶液,按“2.3.1”项下色谱条件进样测定,计算人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1峰面积的RSD分别为2.88%、3.65%%、2.52%(n=6),表明该方法重复性良好。
2.3.8 稳定性考察 取同一浸膏粉适量,按“2.3.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件于制备0 h、2 h、4 h、8 h、12 h、24 h后进样测定,计算人参皂苷Rb1、人参皂苷Re、人参皂苷Rg1峰面积的RSD分别为2.47%、2.50%、2.93%(n=6),表明供试品溶液在24 h内有较好的稳定性。
2.3.9 加样回收率试验 取同一干浸膏粉适量,精密称取9份,每份约0.5 g,分为3组,每组分别按高、中、低浓度精密加入人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1混合对照品溶液。按“2.3.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件进样测定,记录峰面积,计算加样回收率及RSD值。结果人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的平均加样回收率为100.79%、96.90%、105.13%,RSD分别为2.20%、2.52%、1.38%(n=9)。结果见表2。

表2 加样回收试验结果 (n=9)
2.4 正交试验
2.4.1 因素水平设计 根据前期预试验和相关文献可知,提取工艺效果一般受到溶媒类型、溶媒用量、提取时间、提取次数、浸泡时间等因素影响[11-12]。因此,以浸泡时间(A)、加水倍数(B)、提取时间(C)和提取次数(D)为影响因素,按L9(34)正交试验法进行实验,以干膏得率、人参皂苷Rg1含量、人参皂苷Re含量、人参皂苷Rb1含量为评价指标,优选红参的水提工艺。因素水平表见表3。

表3 正交试验因素与水平
2.4.2 数据处理 按正交试验设计,测定各试验组干膏得率、人参皂苷Rg1含量、人参皂苷Rb1含量、人参皂苷Re含量,采用Hassan法[13],将每个指标进行归一化处理,标准化为0~1之间的“归一值”,归一化公式如下:对于取值越大越好的指标,归一值计算公式为:di=(Yi-Ymin)/(Ymax-Ymin);对于取值越小越好的指标,归一值计算公式为:di=(Ymax-Yi)/(Ymax-Ymin)。对各指标归一化值给予不同的权重系数,干膏得率作为主指标,权重系数为0.4,人参皂苷Rg1含量、人参皂苷Rb1含量和人参皂苷Re含量为次指标,权重系数分别为0.2。综合评分值(Pj)按以下计算公式计算,综合评分值(Pj)=0.4×干膏得率+0.2×人参皂苷Rg1含量+0.2×人参皂苷Rb1含量+0.2×人参皂苷Re含量。以综合评分值对试验数据进行直观分析和方差分析,试验结果见表4、表5。

表4 正交试验结果及直观分析结果

表5 方差分析结果
2.4.3 结果分析 以综合评分值为标准,由表5可知,影响红参水提工艺的主次顺序为D(提取次数)>C(提取时间)>A(浸泡时间)>B(加水倍数),以极差最小的B因素为误差列,对各因素进行方差分析。提取次数对试验结果具有显著性影响(P<0.05),浸泡时间、加水倍数、提取时间对试验结果没有显著性影响(P>0.05)。主要影响因素D选择最佳的水平。从离差平方和可知,浸泡时间、加水倍数对试验结果的贡献率较低。从降低生产成本和提高生产效率两方面考虑,确定红参最佳水提工艺为A1B1C1D3,即加8倍量水,浸泡30 min,提取3次,每次0.5 h。
2.5 验证试验
根据优选出来的红参水提工艺参数A1B1C1D3,称取3份红参饮片,每份约100 g,进行3份平行验证试验,结果见表6。结果表明,验证试验的干膏得率、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1含量的均值分别为56.47%、0.197 7%、0.104 5%、0.202 5%,RSD分别为1.92%、1.63%、2.01%、1.05%。各指标的提取效果均较好,优选的红参水提工艺稳定、简单、可行。
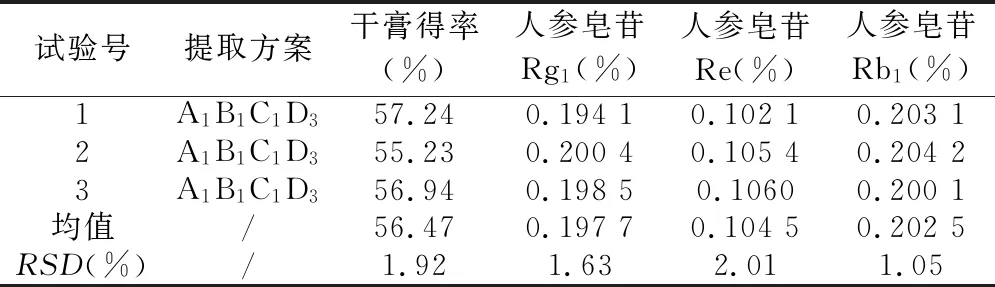
表6 验证试验结果 (n=3)
3 讨论
中药含有多种化学成分,具有多组分、多靶点、多环节的特点,不同功效有其不同的物质基础,单独一个药效成分并不能代表该味中药的整体疗效[14]。综合评分法运用数学知识对一个复杂系统中的多个评价指标信息进行加工处理,从而对其优劣程度进行评价[15]。本研究采用的多指标综合评分方法为加权评分法,根据评价指标对试验结果的影响程度赋予不同的权重系数,既保证了试验结果的全面性,又对重要的评价指标有相应的侧重,使得试验结果更加科学。为了更好地优选红参的水提工艺,选取干膏得率和人参皂苷Rg1、Re、Rb1含量作为评价指标,使得试验结果更加科学全面。文献[16]研究表明,红参中还含有挥发油、多糖类等化学成分,本研究将人参皂苷Rg1、Re、Rb1含量作为优选红参水提工艺的评价指标稍显不足。在后续试验中,将对红参的挥发油类、多糖类化学成分进行研究,充分结合红参的化学成分来优化其水提工艺。
