感染相关肝功能障碍预测模型的建立和评价
2021-11-17王帅刘华敏辛兆瑞王万腾王芸芸孙运波
王帅 刘华敏 辛兆瑞 王万腾 王芸芸 孙运波

[摘要] 目的 通过数据分析,建立感染相关肝功能障碍的预测模型,并对模型进行评价。
方法 回顾性分析青岛大学附属医院重症医学科收治的302例感染病人的临床资料,按照是否发生肝功能障碍,将病人分为无肝损害组和肝损害组。对与肝功能障碍发生相关的危险因素进行Logistic回归分析后,建立感染相关肝功能障碍的预测模型,绘制联合预测因子和其他危险因素的受试者工作特征曲线(ROC曲线)进行评价。
结果 经过Logistic回归分析后得到4个与肝功能障碍发生相关的危险因素:急性生理与慢性健康状况评估Ⅱ(APACHE Ⅱ)评分、乳酸、C反应蛋白以及长期饮酒史。建立的感染相关肝功能障碍预测模型为:L=长期饮酒史+0.220 APACHE Ⅱ评分+0.011 C反应蛋白+2.707乳酸。对预测模型进行评价,模型系数的全局性Omnibus检验有统计学意义(χ2=248.56,P<0.001);联合预测因子L的ROC曲线下面積为0.950,95%置信区间为0.925~0.975;当L>8.895时模型预测肝功能障碍发生的灵敏度为0.859、特异度为0.905。
结论 感染相关肝功能障碍预测模型可运用于临床,而且有较高的预测价值。
[关键词] 感染;肝疾病;回归分析;预测;模型,统计学
[中图分类号] R575.3
[文献标志码] A
[文章编号] 2096-5532(2021)05-0657-05
doi:10.11712/jms.2096-5532.2021.57.131
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20210628.1659.013.html;2021-06-29 09:21:48
ESTABLISHMENT AND EVALUATION OF A PREDICTION MODEL FOR INFECTION-RELATED LIVER DYSFUNCTION
WANG Shuai, LIU Huamin, XIN Zhaorui, WANG Wanteng, WANG Yunyun, SUN Yunbo
(Department of Intensive Care Unit, The Affiliated Hospital of Qingdao University, Qingdao 266071, China)
[ABSTRACT] Objective To establish a prediction model for infection-related liver dysfunction and to evaluate the model through data analysis.
Methods A retrospective analysis was performed on the clinical data of 302 patients with infection who were admitted to Department of Intensive Care Unit, The Affiliated Hospital of Qingdao University. The patients were divided into normal liver function group and liver dysfunction group. After a logistic regression analysis of the risk factors associated with liver dysfunction, a prediction model was established to predict the occurrence of infection-related liver dysfunction, and the receiver operating characteristic (ROC) curve of the combined predictor and other risk factors was plotted to evaluate the predictor.
Results
The logistic regression analysis identified four risk factors associated with liver dysfunction: Acute Physiology and Chronic Health Evaluation Ⅱ (APACHE Ⅱ) score, concentration of blood lactic acid, C-reactive protein, and the long history of drinking. The established prediction model for infection-related liver dysfunction was: L=long history of drinking+0.220 APACHE Ⅱ score+0.011 C-reactive protein+2.707 lactic acid. The prediction model was evaluated using the global Omnibus test of model coefficients, which was statistically significant (χ2=248.56,P<0.001). The area under the ROC curve of the combined predictor L was 0.950 (95%CI=0.925-0.975). When L>8.895, the model for predicting the occurrence of liver dysfunction had a sensitivity of 0.859 and specificity of 0.905.
Conclusion The model for predicting infection-related liver dysfunction can be used in clinical practice and has a high predictive value.
[KEY WORDS] infection; liver diseases; regression analysis; forecasting; models, statistical
感染相关肝功能障碍是指病人出现严重感染甚至脓毒症以后,肝脏继发出现的功能异常,主要表现为血清肝酶或胆红素的显著升高,严重者可出现凝血功能障碍和清蛋白的下降。在因肺部感染或肺外(非肝胆系统)感染入住ICU的病人中,肝功能障碍发生率较高,并且有肝功能障碍的病人具有更高的病死率和更差的预后[1-2],但临床上此类肝功能障碍病人大多无明显的临床表现。因此,对感染相关肝功能障碍进行早期预测并加以预防具有重要的临床意义。到目前为止,部分文献对发生感染相关肝功能障碍的危险因素做出了归纳总结,但未见感染相关肝功能障碍预测模型建立的研究。本研究旨在建立一个能够预测感染相关肝功能障碍的模型,使脓毒症病人在急性肝损害早期得到及时的干预,从而改善脓毒症病人的预后。
1 资料与方法
1.1 研究对象
回顾性收集青岛大学附属医院重症医学科2017年1月—2020年1月收治的目标资料齐全的302例感染病人的临床资料,根据有无继发性肝功能障碍将病人分为肝损害组(92例)和无肝损害组(210例)。纳入标准:①纳入病人年龄≥18周岁;②肝损害组病人肝功能障碍发生于入院后48 h内;③相关临床指标、病史、急性生理与慢性健康状况评估Ⅱ(APACHE Ⅱ)评分等临床资料完整;④肝损害组病人谷丙转氨酶和(或)谷草转氨酶活力升至2倍正常值上限以上[3],或胆红素浓度>20 mg/L并伴有凝血酶原国际标准化比值(INR)>1.5的凝血功能障碍的发生[4]。排除标准:合并肝胆原发性和转移性肿瘤、肝炎、慢性肝功能不全、肝硬化、肝脓肿、胆管炎、胆囊炎、药物性肝损害等疾病以及肝胆术后的病人。
1.2 资料收集
使用统一的调查表记录病人的临床资料,包括基本资料(年龄、性别、感染部位、APACHE Ⅱ评分)、临床检验指标(C反应蛋白、降钙素原、乳酸)、既往病史(糖尿病、高血压、高脂血症病史,吸烟、饮酒史,感染性休克、慢性肾功能不全、慢性心功能不全和慢性阻塞性肺疾病史)、治疗情况(是否机械通气、是否应用镇痛镇静药)。以上自变量均结合相关文献[3]及个人临床经验选取。在收集两组病人的APACHE Ⅱ评分以及血C反应蛋白、降钙素原、乳酸浓度时,均选择入住ICU时的数值。
1.3 统计学方法
资料收集完成后,使用SPSS 25.0软件进行数据统计分析。首先对每个因素进行单因素筛查,分类变量比较采用χ2检验;连续变量先采用Shapiro-Wilk检验判断其正态性,服从正态分布者比较采用独立样本t检验,不服从正态分布者比较采用两独立样本非参数检验。然后将P<0.05的因素视为可疑危险因素,纳入多因素分析。多因素分析采用二元Logistic回归分析(强制进入法),得到最终的独立危险因素。运用独立危险因素的回归系数建立联合预测模型,对联合预测因子L以及独立危险因素进行受试者工作特征曲线(ROC曲线)分析,计算联合预测因子和独立危险因素诊断疾病的准确性、灵敏度以及特异度。
2 结 果
2.1 单因素分析
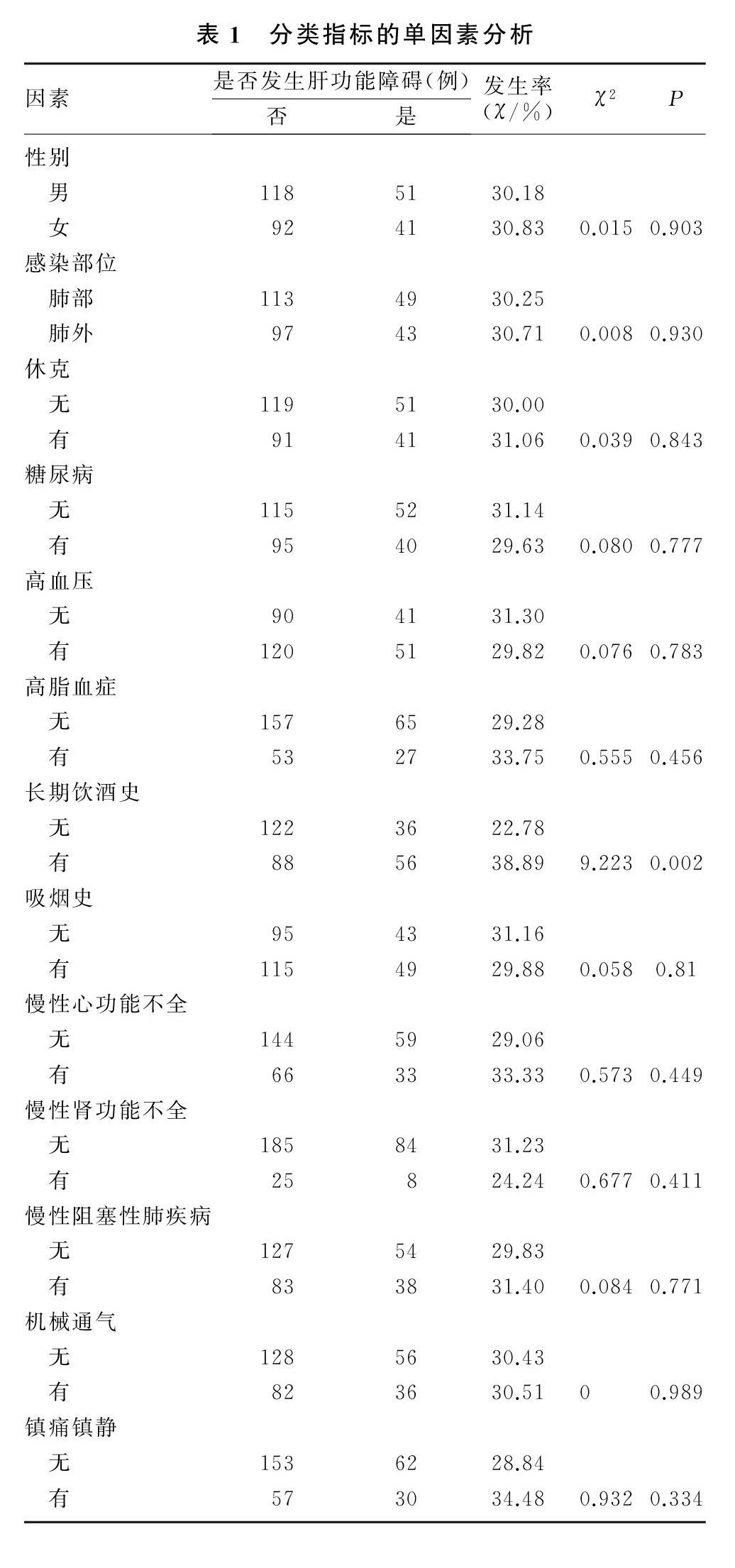
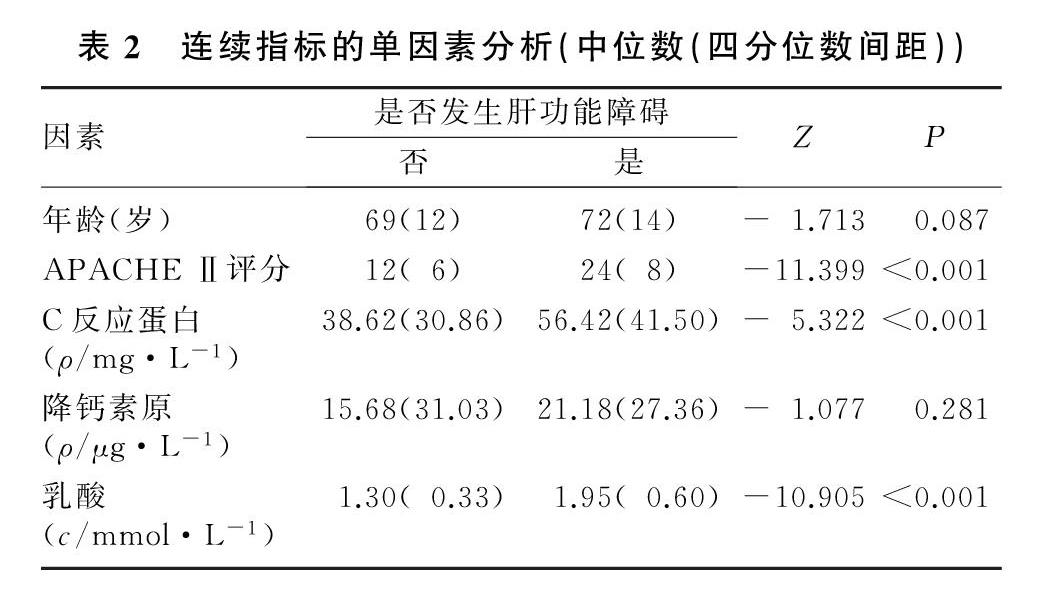
在选定的18个可能的影响因素中,经单因素分析后得到4个与肝损害相关的可疑影响因素,分别为乳酸、APACHE Ⅱ评分、C反应蛋白及长期饮酒史。见表1、2。
2.2 多因素Logistic回归分析
将4个可疑影响因素进行多因素Logistic回归分析,最终确定APACHE Ⅱ评分、乳酸、C反应蛋白及长期饮酒史均为感染相关性肝功能障碍的独立危险因素。见表3。APACHE Ⅱ评分、乳酸、C反应蛋白、长期饮酒史对肝功能障碍的影响分别为:①APACHE Ⅱ评分每升高1分,出现肝功能障碍的可能性增至之前的1.531倍;②血乳酸浓度每升高1单位,出现肝功能障碍的可能性增至之前的186.771倍;③血C反应蛋白浓度每升高1单位,出现肝功能障碍的可能性增至之前的1.021倍;④有长期饮酒史的病人出现肝功能障碍的可能性是无长期饮酒史病人的6.905倍。Logistic回归的拟合优度检验χ2=10.674,P=0.221,提示回归分析与实際观测数值具有良好的一致性。
2.3 预测模型建立
经过二元Logistic分析得出联合预测因子,建立模型L=长期饮酒史+0.426/1.932 APACHE Ⅱ评分+0.021/1.932 C反应蛋白+5.230/1.932乳酸,简化为L=长期饮酒史+0.220 APACHE Ⅱ评分+0.011 C反应蛋白+2.707乳酸(其中二分类变量长期饮酒史,设定有长期饮酒史=1,无长期饮酒史=0)。
2.4 预测模型评价
模型系数的全局性Omnibus检验具有统计学意义(χ2=248.56,P<0.001)。根据长期饮酒史、APACHE Ⅱ评分、C反应蛋白、乳酸以及联合预测因子L绘制ROC曲线。在ROC曲线中,上述5个因子对肝功能障碍发生的预测都具有显著意义,其中联合预测因子L的ROC曲线下面积(AUC)最大,为0.950,具有最高的预测价值。见图1。计算约登指数,约登指数最大时对应的L值为8.895,所以当L>8.895时,模型预测肝功能障碍发生的灵敏度为0.859,特异度为0.905。见表4。
3 讨 论
脓毒症病死率高的主要原因是感染宿主反应失调而引起的危及生命的器官障碍[5-7]。脓毒症的诊断和治疗都继续成为全球现代医学的最大挑战之一。及时诊断和识别有危险的病人,以及早期病因治疗是降低脓毒症病死率的关键。肝功能障碍是发生较为“隐匿”的一种器官功能障碍,在急性肝功能障碍的早期,病人往往没有具体的临床表现,因此容易被临床医生所忽视[8-10]。但其实肝脏在严重感染引起的败血症、脓毒症中起着核心作用,肝脏对败血症的免疫反应是一把双刃剑:它清除细菌和毒素,但会导致炎症、免疫抑制和器官损伤[11]。肝脏通过细菌清除、急性期蛋白或细胞因子的产生和对炎症的代谢适应等机制,调节免疫防御系统[12-14]。然而,肝脏也是脓毒症损伤的目标,在严重感染时会出现缺血和休克引起的低氧性肝损害,胆汁代谢改变引起的胆汁淤积,药物毒性或过度炎症引起的肝细胞损伤,以及继发性硬化性胆管炎等明显病理改变[15-17]。脓毒症导致肝损害具体的病理生理机制有下列几点。①肝脏微循环障碍:脓毒症时肝脏微循环血流量明显减少,肝窦灌注显著降低,可能与内皮素-1(ET-1)、一氧化氮(NO)等血管活性物质的分泌异常有关[18];②能量代谢障碍:在脓毒症状态下,肝细胞线粒体损伤可引起肝脏能量代谢和解毒功能障碍,导致肝功能不全[19];③肠道菌群移位[20];④氧自由基和脂质过氧化[21];⑤炎性细胞过度激活并释放大量炎性因子[22];⑥多形核中性粒细胞(PMN)的介导作用[23-24];⑦血小板活化因子(PAF)的作用[25];⑧肝细胞凋亡或坏死;⑨环氧合酶-2(COX-2)表达上调、NO产生增多、Ca2+跨膜内流增加、感染控制不佳、脏器支持治疗不当以及药物使用不合理等[26-28]。
肝功能障碍也影响着脓毒症病人的预后。一项前瞻性、多中心队列研究调查了伴有早期肝功能障碍(入院48 h内血清胆红素>20 mg/L)的脓毒症病人的预后情况,结果表明,病人的中位重症监护室住院时间更长(5 d vs 3 d),住院28 d病死率更高(30.4% vs 16.4%),肝功能障碍也与较高的观察与预期病死率相关,多元Logistic回归分析显示肝功能障碍的独立死亡风险超过了所有其他器官功能障碍的影响(OR=1.86,95%CI=1.71~2.03)[2]。另外一项回顾性研究结果表明,182例脓毒症导致的肝功能障碍病人的住院病死率为61.5%(112例),83.3%的病人发生感染性休克,77.7%的病人出现心脏停搏,死亡的独立危险因素为INR延长、需要肾替代治疗和感染性休克等[29-31]。因此,对早期肝功能障碍的识别尤为重要,及早进行干预往往会带来更好的预后。既往文献尽管提到了肝功能障碍发生的危险因素,但却没有对其发生做出预测。
本研究经二元Logistic回归分析得到了感染相关肝功能障碍的4个独立危险因素:长期饮酒史、APACHE Ⅱ评分、C反应蛋白和乳酸等。长期饮酒可能会使肝脏中的中性粒细胞的细菌清除功能失调[32-33];而较高的APACHE Ⅱ评分以及较高水平的乳酸、C反应蛋白则直接反映了病人处于严重感染、低灌注、微循环障碍状态,此时大量的细胞因子和炎性递质可以进一步被释放,肝脏在病理生理层面上开始出现“炎症风暴”,肝微血管舒缩功能紊乱进一步加重,肝细胞大量凋亡、坏死,肝功能出现明显异常[34-36]。经Logistic回归分析得到预测感染相关肝功能障碍发生的模型为:L=长期饮酒史+0.220 APACHE Ⅱ评分+0.011 C反应蛋白+2.707乳酸。该公式简单明了,而且使用方便。当临床上遇到确诊为脓毒症的病人时,只需得到公式中4个因素的资料并将其代入公式,即可得到L值,当L>8.895时临床医生需要密切关注病人的肝功能变化,及时采取保肝药物治疗、维持有效循环血量保证肝脏灌注、减轻全身炎性反应等措施。该预测模型可以作为一个很好的肝功能障碍的“报警器”,医生使用该预测模型对临床病人进行筛查,可以更好、更快捷地对临床病人进行评估,从而提高工作效率。
综上所述,感染相关肝功能障碍的发生与长期饮酒史、APACHE Ⅱ评分、C反应蛋白和乳酸等4个独立危险因素密切相关,本次研究得到的预测模型可运用于临床,指导感染病人肝脏功能的保护,从而更好地改善ICU感染病人的预后。
[参考文献]
[1]CANABAL J M, KRAMER D J. Management of sepsis in patients with liver failure[J]. Current Opinion in Critical Care, 2008,14(2):189-197.
[2]KRAMER L, JORDAN B, DRUML W, et al. Incidence and prognosis of early hepatic dysfunction in critically ill patients: a prospective multicenter study[J]. Critical Care Medicine, 2007,35(4):1099-1104.
[3]姜麗静,倪金迪,孙英杰,等. 脓毒症患者发生急性肝功能障碍诱因的多因素回归分析[J]. 肝脏, 2016,21(4):286-289.
[4]WONICA E A, INGLOT M, WONICA R K, et al. Liver dysfunction in sepsis[J]. Advances in Clinical and Experimental Medicine, 2018,27(4):547-551.
[5]SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. J Am Med Assoc, 2016,315:801-810.
[6]MORENO R, SPRUNG C L, ANNANE D, et al. Chevret et al. Time course of organ failure in patients with septic shock treated with hydrocortisone: results of the Corticus study[J]. Intensive Care Medicine, 2011,37(11):1765-1772.
[7]SPRUNG C L, ANNANE D, KEH D, et al. Hydrocortisone therapy for patients with septic shock[J]. New England Journal of Medicine, 2008,358(2):111-124.
[8]LIAUDET L, ROSENBLATT-VELIN N, PACHER P. Role of peroxynitrite in the cardiovascular dysfunction of septic shock[J]. Current Vascular Pharmacology, 2013,11(2):196-207.
[9]ARULKUMARAN N, DEUTSCHMAN C S, PINSKY M R, et al. Mitochondrial function in sepsis[J]. Shock, 2016,45(3):271-281.
[10]KUBITZ R, WETTSTEIN M, WARSKULAT U, et al. Re-
gulation of the multidrug resistance protein 2 in the rat liver by lipopolysaccharide and dexamethasone[J]. Gastroenterology, 1999,116(2):401-410.
[11]LELUBRE C, VINCENT J L. Mechanisms and treatment of organ failure in sepsis[J]. Nature Reviews Nephrology, 2018,14(7):417-427.
[12]YAN J, LI S, LI S L. The role of the liver in sepsis[J]. International Reviews of Immunology, 2014,33(6):498-510.
[13]DE MAIO A, GINGALEWSKI C, THEODORAKIS N G, et al. Interruption of hepatic gap junctional communication in the rat during inflammation induced by bacterial lipopolysaccharide[J]. Shock (Augusta, Ga), 2000,14(1):53-59.
[14]HAN X N, FINK M P, UCHIYAMA T, et al. Increased iNOS activity is essential for hepatic epithelial tight junction dysfunction in endotoxemic mice[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2004,286(1):G126-G136.
[15]STRNAD P, TACKE F, KOCH A, et al. Liver-guardian, modifier and target of sepsis[J]. Nature Reviews Gastroente-
rology & Hepatology, 2017,14(1):55-66.
[16]LESCOT T, KARVELLAS C, BEAUSSIER M, et al. Acquired liver injury in the intensive care unit[J]. Anesthesiology, 2012,117(4):898-904.
[17]LARSEN F S, SCHMIDT L E, BERNSMEIER C, et al. High-volume plasma exchange in patients with acute liver fai-
lure: an open randomised controlled trial[J]. Journal of Hepatology, 2016,64(1):69-78.
[18]SPAPEN H. Liver perfusion in sepsis, septic shock, and multiorgan failure[J]. The Anatomical Record: Advances in Integrative Anatomy and Evolutionary Biology, 2008,291(6):714-720.
[19]HOTCHKISS R S, MOLDAWER L L, OPAL S M, et al. Sepsis and septic shock[J]. Nature Reviews Disease Primers, 2016,2:16045.
[20]BEUTLER B, RIETSCHEL E T. Innate immune sensing and its roots: the story of endotoxin[J]. Nature Reviews Immunology, 2003,3(2):169-176.
[21]HU H B, SUN S C. Ubiquitin signaling in immune responses[J]. Cell Research, 2016,26(4):457-483.
[22]AJIBADE A A, WANG H Y, WANG R F. Cell type-specific function of TAK1 in innate immune signaling[J]. Trends in Immunology, 2013,34(7):307-316.
[23]LAWRENCE T. The nuclear factor NF-kappa B pathway in inflammation[J]. Cold Spring Harbor Perspectives in Biology, 2009,1(6):a001651.
[24]BUKONG T N, CHO Y, IRACHETA-VELLVE A, et al. Abnormal neutrophil traps and impaired efferocytosis contri-
bute to liver injury and sepsis severity after binge alcohol use[J]. Journal of Hepatology, 2018,69(5):1145-1154.
[25]LIU S F, MALIK A B. NF-kappa B activation as a pathological mechanism of septic shock and inflammation[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2006,290(4):L622-L645.
[26]王秋卉,王锦权,叶文,等. 脓毒症对肝脏线粒体膜损伤机制的实验研究[J]. 中国急救医学, 2008,28(2):147-150.
[27]YANG H, WANG H C, CHAVAN S S, et al. High mobility group box protein 1 (HMGB1): the prototypical endogenous danger molecule[J]. Molecular Medicine (Cambridge, Mass), 2015,21(Suppl 1):S6-S12.
[28]BIRRER R, TAKUDA Y, TAKARA T. Hypoxic hepatopathy: pathophysiology and prognosis[J]. Internal Medicine (Tokyo, Japan), 2007,46(14):1063-1070.
[29]RAURICH J M, LLOMPART-POU J A, FERRERUELA M, et al. Hypoxic hepatitis in critically ill patients: incidence, etiology and risk factors for mortality[J]. Journal of Anesthesia, 2011,25(1):50-56.
[30]SPAPEN H. Liver perfusion in sepsis, septic shock, and multiorgan failure[J]. Anatomical Record (Hoboken, N J: 2007), 2008,291(6):714-720.
[31]DIZIER S, FOREL J M, AYZAC L, et al. Early hepatic dysfunction is associated with a worse outcome in patients presenting with acute respiratory distress syndrome: a post-hoc ana-
lysis of the ACURASYS and PROSEVA studies[J]. PLoS One, 2015,10(12):e0144278. doi:10.1371/journal.pone.0144278.
[32]赵广明,胡占升. 脓毒症肝损伤的发病机制与治疗研究进展[J]. 解放军医学杂志, 2019,44(6):515-520.
[33]BENZ F, ROY S, TRAUTWEIN C, et al. Circulating MicroRNAs as biomarkers for sepsis[J]. International Journal of Molecular Sciences, 2016,17(1):78.
[34]NANCY B M. Abnormal liver function tests and hepatic dysfunction in patients with sepsis[J]. Verdauungskrankheiten, 2020,38(4):134-140.
[35]ZENG C L, CHEN Q X, ZHANG K, et al. Hepatic hepcidin protects against polymicrobial sepsis in mice by regulating host iron status[J]. Anesthesiology, 2015,122(2):374-386.
[36]AREZES J, JUNG G, GABAYAN V, et al. Hepcidin-induced hypoferremia is a critical host defense mechanism against the siderophilic bacterium Vibrio vulnificus[J]. Cell Host & Microbe, 2015,17(1):47-57.
(本文編辑 马伟平)
