非血液来源液体活检在胃癌早期诊断中的研究进展
2021-11-17徐亦天
徐亦天,黄 陈
上海交通大学附属第一人民医院胃肠外科,上海200080
癌症的液体活组织检查(liquid biopsy),即液体活检,传统意义上是指利用高通量测序对外周血中分离出的癌症衍生成分,如循环肿瘤细胞(circulating tumor cell,CTC)、循环肿瘤DNA(circulating cell-free tumor DNA,ctDNA)、细胞游离RNA(cell-free RNA,cfRNA)、细胞外囊泡(extracellular vesicle,EV)、受肿瘤影响的血小板(tumour-educated platelet)等,进行基因组学、转录组学、蛋白质组学的评估[1-2]。对于早期治愈率高、难发现、进展期易诊断却预后差的胃癌而言,液体活检的出现不仅可以替代准确性不高的传统血清学肿瘤标志物检测,而且其无创无痛、快速易得、全面反映肿瘤状况的特点也可以很好地辅助并补充相对滞后的上消化道内镜活检,从而达到早期发现、早期诊断、动态监测胃癌的目的,指导个体化的精准治疗,进而改善患者的预后与生存[3-4]。然而,随着技术不断进步,液体活检在各类实体肿瘤(包括胃癌)临床实践中的应用一直很缓慢[5-6]。液体活检的验证与应用受限有很多原因,除去一些与技术发展和临床工作相关的科学问题外,血液样本(包括血清和血浆)中低浓度的癌症衍生成分限制了液体活检在癌症发生或复发早期发现并预警的能力,并且抽取大量血液在临床上并不总是可行的[7-8]。近年来,液体活检的概念被进一步扩展,研究[9-10]发现,除血液外其他体液(如脑脊液、唾液、痰、胸腔积液等)可能蕴藏着比血液更加丰富的肿瘤信息,在胃癌、胰腺癌、前列腺癌等各类恶性肿瘤中发现了许多可靠的标志物,表明除血液外体液的液体活检,即非血液来源液体活检,有能力革新癌症的诊断与管理。因此,本文通过比较血液来源与非血液来源液体活检的优劣,阐述胃癌中非血液来源液体活检研究的必要性,介绍近年来非血液来源液体活检在胃癌早期诊断中的研究进展。
1 非血液来源液体活检的优势与挑战
过去一些研究通过改进检测技术以期解决血液样本中标志物含量低的问题,如利用新一代测序技术(next-generation sequencing,NGS)、为CTC添加额外的标志物、使用含有结合ctDNA材料的植入装置或同时检测同一反应中多个突变的检测方法等[11-13],然而这些方法受限于操作与成本,难以真正推动液体活检的临床应用。非血液来源液体活检的一大优势就是可以从与肿瘤直接接触的体液中收集目标信息,凸显标志物含量和与原发肿瘤的相关性,从而减少对复杂技术的需求。Hirotsu等[14]的研究就很好地反映了非血液来源液体活检这一优点。他们对25例膀胱癌患者和5例膀胱炎及良性肿瘤患者的150份原发肿瘤、尿上清液、尿沉淀、血浆和血沉棕黄层进行了71个基因的靶向测序,并分析比较了每个样本之间的突变谱,结果发现原发肿瘤中的168个体细胞突变可以在尿液活检中被更多地检测出来,尿上清液与尿沉淀分别发现了53%和48%的肿瘤相同突变,而血液中却仅检测到2%[14]。另外,尿液DNA对膀胱肿瘤诊断的敏感性显著高于细胞学诊断(尿上清液vs细胞学,P=0.018;尿沉淀vs细胞学,P=0.002)[14]。即使不与肿瘤直接接触,除血液外的其他体液也有着采集更加无痛、无创、易操作、样本量大等优势,以及较好的肿瘤相关性。Zhang等[15]收集了160例取自晚期非小细胞肺癌患者的外周血和晨尿样本,检测了常见的表皮生长因子受体(epidermal growth factor receptor,EGFR)的基因突变并进行纵向分析发现,在基线匹配的肿瘤样本中,血浆和尿液DNA检出率分别为82.8%和84.0%,阳性预测值均为100%。此外,还观察到患者的DNA浓度越高,其预后越差,尤其是尿液DNA,血浆和尿液DNA增高患者的HR分别为1.23和2.55。因此,非血液来源液体活检由于其非侵入性、接近肿瘤、易学性以及经济上可行性,允许对肿瘤的发生、发展和预后进行纵向评估与连续监测,若能将其应用于胃癌诊断,则很有可能改善胃癌发现晚、预后差、死亡率高的现状。
然而,新兴的非血液来源液体活检,其相比传统液体活检,缺乏分析前处理及分析方法共识与临床验证。某些特定器官或部位采集的体液无法如同全身循环的血液那样反映癌症转移的具体情况[16]。此外,相比于血液,其他体液有着更加复杂的微生物环境,微生物自身及其代谢物会对检测结果造成难以预测的影响,但这也可能是癌症分子检测的新机遇。例如最近一项研究[17]对内镜或手术患者的胃液进行了基于16S rDNA的宏基因组分析,结果显示胃癌手术组的幽门螺杆菌EV水平明显高于健康对照组(P<0.05),是胃癌潜在的生物标志物。在机制上,胃癌患者胃液中丰富的幽门螺杆菌EV可能通过诱导巨噬细胞与胃上皮细胞释放各类炎症介质,被胃上皮细胞选择性摄取,在胃内诱发炎症甚至癌变[17]。
通过检索PubMed数据库近10年的(2011年1月1日—2021年1月1日)非血液来源液体活检在胃癌中的相关研究,我们从较多体液样本类型中选择了4种在早期检测和风险评估胃癌方面最具可行性的体液,分别是唾液、胃液、胃洗液与尿液,共检索到文献50篇。我们发现胃癌中的非血液来源液体活检比传统液体活检在早期诊断上有着许多优势,但必须承认距离它们实际投入临床应用还有许多需要克服的挑战,表1列出了胃癌中不同体液活检的比较。另外,通过图1可以明显地看到近5年(2016—2020年)的文献发表数量明显多于过去5年(2011—2015年),非血液来源液体活检在胃癌诊治中的作用正在逐渐引起学者们的关注,因此,本文将对唾液、胃液、胃洗液与尿液共4种体液来源的液体活检在胃癌早期诊断中的研究进展进行综述。
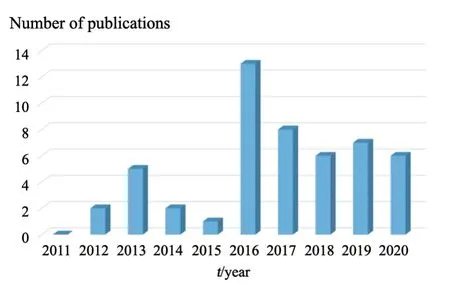
图1 PubMed检索近10年胃癌非血液来源液体活检结果的柱状图Fig.1 Bar chart of non-blood derived liquid biopsy in gastric cancer from PubMed in the last 10 years

表1 胃癌中不同样本类型液体活检的优势与挑战Tab.1 The advantages and challenges of liquid biopsy from different types of samples in gastric cancer
2 胃癌中的唾液活检
唾液细胞外RNA(extracellular RNA,exRNA)已被开发用于检测各种局部和全身疾病,如口腔癌、Sjogren综合征、胰腺癌、乳腺癌、肺癌等[18]。在胃癌的发展过程中,唾液腺受到来自远处肿瘤释放的神经生长因子等的刺激,导致胃癌患者的唾液RNA谱出现显著变化,差异表达的exRNA可用于胃癌检测[19]。一项样本来自韩国的前瞻性研究收集了294例患者(163例胃癌患者和131例非胃癌患者)的内镜检查前全唾液样本,对63例胃癌患者和31例非胃癌患者的唾液转录组进行了分析,并使用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)对候选信使RNA(messenger RNA,mRNA)生物标志物进行了验证[18]。与此同时,对10例胃癌患者和10例非胃癌患者的唾液样本进行了微小RNA(microRNA,miRNA)生物标志物的分析和验证。总共鉴定了30个候选mRNA和15个候选miRNA,它们的表达模式与胃癌的发生相关(P<0.05)[18]。其中12个候选mRNA和6个候选miRNA通过RTFQ-PCR在100/100个来自胃癌和非胃癌患者的唾液样本的独立队列中进行验证。最终由在胃癌中显著下调的3个mRNA(SPINK7、PPL和SEMA4B)和2个miRNA(MIR140-5p和MIR301a)组成了一个生物标志物组合,其受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)为0.81(95% CI:0.72~0.89),灵敏度为75%,特异度为83%。该研究首次证明了唾液exRNA生物标志物在胃癌早期检测和风险评估中具有潜在的效用[18]。
另外,在唾液exRNA作为生物标志物的基础上联合肿瘤标志物如癌胚抗原(carcinoembryonic antigen,CEA)、CA19-9、CA72-4等,可以有效地提高胃癌检测的灵敏度和特异度。Xu等[21]探讨了CEA和唾液mRNA联合检测胃癌的可能性,他们在探索阶段(140例胃癌患者和140名健康对照者)所建立的CEA和唾液mRNA(SPINK7、PPL、SEMA4B和SMAD4)生物标志物组合具有高灵敏度(94%)和高特异度(91%),在独立验证阶段新招募的患者队列(60例胃癌患者和60名健康对照者)中也得到了类似的结果(灵敏度为92%,特异度为87%),证明了联合血液CEA和唾液mRNA早期诊断胃癌的可行性。
3 胃癌中的胃液活检
胃液是胃癌生物标志物的潜在来源,它直接由细胞分泌进入胃,与肿瘤细胞直接接触。且相比血液,标志物不会进入循环系统而被肝脏清除,为早期诊断胃癌提供了新的方法[21],然而目前关于胃液特异性肿瘤分子的研究尚处于起步阶段。
许多血液miRNA标志物已被用于胃癌临床诊治[22],胃液中miRNA的改变也同样可以作为一种胃癌活检的替代方法。Cui等[23]收集了2010年9月—2011年12月接受上消化道内镜检查的141例患者的胃液样本,发现与良性胃病患者相比,胃癌患者的胃液miR-21和miR-106a水平显著不同(P<0.001),用于鉴别良性疾病患者时,胃液miR-21和miR-106a的AUC分别为0.969和0.871。此外,胃液miR-21对早期胃癌的阳性检出率高达71.4%,比血清CEA(14.3%)和胃液CEA(42.8%)更加敏感,表明这些胃液miRNA比常用的胃液生物标志物和血清生物标志物更适合于胃癌的筛查。其他已被报道的胃液miRNA还有miR-421[24]、miR-129[25]和miR-133a[26],它们均被证明能在胃液中稳定存在,且在胃癌早期具有比传统血清标志物更高的灵敏度。然而目前潜在的胃液miRNA缺乏随机对照试验的验证。
长非编码RNA(long non-coding RNA,lncRNA)在癌症中发挥着基因调控的关键作用,胃液中的lncRNA是诊断和监测胃癌的重要标志物[27]。胃癌患者胃液AA174084水平显著高于非胃癌患者,胃液AA174084水平用于鉴别胃癌和非胃癌组时,AUC为0.848,灵敏度为46%,特异度为93%,胃液AUC值比癌组织AUC值(0.676)更高。另外,胃液AA174084水平与肿瘤大小(P=0.026)、肿瘤分期(P=0.034)、Lauren型(P=0.021)、胃液CEA水平(P=0.039)呈正相关,提示胃液AA174084水平越高,胃癌患者的预后越差,可用于预测胃癌患者的临床预后[28];LINC00152在胃癌组织中的表达水平显著升高,胃液LINC00152鉴别胃癌和非胃癌组的AUC为0.645,灵敏度为90%,特异度为90%[29];PVT1在胃癌组织和细胞系中表达明显高于正常对照,胃液PVT1水平在胃癌组和非胃癌组间差异有统计学意义(P=0.03)[30];胃液ABHD11-AS水平在胃癌患者中更高,与临床病理学特征相关,诊断早期胃癌的阳性检出率为71.4%[31]。
环状RNA(circular RNA,circRNA)是一类具有共价闭合环状结构的内源性RNA,最近研究表明它是人类癌症发生、发展的关键调控因子[32]。多种circRNA被报道在胃癌组织与正常组织间存在显著的差异,我们之前的研究也报道了circCCDC9和circNHSL1在胃癌中的差异表达,并深入探索了它们各自的抑癌或促癌机制[33-34]。在胃液活检中,Shao等[35]通过RTFQPCR对38名健康者、30例胃溃疡患者、15例慢性萎缩性胃炎患者和39例胃癌患者的胃液进行检测发现胃液中hsa_circ_0014717的存在,并且冻融和温育实验结果证实了hsa_circ_0014717在胃液中的稳定性,但是进一步分析发现胃液hsa_circ_0014717水平在健康组与胃溃疡组、胃癌组间差异无统计学意义。Shao等[36]又报道了hsa_circ_0065149在胃癌中显著下调,且通过DNA序列确认胃液中存在hsa_circ_0065149,但检测结果表明其在健康志愿者、胃溃疡患者、慢性萎缩性胃炎患者与胃癌患者之间的差异无统计学意义(P=0.448)。以上的结果可能是因为研究样本不充足所导致,但是Shao等[35]的研究证实circRNA能稳定存在于胃液中,具有作为生物标志物的潜力。
癌细胞分泌的EV在肿瘤微环境的形成中发挥重要作用,包括纤维化、血管生成、逃避免疫监视,甚至转移[37]。Kagota等[38]通过纳米粒子跟踪系统和电子显微镜验证了胃癌患者的胃液中存在EV,另外通过Western blot、生物分析仪和RTFQ-PCR对EV的蛋白和miRNA进行检测,证明了胃液EV具有促进正常成纤维细胞增殖的功能。他们还发现胃液EV中的miR16-5p和miR191-5p表达良好,可能是EV的内参基因,提示这些miRNA具有作为胃癌生物标志物的潜力。
4 胃癌中的胃洗液活检
DNA异常甲基化在肿瘤发生的早期就会频繁出现,可以用于检测胃癌,然而由于DNA容易被胃酸降解,将胃液作为DNA生物标志物的来源一直不可行[39]。胃洗液则能用于替代胃液在胃癌分子检测中的部分作用,通过内镜下使用生理盐水在胃黏膜周围进行清洗,可以使大量的细胞脱落进入胃洗液中,从而获得未受损的DNA用于灵敏和定量的分析。Watanabe等[40]最早开发了一种方法来检测胃洗液中胃癌DNA甲基化,并发现胃洗液的甲基化水平与胃癌活检样本的甲基化水平密切相关。候选基因中的GDNF和MINT25被证明是早期胃癌最敏感的分子标志物,特别是胃洗液中MINT25基因甲基化可以很好地鉴别胃癌与非胃癌,其灵敏度与特异度分别为90%和96%,AUC为0.961。Sox17基因沉默在早期胃癌中经常发生,可能在疾病的发生和进展中起关键作用,而胃洗液Sox17被报道在早期胃癌内镜治疗的前后表现出显著的甲基化差异(P<0.000 1),可用于内镜治疗后复发的早期诊断[41]。BARHL2是另一种候选的早期胃癌标志物,并且独立于幽门螺杆菌感染,在内镜下切除前早期胃癌患者的胃洗液来源DNA中观察到高水平的BARHL2基因的甲基化,但在治愈性内镜下切除后甲基化水平显著降低(P<0.000 1)[42]。令人感兴趣的是,使用胃液提取的外泌体DNA(exoDNA)进行分析,发现exoDNA中的BARHL2甲基化似乎并不受胃酸影响,对区分胃癌患者和非胃癌对照的灵敏度为90%,特异度为100%,胃洗液来源的DNA和胃液来源的exoDNA均可用于早期检测胃癌[42]。
最近,Pizzi等[43]通过第二代深度测序技术检测了肿瘤活检、血浆和胃洗液中胃癌常见高突变基因TP53,发现在胃洗液中有11个不同的TP53突变,其中4个在原发肿瘤活检中缺失,提示可能存在肿瘤异质性。在判断胃癌TP53突变时,38/46例(82.6%)患者的肿瘤活检结果与胃洗液检测结果相一致,优于来自血浆样本的结果。若仅考虑活检中观察到的TP53突变(n=15),联合血浆和胃洗液来源的DNA测序可以确定大多数突变患者(9/15,60%),高于以往仅使用血浆样本的胃癌患者(34%[44]或30%[45]),对于追踪肿瘤DNA的改变很有帮助。
5 胃癌中的尿液活检
在胃癌中,尿液活检的生物学基础是癌细胞可以通过分泌外泌体颗粒将癌症衍生成分释放到体液中,从而保护其在循环中不被降解,经过肾脏对于血液的滤过作用进入尿液[46]。尿液收集过程是真正无创的,安全简单,无需任何特殊的技术和仪器,且样本体积量大。
Kao等[47]从胃癌患者尿液样本中提取总RNA,验证了之前其他研究报道的胃癌血清生物标志物miR-21-5p在尿液中的稳定性,发现胃癌患者手术前后尿液中miR-21-5p的表达存在差异。术前和术后胃癌尿液样本中miRNA表达水平相比,去除癌组织后miR-21-5p表达水平有显著下降趋势(P=0.000 22)。Iwasaki等[48]分析了153对年龄和性别相匹配的胃癌患者和健康者的尿液样本,发现有22种尿中显著异常表达的miRNA,其中尿miR-6807-5p和尿miR-6856-5p是诊断胃癌的显著独立的生物标志物。随后他们联合这两种miRNA与幽门螺杆菌感染状态来鉴别健康组和胃癌组,在验证队列中的AUC高达0.885。此外,胃癌根治性切除后,尿miR-6807-5p和尿miR-6856-5p表达水平显著降低至无法检测,提示两者可能具有疗效监测的作用。
核酸氧化修饰与包括癌症在内的多种疾病有关,近年来引起了越来越多的关注。Chen等[49]开发并验证了一种准确可靠的固相萃取结合超高效液相色谱-串联质谱(UPLC-MS/MS)同时可定量分析人类尿液中这些氧化核酸修饰的方法,并定量分析了60例胃癌患者和70名健康对照者的尿8-羟基-2’-脱氧鸟苷(8-OHdG)和8-羟基鸟苷(8-OHG),结果显示胃癌患者尿液中8-OHdG和8-OHG含量均高于健康对照组(P<0.000 1)。用于诊断胃癌时,尿8-OHdG和8-OHG的AUC分别为0.777和0.841,提示这些氧化核酸修饰可作为胃癌早期诊断的潜在无创标志物。
6 总结与展望
近几年来非血液来源液体活检在胃癌中的研究正在加速发展,在早期诊断胃癌方面卓有成效,但目前该领域的研究仍然较少,且面临许多挑战,如内镜采集胃液或胃洗液过程的侵入性、检测结果易受体液复杂成分的影响、缺少大样本多中心研究等,因此需要后期更加深入地开展研究。未来对于胃癌非血液来源液体活检的研究可能集中在:①验证非血液样来源样本中癌症衍生成分的稳定性;② 研发从成分复杂的非血液来源样本中进行提纯的标准方法;③研究非血液来源样本中的生物标志物与肿瘤发生、发展的相关机制;④ 探索非血液来源液体活检与血清学肿瘤标志物检测或传统液体活检的联合方案,用于诊断或监测胃癌;⑤ 探索非血液来源液体活检在胃癌疗效监测与预后评估中的应用,以及更多可能应用于胃癌液体活检的体液类型等。伴随着相关研究的推进,相信非血液来源液体活检将成为胃癌及其他恶性肿瘤常规诊筛和临床管理的一个重要组成部分。
