微流控芯技术检测循环肿瘤细胞在脑胶质瘤预后预测中的价值
2021-11-17杨通衢韩志桐赵卫平陈云照张大鹏张瑞剑
杨通衢,韩志桐,赵卫平,陈云照,张大鹏,张瑞剑
1.内蒙古医科大学附属医院,内蒙古 呼和浩特 010010;
2.内蒙古自治区人民医院神经外科,内蒙古 呼和浩特 010010;
3.内蒙古科技大学包头医学院,内蒙古 包头 014040
脑胶质瘤是常见的颅内原发性肿瘤,主要由大脑与脊髓内癌变的胶质细胞产生。近年来,胶质瘤的发病率明显上升,占全部颅内恶性肿瘤发病率的81%,5年生存率低于5%,其流行病学特征呈“三高一低”,即高发病率、高致死率、高复发率以及低治愈率,进展迅速[1-2]。脑胶质瘤的治疗方法主要为手术切除,并辅以放疗或化疗,但预后较差[3],因此早期诊断在改善患者预后方面具有重要意义。目前,临床上即使分辨率最高的影像学设备也只能检测出5 mm以上的肿块,病理学检查虽可以对肿瘤组织实现精准的分期分级,但有其局限性[4-6]。微流控芯技术是近年来发展起来的可精确操控微升、毫升级别样品的生物体液活检技术,通过控制器件特征尺寸与细胞尺寸相匹配从而实现微量循环肿瘤细胞循环肿瘤细胞(circulating tumor cell,CTC)的富集[7-8]。多项研究表明,由于CTC携带了肿瘤所有基因,可及时反映肿瘤的动态信息,因此,可作为生物体液活检重要标志物[9-12]。然而,CTC在脑胶质瘤中的研究较少。本研究通过微流控芯技术对外周血中的胶质瘤细胞进行富集可实时掌握肿瘤进展动态,为肿瘤的早期诊断、个体化治疗以及预后提供重要的依据。
1 资料和方法
1.1 一般资料
选取2016年3月—2020年3月内蒙古自治区人民医院神经外科收治的96例脑胶质瘤患者,其中男性56例,女性40例,年龄在19~71岁,平均年龄(56.25±7.96)岁,病程1~4年,平均病程(10.84±5.26)个月。诊断标准:符合《脑胶质瘤诊疗规范(2018年版)》[13]规定的相关症状及影像学特征:患者主要表现为头痛、眩晕、意识丧失、视物模糊,甚至大脑功能区出现运动、语言以及感觉功能异常等症状,CT扫描显示不同密度灶,可见增强的肿瘤包膜,部分患者肿瘤周边存在水肿,磁共振成像(magnetic resonance imaging,MRI)显示额叶胶质瘤28例,颞叶胶质瘤19例,顶叶胶质瘤9例,丘脑叶胶质瘤4例。纳入标准:年龄大于18周岁;肝肾功能正常;无传染性疾病;患者临床资料完整;患者知情同意并自愿参加本研究。排除标准:合并血液系统肿瘤患者;合并精神科疾病存在认知功能障碍的患者;研究期间死亡的患者。
1.2 实验方法
1.2.1 CTC的收集
采集所有患者手术前外周血4 mL于抗凝管内,加入4 mL红细胞裂解液缓慢吹打后室温下静置10 min对红细胞进行充分裂解,随后离心取下层沉淀细胞,加入10 mL磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)对细胞进行重悬。
1.2.2 CTC的富集
将收集到的细胞悬液,以2 mL/min的流速依次经过微流控芯分选装置和免疫磁珠纯化装置,选用4段微柱式结构串联而成的分选芯片,注入其中的细胞根据自身的尺寸分别被不同段的微柱捕捉。本研究中4段微柱的尺寸分别为20、15、10和5 μm,CTC在10 μm处被捕捉后形成富集液,将富集液均匀摊至载玻片上。
1.2.3 CTC的鉴定
将上述取得的含CTC载玻片用4%的多聚甲醛进行固定,5 min后PBS洗涤,采用0.5%Triton X-100通透细胞15 min,洗涤后用1%BSA进行封闭60 min,加入CD133、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、CD45一抗后4 ℃温育过夜,次日取出PBS洗涤后加入相应的荧光二抗37 ℃避光温育60 min(此后均避光),洗涤后加入DAPI细胞核染色液染色10 min,洗涤后加入20 μL水溶性封片液封片,并置于荧光显微镜下观察。
1.3 观察指标
采用免疫荧光法观察并鉴定微流控芯技术富集的CTC细胞特点(CTC为CD133+CD45-;白细胞为CD133-CD45+)。
术后随访3年,单因素分析脑胶质瘤患者外周血CTC的检测与脑胶质瘤临床特征的关系,临床指标包括年龄、性别、KPS评分、NSE、血清胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、肿瘤分期、组织学类型以及是否存在囊性病变等,并对筛选出的相关性指标进行多因素logistic回归分析,制作预测的受试者工作特征(receiver operating characteristic,ROC)曲线和脑胶质瘤患者术后生存率曲线。脑胶质瘤分期主要为4级:Ⅰ级为毛细胞型星型细胞瘤,占5%;Ⅱ级为星型胶质瘤或少突胶质瘤细胞,占30%~40%;Ⅲ期为间变性胶质瘤,占脑胶质瘤的15%~25%;Ⅳ级为胶质母细胞瘤,占胶质瘤细胞的1/3。参照《脑胶质瘤的分类和病理诊断》判定是否存在囊性病变,结合影像学如CT或MRI检查确定。
1.4 统计学处理
所有试验数据均采用SPSS 20.0进行处理,计量资料采用t检验进行统计学分析,并以x±s形式描述,计数资料采用χ2进行统计学分析,并以频数或频率n(%)表示。以脑胶质瘤患者CTC检测情况为因变量,以危险因子为自变量,拟合多元logistic回归方程,分析各危险因素对CTC检测情况的综合影响。P<0.05为差异有统计学意义。
2 结果
2.1 脑胶质瘤患者CTC检测情况
经微流控芯技术对CTC进行富集,采用免疫荧光染色对CTC进行鉴定,结果显示,本研究中96例脑胶质瘤患者中41例外周血均检测出CTC,检测阳性率为42.71%,外周血检测出的CTC数目为(4~103)/mL,平均数目为(66.27±6.36)/mL。患者外周血CTC和白细胞在免疫荧光显微镜下荧光特点见图1。
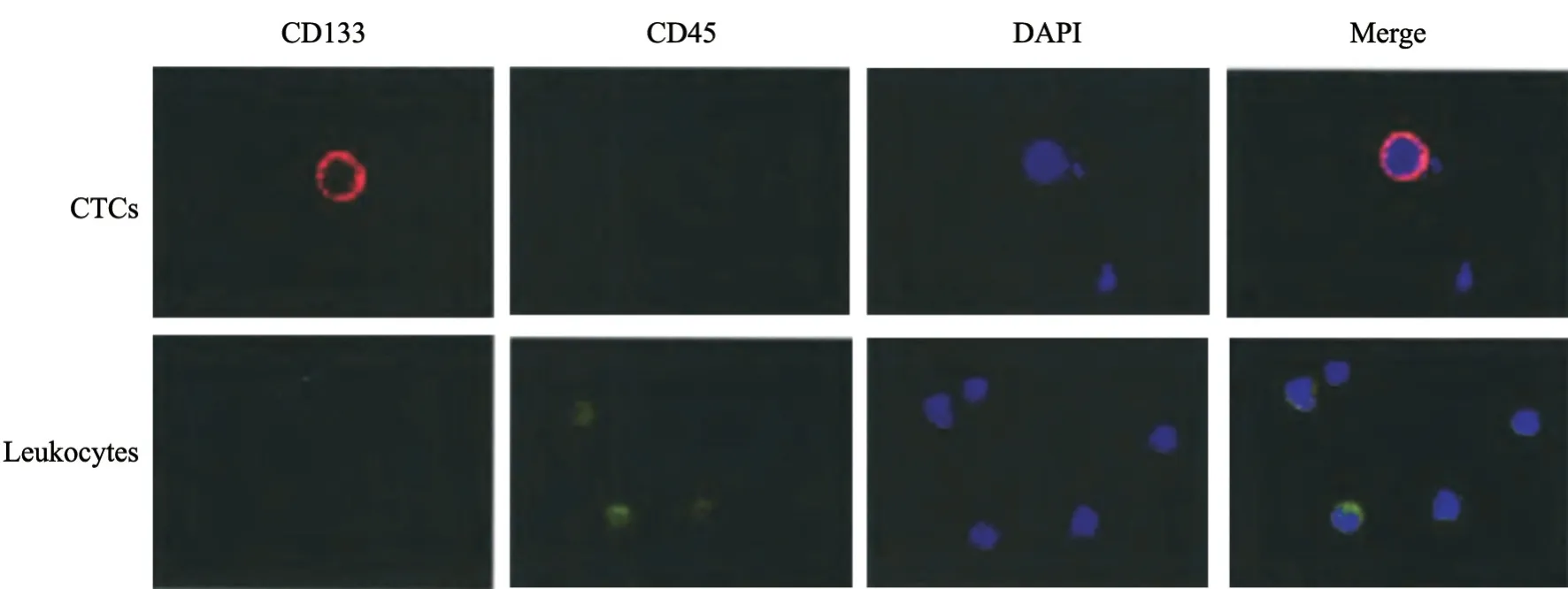
图1 脑胶质瘤患者外周血CTC与白细胞鉴定Fig.1 Identification of CTCs and leukocytes in the peripheral blood of patients with glioma
2.2 脑胶质瘤患者外周血CTC的数量与脑胶质瘤临床特征的单因素分析结果
外周血CTC的数量与脑胶质瘤临床病理学特征单因素分析结果显示,外周血CTC的数量与患者的肿瘤分期、总生存期(overall survival,OS)、是否存在囊性病变及NSE的表达情况密切相关(P<0.05),与年龄、性别、KPS评分及GFAP等临床特征无相关性(表1)。

表1 脑胶质瘤患者外周血CTC与脑胶质瘤临床特征的关系Tab.1 Relationship between CTCs in peripheral blood of patients with glioma and clinical features of glioma n (%)
2.3 Logistic回归分析结果
在单因素回归分析基础上,对肿瘤分期、组织学类型、是否存在囊性病变以及NSE的表达情况进行二元logistic回归分析。结果发现,肿瘤分期(OR=4.914,95% CI:1.535~15.734)、组织学类型(OR=0.187,95% CI:0.061~0.575)以及NSE的表达情况(OR=8.390,95% CI:2.922~24.089)与CTC阳性密切相关,CTC阳性发生的最终概率预测模型为P=1/[1+e(1.384-1.592肿瘤分期+1.676OS+2.127NSE)](表2)。
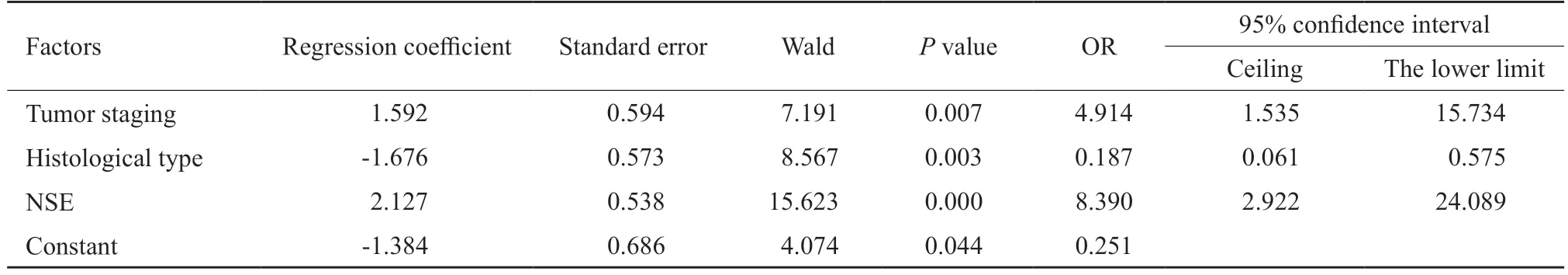
表2 多因素回归分析结果Tab.2 Multivariate regression analysis results
2.4 ROC曲线评估脑胶质瘤预测模型的预测性
将肿瘤分期、组织学类型以及NSE作为检验变量,作ROC曲线分析。得出肿瘤分期、组织学类型以及NSE的曲线下面积(area under curve,AUC)分别为0.645、0.687、0.720,预测概率AUC为0.814,差异有统计学意义(P<0.05,表3、图2)。
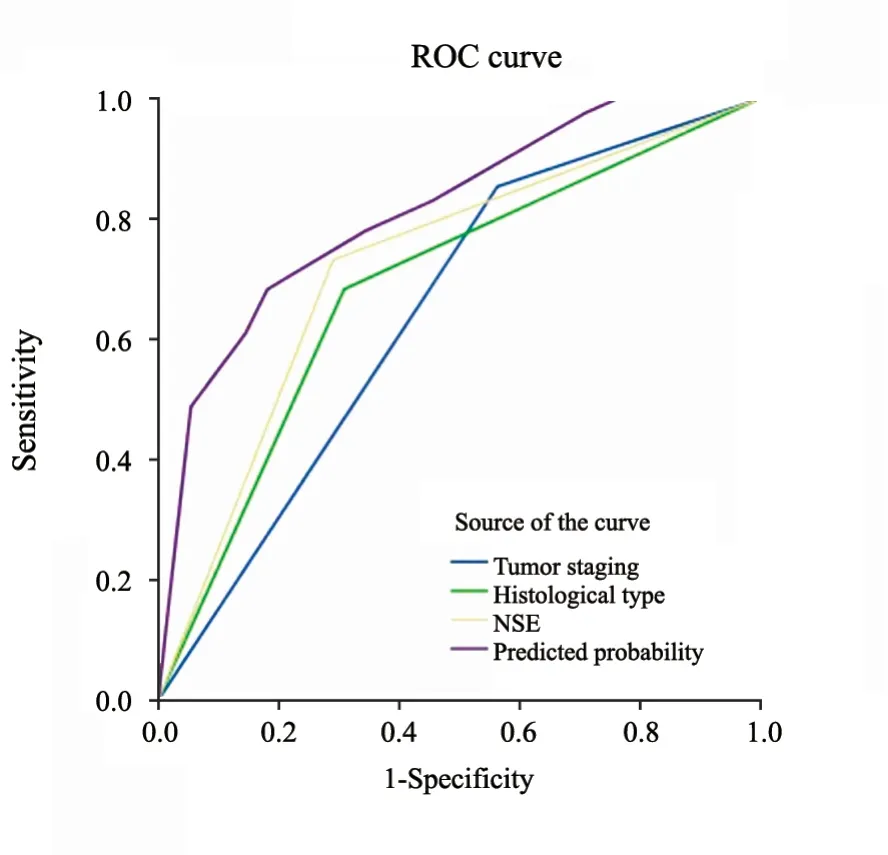
图2 脑胶质瘤患者肿瘤分期、组织学类型以及NSE预后评估的ROC曲线Fig.2 ROC curves of tumor stage,histological type and prognostic value of NSE in patients with glioma
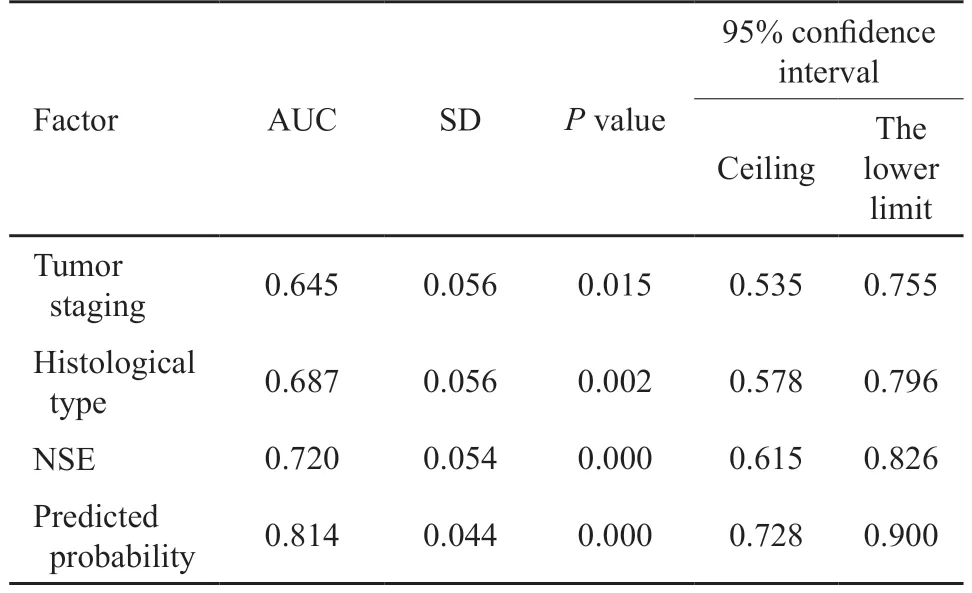
表3 肿瘤类型、肿瘤分期、组织学类型以及NSE的AUCTab.3 AUC of tumor type,tumor stage,histological type and NSE
2.5 脑胶质瘤患者外周血CTC与预后的关系
本研究中96例患者随访结果显示,自随访开始,CTC阳性组患者的生存率均明显高于CTC阴性组患者,经log-rank检验,差异有统计学意义(P<0.05)。其中CTC阳性组患者生存中位数为699 d,阴性组患者生存中位数为1 131 d(图3)。
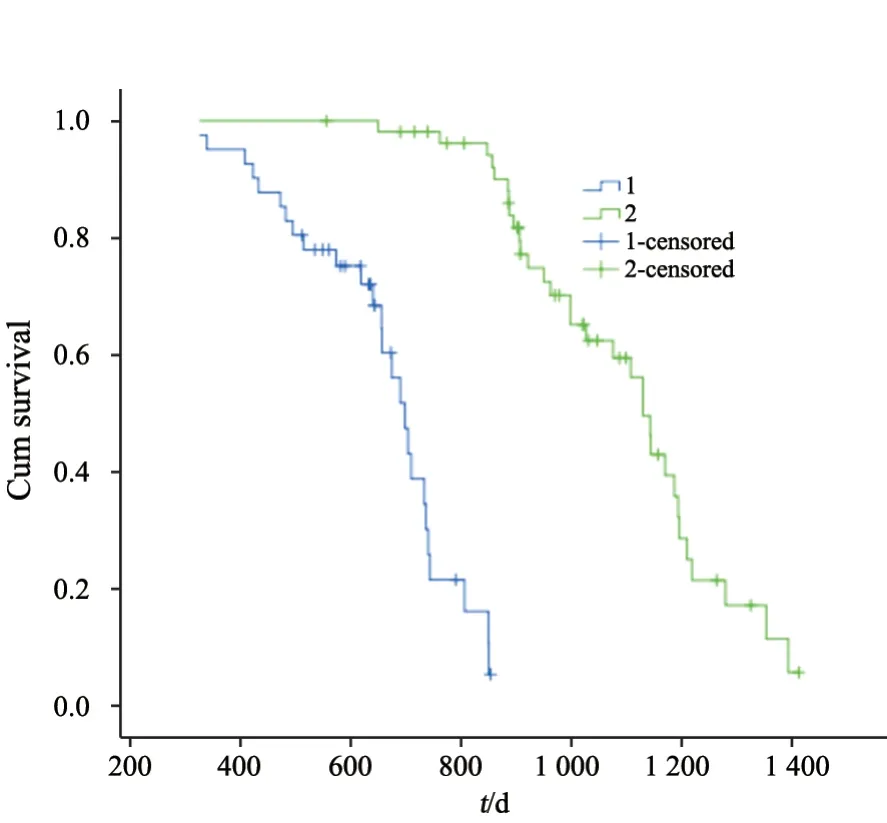
图3 患者生存率曲线Fig.3 Survival curves of patients
3 讨 论
目前已知的液体活检技术主要包括CTC、循环肿瘤DNA和细胞外囊泡,细胞外囊泡包括凋亡小体、微泡和外泌体[14]。研究表明,循环肿瘤DNA在人体内含量丰富,在脑胶质瘤患者的血浆中可以监测到循环肿瘤DNA,且与肿瘤组织样本的基因图谱具有同等追踪突变以及突变模式的能力[15-16]。另有研究证实,虽然循环肿瘤DNA具有高度特异性,利于检测,但是由于其半衰期较短,在人体内1~2 h即可降解[17]。CTC的检测难点在于其数量极少,通常临床研究的样本包含了大量的细胞信息,其中CTC仅占据其中的1/109,因此对于CTC的分选要求较高。微流控芯技术利用不同细胞在大小、形状上的差异,设计出可控的微结构进行过滤,分离出所需的CTC,从而达到分选富集的目的。微流控芯技术通过富集并检测血液中的CTC可直接反映肿瘤的类型和大小,进而辅助判断患者存活时间。该项技术已经在肺癌脑转移患者中进行了科学研究和临床探索,具有精准、微创、简单、快速的优点,在肿瘤的早期诊断与预测方面具有较强的价值[18]。然而由于CTC在人体外周血中数量极少,在109数量级细胞内才可能发现少数的CTC,此外,人体存在血脑屏障的作用,CTC在胶质瘤方面的研究目前较少[19-20]。
由于胶质瘤细胞表面主要表达特异性的CD133分子,且CD133也是脑胶质瘤术后复发的关键指标,CD133阳性的胶质瘤细胞可促进血管内皮生长因子的表达,进而促进脑内肿瘤血管的形成[21-22]。本研究通过微流控芯技术检测并利用免疫荧光法进行鉴定,得出96例脑胶质瘤患者中CTC阳性检出率为42.71%,平均数目为(66.27±6.36)/mL,表明微流控芯技术可有效地富集脑胶质瘤患者的外周血CTC,但稍低于其他肿瘤的检出率[20],可能与人体存在血脑屏障有关,这也是脑胶质瘤外周血检测CTC面临的突出问题,同时推测可能也与本研究收集的样本量较小有关。多因素回归分析及ROC曲线分析[23]结果显示,外周血CTC的检测与患者的肿瘤分期、OS、NSE的表达密切相关(P<0.05),提示神经元细胞内NSE异常可能参与了脑胶质瘤患者外周血CTC释放过程。NSE是神经元或神经内分泌细胞分泌的一种特异性蛋白质,当神经元或血脑屏障受损时,大量的NSE释放入血,产生脑部症状,且脑部症状严重程度与NSE浓度呈正比,NSE现主要作为神经母细胞瘤与肺癌脑转移的重要标志物[24-25]。本研究中NSE作为脑胶质瘤预后的一项重要指标,可能通过影响脑胶质瘤的临床分期,进而影响胶质瘤细胞释放入血的水平。
基于以上临床特征的多因素回归分析结果,对患者的预后进行分析,结果显示,两组患者2和3年生存率差异有统计学意义,推测CTC可能与脑胶质瘤患者病程尤其是肿瘤恶化程度相关,患者确诊时间越久,肿瘤的恶化程度就越严重,释放入血的CTC可聚集成灶,进而发生转移,因此,脑胶质瘤患者外周血CTC可作为远期预后的一项重要指标,临床医师可根据患者外周血CTC水平采取相应的干预措施,改善脑胶质瘤患者的预后。脑胶质瘤患者肿瘤组织中GFAP检出结果对其外周血CTC数量影响相对有限,不同GFAP检出情况患者外周血CTC数量差异无统计学意义。原因在于中间丝蛋白GFAP虽然特异表达于正常胶质细胞、肿瘤性星形矫治细胞、室管膜细胞中,但主要作用是维持星形细胞形态和结构功能,继而影响细胞分化。GFAP与脑肿瘤分化密切相关,病情轻微的患者[世界卫生组织(World Health Organization,WHO)分级Ⅱ~Ⅳ级]中枢神经系统低氧损伤程度较轻,GFAP检出结果本身就无显著差异,亦不会显著影响外周血CTC数量。
综上所述,本研究建立的微流控芯技术可定量检测脑胶质瘤患者外周血CTC,其水平与肿瘤分期、OS、NSE的表达密切相关,且直接影响脑胶质瘤患者远期生存率。因此,外周血CTC可作为脑胶质瘤患者诊断、预后尤其是转移的重要指标。
