妇科肿瘤免疫检查点抑制剂临床应用指南
2021-11-17中华医学会妇科肿瘤学分会
中华医学会妇科肿瘤学分会
肿瘤免疫治疗是继手术治疗、化学治疗(化疗)和放射治疗(放疗)后的第4种肿瘤治疗模式。肿瘤免疫机制复杂,长期以来对其认识不足,肿瘤免疫治疗疗效不佳。自2011年伊匹木单抗在美国获批上市以来,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在肿瘤免疫治疗方面取得了突破性进展,特别是在霍奇金淋巴瘤、黑色素瘤等肿瘤的治疗中取得了显著临床疗效。在妇科肿瘤领域,临床研究表明ICI应用于晚期/复发患者具有一定的疗效,国际上已有ICI获批用于妇科肿瘤的临床治疗。近年来,ICI在我国妇科肿瘤临床治疗中已有广泛应用,但缺乏临床规范。为此,中华医学会妇科肿瘤学分会组织专家依据循证医学证据,结合中国国情和临床应用经验,形成《妇科肿瘤免疫检查点抑制剂临床应用指南》(以下简称本指南)。
本指南采用以下推荐级别(表1),无特殊说明者推荐级别均为2A类。

表1 推荐级别及其代表意义
1 免疫检查点抑制剂简介
1987年,Golstein发现了细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte antigen-4,CTLA-4)[1],随后,Allison在小鼠中证实抗CTLA-4抗体促使免疫系统杀伤肿瘤细胞[2-3]。Honjo等于1992年发现了程序性死亡蛋白-1(programmed death-1,PD-1),并在后续研究中证实PD-1是免疫应答的负性调节因子[4-5]。
1.1 作用机制 2006年,Korman等[6]首次正式提出免疫检查点的概念。T细胞表面具有识别抗原信号的T细胞受体和接受调控T细胞活化所需的共刺激分子。较早发现的共刺激分子(如CD28分子和4-1BB分子等)为T细胞活化提供第二信号,使T细胞活化、增殖、分化为效应T细胞。而较晚发现的共刺激分子(如CTLA-4和PD-1)只在活化后的T细胞表达,与配体结合后,阻断活化T细胞的增殖、分化,是机体免疫应答和免疫耐受的重要“刹车”分子。这类发挥负性调节的共刺激分子,被称为免疫检查点分子。
肿瘤微环境中,肿瘤细胞表达相应配体,导致T细胞失能,使肿瘤细胞逃避免疫系统的监视和清除。抗CTLA-4和抗PD-1/程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)的靶向药物通过解除肿瘤细胞对T细胞功能的抑制,从而发挥抗肿瘤效应[6-7]。
1.2 种类和特点 免疫检查点分子包括常见的CTLA-4、PD-1、PD-L1和其他潜在尚未应用于临床的新型免疫检查点分子,如淋巴细胞活化基因3(lymphocyte activation gene 3,LAG-3)、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with immunoglobulin and immunoreceptor tyrosine-based inhibitory domains,TIGIT)、T细胞免疫球蛋白黏蛋白3(T cell immunoglobulin and mucin domain-containing protein 3,TIM-3)、T细胞激活抑制物免疫球蛋白可变区结构域(V-domain immunoglobulin suppressor of T cell activation,VISTA)等[7-8]。
1.2.1CTLA-4及其抗体CTLA-4是由CTLA-4基因编码的一种跨膜蛋白质,表达在活化的CD4+、CD8+T细胞,与配体CD80(B7-1)和CD86(B7-2)结合。CTLA-4中止激活的T细胞反应(T cell response,TCR)以及介导调节性T细胞(regulatory T cell,Treg)的抑制功能。此外,CTLA-4还可介导树突细胞结合CD80/CD86,诱导色氨酸降解酶吲哚胺2,3-双加氧酶的表达,导致TCR的抑制。CTLA-4抗体通过与CTLA-4结合来减少Treg的抑制,激活TCR。目前获批上市的CTLA-4抗体只有伊匹木单抗,其上市时间早,单药治疗效果有限,不良反应较多,在与PD-1抗体联合治疗中有一定前景,可放大后者的抑瘤效应。
1.2.2 PD-1/PD-L1及其抗体 PD-1是CD28超家族成员,有2个配体:PD-L1(又称CD274或B7-H1)和PD-L2(又称CD273或B7-DC)。肿瘤细胞表达PD-L1,与PD-1结合,阻断T细胞激活和细胞因子生成。PD-1/PD-L1抗体通过与PD-1/PD-L1的结合阻断该通路,恢复免疫杀伤功能。在实体瘤的临床研究中发现,PD-1抗体较PD-L1抗体治疗的总体生存获益更佳,而两者的总体不良事件和免疫治疗相关不良事件(immune-related adverse event,irAE)的发生率差异无统计学意义。目前暂无比较PD-1抗体和PD-L1抗体的头对头临床试验的结果[9]。
全球已有13种PD-1/PD-L1抗体药物获批上市(表2),帕博利珠单抗是最早获批的PD-1抗体。国内获批上市的PD-1和PD-L1抗体药物有10种。

表2 全球已批准上市的免疫检查点抑制剂(截至2021年9月1日)
1.3 生物标志物 ICI并非对所有肿瘤有效。寻找生物标志物旨在判断肿瘤的生物学行为和选择精准的治疗手段。有效的生物标志物可筛选出从ICI治疗中获益的人群,监测其疗效和预后。
1.3.1 PD-L1表达 PD-L1是PD-1/PD-L1抗体的直接作用靶点。PD-1/PD-L1抗体的疗效与PD-L1表达水平密切相关。由于肿瘤异质性和不同平台间检测方法的差异,PD-L1并非是预测ICI疗效的理想生物标志物。
PD-1/PD-L1在子宫颈癌和妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN)组织中广泛表达,PD-L1表达阳性的肿瘤对PD-1/PD-L1抑制剂的总体有效率较好。然而,联合治疗发现,无论PD-L1表达是否阳性,均有可能观察到持久的临床反应。
1.3.2 肿瘤突变负荷 通过全外显子测序获得肿瘤基因组中体细胞突变的数量,即肿瘤突变负荷(tumor mutation burden,TMB)。理论上,肿瘤体细胞突变的数量与免疫疗效呈正相关,TMB越高,其表达肿瘤新生抗原的可能性越大,治疗效果越好[10-11]。然而,引起免疫应答攻击的肿瘤新生抗原可能只是小部分基因突变产生,且TMB临界值尚不明确,其作为预测免疫疗效的标志物尚存较大争议[12]。
在子宫内膜癌分子分型中,DNA聚合酶ε(DNA poly-merase ε,POLE)超突变型和微卫星不稳定型(microsatellite instability,MSI)中TMB较高[13],是ICI潜在获益人群。
1.3.3 错配修复缺陷或微卫星高度不稳定 错配修复缺陷(deficient mismatch repair,dMMR)可致MSI,使肿瘤更易发生体细胞突变,其突变基因的数量是错配修复正常(proficient mismatch repair,pMMR)肿瘤的10倍甚至100倍。因此,错配修复(mismatch repair,MMR)状态可用于预测PD-1/PD-L1抑制剂的疗效[14]。
1.3.4 其他生物标志物 还有一些突变基因可作为生物标志物预测免疫治疗效果,包括影响上述基因的JAK家族、DDR基因等;影响抗原呈递的B2M、HLA-DRA等基因;影响肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的PTEN、STK11等基因。此外,研究发现KRAS突变的患者更易从ICI治疗中获益。而EGFR、ALK驱动基因突变的患者,在ICI治疗中可能存在超进展的风险[15]。目前已经有多种标志物用于免疫治疗的用药指导,而不依赖于肿瘤的组织来源。美国食品药品监督管理局(Food and Drug Administration,FDA)于2017年加速批准帕博利珠单抗用于治疗不可切除或转移性微卫星高度不稳定性(microsatellite instability-high,MSI-H)或dMMR的多种实体瘤,2020年加速批准其用于治疗不可切除或转移性肿瘤组织呈现高肿瘤突变负荷[(tumor mutation burden-high,TMB-H),TMB≥10个突变/Mb]的成人和儿童实体瘤患者(既往治疗后疾病进展且没有更佳替代疗法)。2021年加速批准dostarlimab-gxly用于dMMR实体瘤的成人患者(既往治疗后疾病进展且没有更佳替代疗法)。
2 免疫治疗的疗效评价
实体瘤临床疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1是目前最常用的肿瘤药物治疗疗效的评价方法。然而,与化疗直接作用于肿瘤细胞的机制不同,免疫治疗通过激活机体的免疫反应产生抗肿瘤效应,除传统的评价指标外,对免疫治疗的疗效评价有更多的问题需要考虑。为弥补RECIST 1.1在抗肿瘤细胞免疫治疗疗效评价中的不足,已建立新的免疫相关疗效评价标准,但尚待完善。因此,临床实践中仍将RECIST 1.1作为实体瘤临床疗效评价的主要标准,新提出的免疫治疗疗效评价标准仅作为参考。
2.1 免疫相关疗效评价标准 2009年,首个免疫相关疗效评价标准(immune-related response criteria,irRC)对新病灶和疾病进展(progression disease,PD)的定义和划分做出了新规定,随后的临床试验也证实了该标准独特的优越性[16]。然而,irRC使用的双径测量法可重复率较低,在一定程度上可能夸大肿瘤的实际变化程度。因此,irRC没有获得广泛应用。
2.2 实体瘤免疫治疗疗效评价标准 2017年初,RECIST工作组正式提出实体瘤免疫治疗疗效评价标准(immunotherapy response evaluation criteria in solid tumour,iRECIST)[17],该标准提出了全新的疗效评价专业术语。
首先,标识疗效反应类型时加前缀“i”(免疫),如免疫完全缓解(immune complete response,iCR)、免疫部分缓解(immune partial response,iPR)、免疫疾病稳定(immune stable disease,iSD)等。此外,iRECIST还引入了两个关键概念:待证实的疾病进展(immune unconfirmed progressive disease,iUPD)和已证实的疾病进展(immune confirmed progressive disease,iCPD)。将之前RECIST 1.1评定的PD暂视为iUPD,医生可依据患者的肿瘤类型、疾病分期和临床情况综合判断是否继续治疗,在4~6周时再次评价以获得iCPD。值得注意的是,在此评价模式下,iUPD之后可再次出现iSD、iPR或iCR,即只要iCPD未得到证实,就要不断持续评价并记录未证实的原因。iRECIST创新性地提出了一种循环反复评价模式,一定程度上可捕获免疫治疗下非典型反应类型,如假性进展(pseudoprogression,psPD)和延迟反应(delayed response,DR)的出现。临床上对于psPD和疾病超进展(hyper-progressive disease,HPD)的处理,需要医生结合患者实际临床状态进行慎重评估和决策。
2.3 实体瘤免疫治疗疗效改良评价标准 2018年,Hodi等[18]提出了实体瘤免疫治疗疗效改良评价标准(immune-modified response evaluation criteria in solid tumor,imRECIST),该标准在RECIST 1.1和irRC的基础上,提出了更为科学的单径测量法,并在评定PD时只计算基线可测量病灶,否定了非靶病灶和新病灶在定义PD时的价值。
基于多种免疫相关疗效评价标准的应用,被传统标准评定为PD的患者不再轻易被终止免疫治疗。疾病进展后继续免疫治疗(treatment beyond progression,TBP)可能有临床获益。目前仍不清楚接受TBP后的肿瘤缩小是TBP的作用,还是免疫治疗的后续效应,因此,应充分评估以平衡TBP的获益与风险。
此外,针对肿瘤免疫治疗中出现的非典型反应模式,如DR、混合缓解(mixed responses)、psPD和HPD等[19-21],提出了多种免疫相关疗效评价标准。然而,这些反应模式发生率较低。psPD发生率一般<10%[22]。2016年第1次报道的HPD总体发生率为9.2%,65岁以上老年患者发生率较高,为19.4%[21]。大部分患者的临床疗效反应类型仍然符合传统的RECIST 1.1。
3 临床应用
在妇科肿瘤领域,ICI目前主要用于晚期/复发子宫内膜癌、子宫颈癌、卵巢癌和GTN化疗失败后的补救治疗。
3.1 子宫内膜癌 子宫内膜癌PD-1/PD-L1的表达比例较高,其中子宫内膜样腺癌表达率为40%~80%,浆液性癌为10%~68%,透明细胞癌为23%~69%[23]。同时,子宫内膜癌也是MSI-H和(或)dMMR发生率较高的肿瘤,可达31.37%[24],TMB-H者占11.2%[25]。晚期/复发子宫内膜癌是ICI治疗获益较多的妇科肿瘤瘤种。
3.1.1 PD-1/PD-L1抑制剂单药治疗 目前ICI应用于晚期/复发子宫内膜癌的证据主要来自于帕博利珠单抗的KEYNOTE系列临床试验。在该系列研究中,一项研究通常覆盖多个瘤种,其中关于子宫内膜癌的数据显示,帕博利珠单抗应用于至少接受过一次标准化疗后进展的晚期或复发患者,MSI-H/dMMR患者客观缓解率(objective response rate,ORR)为53.0%~57.1%[26-27],TMB-H患者ORR为46.7%[28],而PD-L1表达阳性患者ORR为13%[29]。NCI-MATCH(EAY131)研究(NCT02465060)Z1D亚组旨在评估纳武利尤单抗治疗dMMR的非结直肠肿瘤患者。该亚组共入组子宫内膜样腺癌、内膜样腺癌合并其他病理类型、癌肉瘤共17例,其中13例为子宫内膜样腺癌患者,ORR为45.4%;3例完全缓解(complete response,CR)中2例为子宫内膜样腺癌[30]。GARNET研究(NCT02715284)的队列A1为dMMR子宫内膜癌患者(103例),ORR为44.7%,疾病控制率(disease control rate,DCR)为57.3%[31]。基于GARNET研究,2021年4月美国FDA加速批准dostarlimab-gxly用于治疗含铂治疗后进展或复发的dMMR晚期/复发子宫内膜癌成人患者,欧洲药品管理局(European Medicines Agency,EMA)有条件批准其用于治疗含铂治疗后进展或复发的dMMR或MSI-H晚期/复发子宫内膜癌成人患者。
另有研究表明,其他PD-1/PD-L1抑制剂用于MSI-H/dMMR患者的临床获益显著优于微卫星稳定性(microsatellite stabilized,MSS)患者[32-33]。在关于纳武利尤单抗和阿替利珠单抗的研究中,对PD-L1表达进行了检测和亚组分析,但这两项研究均未发现治疗反应率与PD-L1表达有明确的相关性[34-35]。PD-1/PD-L1抑制剂单药用于晚期/复发子宫内膜癌的研究见表3。

表3 PD-1/PD-L1抑制剂单药治疗晚期/复发子宫内膜癌的研究

药物名称DCR(%)(95%CI)mDOR(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)帕博利珠单抗NANANANANANR(2.9~27.0+)25.7(4.9~NR)NR(27.2~NR)263例PR分别为63.7+周、64.7+周、64.3周SD者为24.6周(13.1~24.6)1.8(1.6~2.7)NR(4.3~NR)NANANANA纳武利尤单抗NA总体:68(52~81)PD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NANA总体:NEPD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NANA总体:3.4(2.0~5.4)PD-L1阳性:3.5(1.5~5.9)PD-L1阴性:3.3(2.0~9.1)MSI-H:NEMSS:2.2(1.4~4.0)NA总体:8.7(7.1~NE)PD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NAdostarlimab-gxly队列A1:57.3(47.2~67.0)队列A2:35.2(27.4~43.7)队列A1:NR队列A2:NRNANA阿替利珠单抗NA2例PR者:7.3个月、8.1+个月1.7(0.6~11+)9.6(0.6~11.8+)度伐利尤单抗NANAdMMR:5.5pMMR:1.8dMMR:NRpMMR:11.5阿维鲁单抗NANAdMMR:4.4(1.7~NR)pMMR:1.9(1.6~2.8)dMMR:NRpMMR:6.6(2.0~10.2)
基于上述研究证据,对晚期/复发伴MSI-H/dMMR的子宫内膜癌患者推荐使用帕博利珠单抗单药治疗、纳武利尤单抗单药治疗(2B类)、dostarlimab-gxly单药治疗(2B类)。晚期/复发伴TMB-H的子宫内膜癌患者推荐使用帕博利珠单抗单药治疗。
3.1.2 PD-1/PD-L1抑制剂联合治疗 ICI治疗可使部分患者病情缓解,改善预后,但仍有较多患者呈原发性或获得性耐药。联合治疗主要包括联合化疗、其他免疫治疗、靶向治疗等,旨在发挥不同机制的协同作用,提高疗效。在子宫内膜癌中,联合抗血管生成的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)和化疗已有初步研究结果。
3.1.2.1 联合抗血管生成治疗 抗血管生成药物可逆转血管内皮生长因子导致的免疫抑制效应,促进T细胞和其他免疫效应分子活化;而ICI可通过激活效应T细胞,促进肿瘤血管正常化,从而增强效应T细胞的浸润和杀伤功能[36]。
KEYNOTE-146/Study111(NCT02501096)研究是一项Ⅰb/Ⅱ期、多中心、开放标签的单臂研究,旨在评估帕博利珠单抗联合仑伐替尼用于既往接受不超过二线化疗且有可测量病灶的晚期子宫内膜癌患者的疗效和安全性,主要研究终点的24周ORR为38.0%;非MSI-H/dMMR患者ORR为37.2%,MSI-H/dMMR患者ORR为63.6%。对于既往接受过治疗的患者,无论MSI状态如何,中位缓解持续时间(duration of response,DOR)为21.2个月,中位无进展生存(progression-free survival,PFS)时间为7.4个月,中位总生存(overall survival,OS)时间为16.7个月[37]。该研究结果表明,联合方案用于治疗复发子宫内膜癌,不仅在MSI-H患者中疗效显著,而且在MSS患者中的疗效也优于帕博利珠单抗单药治疗。基于该研究的中期分析数据,美国FDA于2019年9月加速批准帕博利珠单抗联合仑伐替尼用于既往接受系统治疗后出现疾病进展的晚期/复发非MSI-H/dMMR子宫内膜癌患者(不适宜手术或放疗者)。
基于KEYNOTE-146/Study111研究,KEYNOTE-775/Study309研究(NCT03517449)是一项多中心、开放标签、随机对照Ⅲ期临床研究,比较了帕博利珠单抗联合仑伐替尼治疗方案与医生选择治疗方案(多柔比星或紫杉醇周疗)用于既往至少接受过一线含铂药物治疗的晚期/复发子宫内膜癌患者的疗效和安全性,该研究共入组827例患者,主要研究终点为PFS和OS。与医生选择治疗方案相比,帕博利珠单抗联合仑伐替尼治疗使pMMR患者中位PFS时间延长2.8个月,复发或死亡风险降低40%;中位OS时间延长5.4个月,死亡风险降低32%;ORR提高15.2%。而对于整体患者人群,中位PFS时间延长3.4个月,复发或死亡风险降低44%;中位OS时间延长6.9个月,死亡风险降低38%;ORR提高17.2%[38]。该研究表明,在既往至少接受过一线含铂药物治疗的晚期/复发子宫内膜癌患者中,帕博利珠单抗联合仑伐替尼治疗可改善包括pMMR在内全部患者的预后。基于该研究数据,美国FDA于2021年7月正式批准帕博利珠单抗联合仑伐替尼用于既往接受系统治疗后出现疾病进展的晚期/复发非MSI-H/dMMR子宫内膜癌患者(不适宜手术或放疗者)。
基于上述研究证据,推荐帕博利珠单抗联合仑伐替尼用于非MSI-H/dMMR晚期/复发子宫内膜癌(1类)。
3.1.2.2 联合化疗 联合化疗的协同机制可能是由于化疗可提高肿瘤的抗原呈递和免疫原性[39]、诱导肿瘤细胞PD-L1表达[40],肿瘤微环境中的效应T细胞通过减弱基底层细胞介导的化疗抵抗,增强化疗药物效果等[41]。
BTCRC-GYN15-013研究(NCT02549209)是一项评估帕博利珠单抗联合紫杉醇/卡铂应用于既往至少接受过一线化疗、无铂间期>6个月的晚期/复发子宫内膜癌患者的多中心、单臂Ⅱ期临床研究。该研究ORR为74.4%,中位PFS时间为9个月;pMMR者的中位PFS时间为9个月,dMMR者尚未达到[42]。与既往研究相比,患者ORR和PFS时间显著改善,不良反应未超预期。
鉴于目前ICI联合化疗用于晚期/复发子内膜癌治疗的证据有限,尚不足以推荐临床应用。
3.2 子宫颈癌 子宫颈癌患者的MSI-H比例较低(2.62%)[24],但TMB-H者占比为14.9%[25],PD-L1表达率较高,可达34.4%~96.0%[43],提示PD-1抑制剂有可能用于晚期/复发子宫颈癌的治疗。
3.2.1 PD-1抑制剂单药治疗 在KEYNOTE系列研究中纳入的晚期/复发子宫颈癌患者的数据显示,PD-L1表达阳性者对帕博利珠单抗治疗的ORR为14.6%~17.0%[44-45]。另有数项Ⅰ/Ⅱ期临床研究结果表明,纳武利尤单抗在晚期/复发子宫颈癌的治疗中也有一定疗效,ORR为4.0%~26.3%[34,46-47](表4)。KEYNOTE-158和JapicCTI-163212研究均根据纳入病例的PD-L1表达状况进行亚组分析,结果表明PD-L1表达阳性者对PD-1抑制剂的反应性较好[34,45]。对于晚期/复发子宫颈癌患者,PD-L1可能是较为可靠的生物标志物。

表4 PD-1/PD-L1抑制剂治疗晚期/复发子宫颈癌的研究

药物名称DCR(%)(95%CI)mDOR(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)帕博利珠单抗305.4(4.1~7.5)2(2~3)11(4~15)总体:30.6(21.7~40.7)PD-L1阳性:32.9(22.9~44.2)PD-L1阴性:20(4.3~48.1)总体:NRPD-L1阳性:NRPD-L1阴性:NR总体:2.1(2.0~2.2)PD-L1阳性:2.1(2.1~2.3)PD-L1阴性:NA总体:9.4(7.7~13.1)PD-L1阳性:11(9.1~14.1)PD-L1阴性:NA纳武利尤单抗总体:75(59~87)PD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NA总体:NE(3.0~NE)PD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NA总体:5.6(2.8~7.1)PD-L1阳性:5.5(2.8~7.1)PD-L1阴性:6.2(1.4~7.1)MSI-H:NAMSS:5.9(2.5~7.1)总体:NE(NE~NE)PD-L1阳性:NAPD-L1阴性:NAMSI-H:NAMSS:NA68.4(43.4~87.4)NR(23.3~29.5)5.1(1.9~9.1)21.9(15.1~NR)403.83.5(1.9~5.1)14.5(8.3~26.8)赛帕利单抗53.66(37.43~69.34)NANANA
基于KEYNOTE-158研究的子宫颈癌队列,2018年6月,美国FDA加速批准帕博利珠单抗用于治疗化疗期间或化疗后疾病进展的PD-L1联合阳性评分(combined positive score,CPS)≥1分的复发或转移性子宫颈癌患者。
EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9研究(NCT03257267)[49]是一项比较西米普利单抗与医生选择的化疗方案(培美曲塞、长春新碱、拓扑替康、伊立替康或吉西他滨)治疗既往一线含铂化疗进展后的晚期或转移性子宫颈癌患者的多中心、开放标签、随机对照Ⅲ期临床研究,共入组608例患者,主要研究终点为OS。由于西米普利单抗组鳞癌患者的OS显著获益而提前终止研究。中期分析提示:在整体人群中,与化疗组相比,西米普利单抗组患者PFS时间显著延长,复发或死亡风险降低25%(HR=0.75,95%CI为0.63~0.89,P=0.00048);OS时间显著延长3.5个月(12.0个月 vs 8.5个月),死亡风险降低31%(HR=0.69,95%CI为0.56~0.84,P=0.00011)。西米普利单抗组患者的ORR为16%(95%CI为13%~21%,P=0.00004),中位反应持续时间为16个月;化疗组患者的ORR为4%,中位反应持续时间为7个月。在鳞癌和腺癌亚组中,趋势与总人群一致:西米普利单抗组患者预后显著改善。该研究表明,与单药化疗相比,西米普利单抗可显著改善既往一线含铂化疗进展后的晚期或转移性子宫颈癌患者的OS,与PD-L1表达状况和组织学类型无关。
基于以上研究证据,推荐帕博利珠单抗用于治疗PD-L1表达阳性或dMMR/MSI-H、TMB-H的晚期/复发子宫颈癌患者。推荐西米普利单抗用于治疗晚期/复发子宫颈癌患者(2B类)。对于其他PD-1/PD-L1抑制剂的证据有限,尚不足以推荐临床应用。
3.2.2 PD-1/PD-L1抑制剂联合治疗 由于ICI单药治疗晚期/复发子宫颈癌的临床获益并不满意,一些联合化疗/放疗、多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂、小分子TKI和免疫治疗联合应用的临床试验正在进行中,已有相关结果见表5[50-56]。
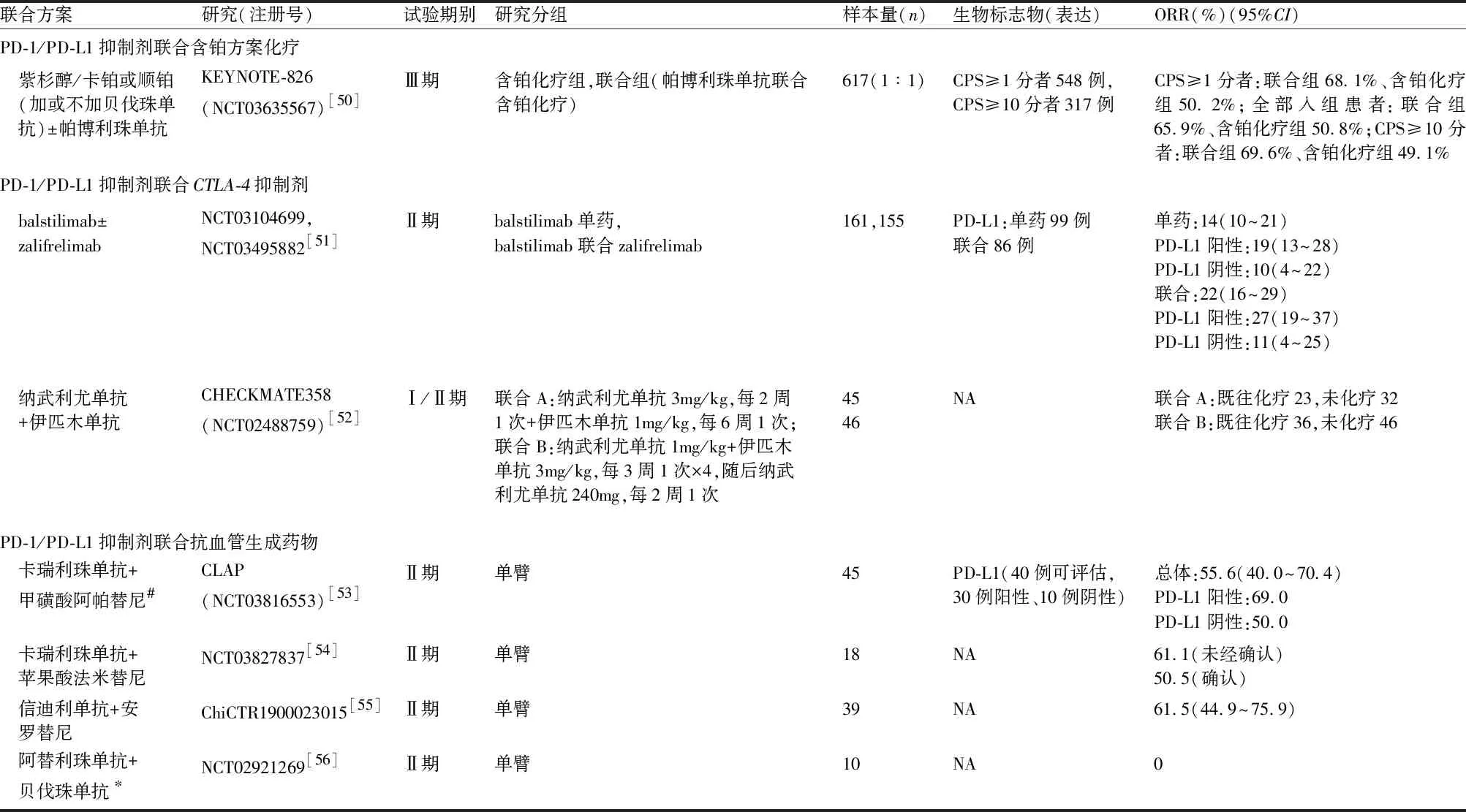
表5 PD-1/PD-L1抑制剂联合治疗晚期/复发子宫颈癌的研究

联合方案DCR(%)(95%CI)mDOR(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)PD-1/PD-L1抑制剂联合含铂方案化疗 紫杉醇/卡铂或顺铂 (加或不加贝伐珠单抗)±帕博利珠单抗NACPS≥1分者:联合组18.0个月、含铂化疗组10.4个月;全部入组患者:联合组18.0个月、含铂化疗组10.4个月;CPS≥10分者:联合组21.1个月、含铂化疗组9.4个月CPS≥1分者:联合组10.4个月、含铂化疗组8.2个月(HR=0.62,95%CI为0.50~0.77,P<0.001);全部入组患者:联合组10.4个月、含铂化疗组8.2个月(HR=0.65,95%CI为0.53~0.79,P<0.001);CPS≥10分者:联合组10.4个月、含铂化疗组8.1个月(HR=0.58,95%CI为0.44~0.77,P<0.001)CPS≥1分者:联合组24个月OS率53.0%,含铂化疗组41.7%(HR=0.64,95%CI为0.50~0.81,P<0.001);全部入组患者:联合组50.4%,含铂化疗组40.4%(HR=0.67,95%CI为0.54~0.84,P<0.001);CPS≥10分者:联合组54.4%,含铂化疗组44.6%(HR=0.61,95%CI为0.44~0.84,P=0.001)PD-1/PD-L1抑制剂联合CTLA-4抑制剂 balstilimab± zalifrelimabNA单药:15.4(1.1+~15.4)联合:NR(1.3+~16.6+)NANA 纳武利尤单抗 +伊匹木单抗NANA联合A:既往化疗3.6(1.9~5.1)未化疗13.8(2.1~NR);联合B:既往化疗5.8(3.5~17.2)未化疗8.5(3.7~NR)联合A:既往化疗10.3(7.9~15.2)未化疗NR(17.4~NR);联合B:既往化疗25.4(17.5~NR)未化疗NR(13.9~NR)PD-1/PD-L1抑制剂联合抗血管生成药物 卡瑞利珠单抗+ 甲磺酸阿帕替尼82.2(67.9~92.0)NR(5.6~NE)总体:8.8(5.6~NE)PD-L1阳性:NR(5.8~NE)PD-L1阴性:5.2(1.8~NE)NR(11.6~NE)卡瑞利珠单抗+ 苹果酸法米替尼83.3NA12.3(3.2~NR)NA 信迪利单抗+安 罗替尼94.9(80.7~98.8)NANRNA 阿替利珠单抗+ 贝伐珠单抗∗60NA2.9(1.8~6.0)8.9(3.4~21.9)
KEYNOTE-826研究[50](NCT03635567)是一项随机、双盲、安慰剂对照的Ⅲ期临床研究,探索帕博利珠单抗联合含铂化疗(加或不加贝伐珠单抗)应用于持续性、复发性或转移性子宫颈癌患者一线治疗的疗效与安全性,该研究共入组617例既往未行化疗且不适于放疗或手术的持续性、复发性或转移性子宫颈鳞癌、腺癌或腺鳞癌患者,其中CPS≥1分者548例,CPS≥10分者317例,主要研究终点为PFS和OS。研究结果提示,在CPS≥1分者、全部入组患者、CPS≥10分者中,帕博利珠单抗联合含铂化疗组、含铂化疗组患者的中位PFS时间分别为10.4个月和8.2个月(HR=0.62,95%CI为0.50~0.77,P<0.001),10.4个月和8.2个月(HR=0.65,95%CI为0.53~0.79,P<0.001),10.4个月和8.1个月(HR=0.58,95%CI为0.44~0.77,P<0.001)。在CPS≥1分者、全部入组患者、CPS≥10分者中,帕博利珠单抗联合含铂化疗组、含铂化疗组患者24个月OS率分别为53.0%和41.7%(HR=0.64,95%CI为0.50~0.81,P<0.001),50.4%和40.4%(HR=0.67,95%CI为0.54~0.84,P<0.001),54.4%和44.6%(HR=0.61,95%CI为0.44~0.84,P=0.001)。该研究提示,与含铂化疗组相比,帕博利珠单抗联合含铂化疗可显著改善患者的PFS和OS。
基于以上研究证据,推荐帕博利珠单抗联合含铂化疗(加或不加贝伐珠单抗)应用于持续性、复发性或转移性宫颈癌患者一线治疗(1类)。其他联合治疗方案尚不足以推荐临床应用。
3.3 晚期和复发卵巢恶性肿瘤 大多数卵巢癌为浆液性上皮性卵巢癌,MSI-H者很少,有报道仅占1.37%[24],TMB-H者占1.47%[57],PD-L1表达者占10%~30%[58]。一般认为卵巢癌在妇科肿瘤免疫治疗中疗效最差。
3.3.1 PD-1/PD-L1抑制剂单药治疗 ICI单药治疗卵巢癌的临床试验多数处于Ⅰ~Ⅱ期,对于晚期/复发卵巢癌患者,总体反应率不高,目前数据显示ORR为5.9%~22.2%[59-66]。NINJA研究[61]和JAVELIN Ovarian 200研究[66]提示,与化疗相比,单独应用ICI并未改善患者预后。目前的研究结果见表6。

药物名称DCR(%)(95%CI)mDOR(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)BMS-93655924NANANA纳武利尤单抗45(23.1~68.5)纳武利尤单抗:36.1吉西他滨或PLD:60.5NA纳武利尤单抗:18.7(2.5~NE)吉西他滨或PLD:7.4(3.0~10.3)3.5(1.7~3.9)纳武利尤单抗:2.0(1.9~2.2)吉西他滨或PLD:3.8(3.6~4.2)HR=1.5,P=0.00220(7.0~NR)纳武利尤单抗:10.1(8.3~14.1)吉西他滨或PLD:12.1(9.3~15.3)HR=1.0,P=0.808(主要研究终点)帕博利珠单抗38.4总体:22.1(18.0~26.6)CPS≥1分:24.0(17.4~31.6)CPS≥10分:27.7(17.3~40.2)队列A:22.1(17.4~27.4)CPS≥1分:24.8(16.7~34.3)CPS≥10分:25.6(13.5~41.2)队列B:22.0(14.0~31.9)CPS≥1分:22.4(11.8~36.6)CPS≥10分:31.8(13.9~54.9)NR(20.5+~30.4+)总体:10.2(3.3+~35.4+)队列A:8.3(3.9~35.4+)队列B:23.6(3.3+~32.8+)1.9(1.8~3.5)队列A:2.1(2.1~2.2)CPS≥1分:2.1(2.1~2.8)CPS≥10分:2.1(2.1~4.2)队列B:2.1(2.1~2.6)CPS≥1分:2.1(2.1~3.3)CPS≥10分:2.1(2.0~8.3)13.8(6.7~18.8)队列A:18.7(17.0~22.5)CPS≥1分:20.6(15.2~23.2)CPS≥10分:21.9(12.9~26.8)队列B:17.6(13.3~24.4)CPS≥1分:20.7(13.6~27.4)CPS≥10分:24.0(14.5~NR)阿替利珠单抗22.22例PR者为8.1个月和30.6+个月2.9(1.3~5.5)11.3(5.5~27.7)阿维鲁单抗52NA2.6(1.4~2.8)TPS≥1%+/-:2.7/1.4TPS≥5%+/-:2.7/2.2肿瘤浸润免疫细胞≥10%+/-:1.5/2.611.2(8.7~15.4)TPS≥1%+/-:13.8/7.0TPS≥5%+/-:10.6/11.9肿瘤浸润免疫细胞≥10%+/-:11.1/11.9阿维鲁单抗单药:33(26~40)阿维鲁单抗+PLD:57(50~65)PLD单药:49(42~56)阿维鲁单抗单药:9.2(8.4~NE)阿维鲁单抗+PLD:8.5(5.8~NE)PLD单药:13.1(7.4~NE)阿维鲁单抗单药:1.9(1.8~1.9)阿维鲁单抗+PLD:3.7(3.3~5.1)PLD单药:3.5(2.1~4.0)联合∶PLD:HR=0.78(93.1%CI:0.59~1.24),P=0.030阿维鲁单抗∶PLD:1.68(1.32~2.60),P>0.99阿维鲁单抗单药:11.8(8.9~14.1)阿维鲁单抗+PLD:15.7(12.7~18.7)PLD单药:13.1(11.8~15.5)联合∶PLD:HR=0.89,P=0.21阿维鲁单抗∶PLD:HR=1.14(0.95~1.58),P=0.83
基于帕博利珠单抗已获批dMMR/MSI-H和TMB-H泛瘤种适应证,仅推荐帕博利珠单抗用于治疗伴有dMMR/MSI-H或TMB-H的复发卵巢癌患者(2B类)。其他ICI数据更加有限,尚不足以推荐临床应用。
3.3.2 PD-1/PD-L1抑制剂联合化疗 ICI单药治疗卵巢癌效果欠佳,一些研究探索了ICI联合化疗的模式[66-70]。JAVELIN Ovarian 100研究探索在初治卵巢癌患者中,一线紫杉醇+卡铂化疗联合阿维鲁单抗和维持治疗的疗效,结果表明,与单纯化疗组相比,联合阿维鲁单抗治疗和维持治疗患者PFS时间并未获益,该研究提前中止[67]。对于铂耐药复发卵巢癌,部分联合化疗的研究提示,与既往单药治疗相比,联合治疗ORR有一定程度提高,但反应时间较短。Ⅲ期研究(JAVELIN Ovarian 200)显示联合治疗无明显额外获益[66](表7)。

表7 PD-1/PD-L1抑制剂联合化疗治疗晚期/复发卵巢癌的研究

联合方案DCR(%)(95%CI)mDOR(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)PD-1/PD-L1抑制剂联合化疗 紫杉醇/卡铂± 阿维鲁单抗NANA化疗→Ave组:16.8(13.5~NE);化疗+Ave→Ave组:18.1(14.8~NE);化疗→对照组:NE(18.2~NE);与化疗→对照组比较,PFS时间均未改善,超过了预定的无效界限,试验终止(主要研究终点)NA PLD+阿维鲁单抗阿维鲁单抗单药:33(26~40)阿维鲁单抗+PLD:57(50~65)PLD单药:49(42~56)阿维鲁单抗单药:9.2(8.4~NE)阿维鲁单抗+PLD:8.5(5.8~NE)PLD单药:13.1(7.4~NE)阿维鲁单抗单药:1.9(1.8~1.9);阿维鲁单抗+PLD:3.7(3.3~5.1);PLD单药:3.5(2.1~4.0);联合:PLD:HR=0.78(93.1%CI:0.59~1.24),P=0.030;阿维鲁单抗:PLD:1.68(1.32~2.60),P>0.99阿维鲁单抗单药:11.8(8.9~14.1);阿维鲁单抗+PLD:15.7(12.7~18.7);PLD单药:13.1(11.8~15.5);联合:PLD:HR=0.89,P=0.21;阿维鲁单抗:PLD:HR=1.14(0.95~1.58),P=0.83 PLD+度伐利尤单抗NANA5.5(0.3~28.8+)17.6(1.7~32.5+)PLD+帕博利珠单抗CBR:52.2(30.6~73.2)(主要研究终点)NA8.1(1.7~14.7)18.3(9.4~31.5)帕博利珠单抗+ 吉西他滨+顺铂88.94.96.2(3.78~8.26)11.3(6.35~21.97)
基于这些研究,对于卵巢癌患者,目前尚不足以推荐PD-1/PD-L1抑制剂联合化疗的临床应用。
3.3.3 PD-1/PD-L1抑制剂联合靶向药物 ICI联合靶向药物的多数研究尚在进行中,已有结果的主要研究汇总见表8[54,71-79]。与抗血管生成药物的联合治疗目前仅有Ⅰ~Ⅱ期的研究结果,总体ORR为15%~32%[54,72-74]。与PARP抑制剂的联合治疗方面,在奥拉帕利联合度伐利尤单抗应用于gBRCA突变的铂敏感患者的MEDIOLA研究(NCT02734004)中ORR达71.9%[75],但在尼拉帕利联合帕博利珠单抗应用于铂耐药患者的TOPACIO/KEYNOTE-162研究(NCT02657889)中ORR仅为18%[76]。在与其他ICI联合治疗的NRG GY003研究(NCT02498600)中,与纳武利尤单抗单药相比,联合伊匹木单抗治疗患者的ORR显著提高(31.4% vs 12.2%)(OR=3.28,85%CI为1.54~NE,P=0.034),mPFS时间显著延长(3.9个月 vs 2.0个月,HR=0.528,95%CI为0.339~0.821,P=0.004),mOS时间延长,但差异无统计学意义(28.1个月 vs 21.8个月,HR=0.789,95%CI为0.439~1.418,P=0.43)[71]。

表8 PD-1/PD-L1抑制剂联合靶向药物治疗晚期/复发卵巢癌的研究

联合方案DCR(%)(95%CI)mDOR时间(月)(95%CI)mPFS时间(月)(95%CI)mOS时间(月)(95%CI)PD-1/PD-L1抑制剂联合CTLA-4抑制剂 纳武利尤单抗±伊匹木单抗NANA纳武利尤单抗单药组:2.0;联合治疗组:3.9(HR=0.528,0.339~0.821,P=0.004)纳武利尤单抗单药组:21.8;联合治疗组:28.1(HR=0.789,0.439~1.418,P=0.43)PD-1/PD-L1抑制剂联合抗血管生成药物 阿替利珠单抗+贝伐珠单抗55(31.5~76.9)NR(11.3~NR)4.9(1.2~20.2)10.2(1.2~26.6)纳武利尤单抗+贝伐珠单抗总体:55.3铂耐药:33.3铂敏感:75NA总体∗∗:9.4(6.7~NA)铂耐药:7.7(4.7~NA)铂敏感:12.1(8.4~NA)NA 帕博利珠单抗+仑伐替尼74(55~88)NR(1.5+~7.9+)4.4(4.0~8.5)NA 卡瑞利珠单抗+苹果酸法米替尼62.5NA4.2(2.1~6.2)NAPD-1/PD-L1抑制剂联合PARP抑制剂 奥拉帕利+度伐利尤单抗28周DCR:65.6(90%CI:49.6~79.4)10.211.1(8.2~15.9)NR 尼拉帕利+帕博利珠单抗65(90%CI:54~75)NA3.4(2.1~5.1)NA多种治疗方式联合 口服环磷酰胺+帕博利珠单抗 +贝伐珠单抗总体:95铂耐药:93.3铂敏感:1005.9(3.6~11.3)总体:10.0(90%CI:6.5~17.4)铂耐药:7.6(90%CI:5.7~10.3)铂敏感:20.2(90%CI:6.0~NR)NA 奥拉帕利+度伐利尤单抗 ±贝伐珠单抗24周DCR(主要研究终点)三药联合组:77.4(90%CI:61.7~88.9)双药联合组:28.1(90%CI:15.5~43.9)三药联合组:11.1(IQR:7.4~16.4)双药联合组:6.9(IQR:5.4~11.1)三药联合组:14.7(10.0~18.1)双药联合组:5.5(3.6~7.5)NA 紫杉醇/卡铂±贝伐珠单抗± talazoparib±阿维鲁单抗NANA联合维持组PFS时间无显著获益,研究中止 紫杉醇/卡铂+贝伐珠单抗 ±阿替利珠单抗NANA阿替利珠单抗联合组:19.5(18.1~20.8);PD-L1阳性:20.8(19.1~24.2);对照组:18.4(17.2~19.8);PD-L1阳性:18.5(16.6~21.4);mPFS时间两组间:HR=0.92(0.79~1.07),P=0.2785;PD-L1阳性两组间:HR=0.80(0.65~0.99),P=0.0376(主要研究终点),(P≤0.002认为阳性)阿替利珠单抗联合组:NE;PD-L1阳性:NE;对照组:NE;PD-L1阳性:31.2(30.0~NE);mOS时间两组间:HR=0.96(0.74~1.26),P=0.7887;PD-L1阳性两组间:HR=0.98(0.68~1.41);P=0.9083(OS中期分析)
基于以上研究,PD-1/PD-L1抑制剂联合某些靶向药物虽然显示出一定疗效,但尚待更多研究证据,暂不足以推荐临床应用。
3.4 妊娠滋养细胞肿瘤 多项研究证实,PD-L1在GTN组织中广泛表达。因此,PD-1/PD-L1抑制剂可能是治疗耐药GTN的选择之一。目前的疗效报道多数来自于个案报道,综合Ghorani等[80]、Huang等[81]和Choi等[82]报道的病例,7例耐药GTN患者给予帕博利珠单抗治疗后,3例绒毛膜癌和2例胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)患者获得CR,1例上皮样滋养细胞肿瘤(epithelioid trophoblastic tumor,ETT)患者获得部分缓解(partial response,PR)并仍在继续治疗中,1例PSTT合并ETT患者对免疫治疗无反应。
一项回顾性研究显示,8例耐药复发GTN患者应用帕博利珠单抗治疗,4例持续缓解无复发,1例在缓解后再次复发,3例对治疗无反应[83]。TROPHIMMUN研究(NCT03135769)是一项评估阿维鲁单抗对耐药GTN治疗的Ⅱ期研究,化疗耐药GTN患者在经过平均9个周期阿维鲁单抗治疗后,人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)水平降至正常,国际妇产科联盟预后评分和分期与阿维鲁单抗治疗的疗效可能无关[84]。北京协和医院正在进行一项卡瑞利珠单抗联合甲磺酸阿帕替尼治疗复发/耐药GTN的Ⅱ期单臂临床研究,20例患者的ORR为55%,其中CR为50%(10/20)[85]。
基于以上研究结果,推荐对耐药/复发的GTN患者,可以选择单药使用PD-1/PD-L1抑制剂(帕博利珠单抗、阿维鲁单抗、卡瑞利珠单抗)或联合治疗(2B类)。
3.5 外阴/阴道癌
3.5.1 外阴/阴道黑色素瘤 晚期皮肤黑色素瘤应用ICI疗效显著,特别是伊匹木单抗与纳武利尤单抗联合治疗有效率可达53%[86],且具有显著生存获益,已成为标准治疗。然而目前缺乏ICI治疗生殖道恶性黑色素瘤的临床试验,仅有的数据来自回顾性报道[87]:4例应用伊匹木单抗,2例应用帕博利珠单抗,1例应用纳武利尤单抗,治疗反应率为28.5%。应用PD-1抑制剂治疗患者的PFS时间长于应用CTLA-4抑制剂者。
借鉴皮肤黑色素瘤ICI治疗经验,推荐帕博利珠单抗和/或伊匹木单抗用于晚期/复发外阴黑色素瘤(2B类)和晚期/复发阴道及子宫颈黑色素瘤的治疗(3类)。
3.5.2 外阴/阴道鳞癌 外阴/阴道鳞癌应用ICI治疗的研究较少。
KEYNOTE-158研究(NCT02628067)是一项评估帕博利珠单抗治疗晚期实体瘤的多队列研究。外阴癌队列,共入组101例晚期患者,其中84例(83.2%)患者为PD-L1阳性肿瘤,ORR为10.9%,中位PFS时间为2.1个月,中位OS时间为6.2个月,中位持续反应时间为20.4个月[88]。该研究共对71例患者进行了TMB分析,其中12例为TMB-H,ORR为16.7%;59例为非TMB-H,ORR为3.4%[28]。
CheckMate 358研究(NCT02488759)共入组5例复发/转移的外阴/阴道癌患者,纳武利尤单抗治疗的ORR为20%,12个月和18个月的OS率为40%和20%,6个月的PFS率为40%[46]。
基于以上研究证据,推荐帕博利珠单抗用于治疗PD-L1表达阳性或dMMR/MSI-H、TMB-H的晚期或复发外阴癌患者(2B类),推荐纳武利尤单抗用于治疗晚期或复发外阴/阴道癌患者(2B类)。
4 免疫治疗相关不良事件及其处理
随着ICI临床应用越来越多,其导致的irAE逐渐引起了人们的重视,irAE的处理已成为目前亟待解决的重要临床问题。2017年,欧洲肿瘤内科学会(European Society of Medical Oncology,ESMO)首次发表了《免疫治疗的毒性管理:ESMO诊断、治疗和随访临床实践指南》[89]。同年,美国肿瘤免疫治疗学会(Society for Immunotherapy of Cancer,SITC)毒性管理工作组也发布了ICI毒性管理共识[90]。2018年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)联合美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)发布了《免疫检查点抑制剂治疗相关毒性的管理指南》并每年更新,现已更新至2021年第3版[91]。这些指南对于临床防治irAE具有重要指导价值。
4.1 irAE的发生机制和特点 ICI调节T细胞活性所导致的免疫激活,在攻击肿瘤细胞的同时也对正常细胞造成损伤,引起irAE,从而出现相应器官的自身免疫样炎症反应[92]。
irAE可在治疗中的任意时间发生,也可在治疗结束后数月才发生。若ICI联合治疗,则irAE发生风险增加且发生时间常提前。irAE与药物种类、肿瘤类型、疾病状态有关。CTLA-4抑制剂irAE发生率和严重程度均高于PD-1/PD-L1抑制剂,而PD-1抑制剂与PD-L1抑制剂的irAE发生率基本相当[9]。
4.2 irAE的分级 irAE从无症状到严重或危及生命,分为5个级别:G1,轻度不良反应;G2,中度不良反应;G3,重度不良反应;G4,危及生命的不良反应;G5,不良反应相关死亡(附录1)。

附录1 妇科肿瘤常见irAE的分级和处理
4.3 妇科肿瘤患者常见irAE irAE可累及全身各个器官和组织,其中以皮肤、结肠、内分泌器官、肝、肺较为常见,而心血管系统、神经系统、肾脏、眼部较为罕见。ICI所致的irAE多数为轻至中度,CTLA-4抑制剂所致的任意级别和严重的irAE发生率分别为77%和24%;PD-1/PD-L1抑制剂分别为26.82%和6.10%[93-94]。
ICI所致死亡总体发生率不高,CTLA-4抑制剂的致死率为1.08%,多归因于结肠炎(70%);PD-1抑制剂为0.36%,PD-L1抑制剂为0.38%,多归因于肺炎(35%)、肝炎(22%)及神经毒性(15%);PD-1/PD-L1抑制剂联合CTLA-4抑制剂为1.23%,多归因于结肠炎(37%)和心肌炎(25%)[95]。
值得注意的是,真实世界病例不良反应发生率可能高于临床研究和文献报道,并且联合治疗常常会增加irAE的发生率和严重程度。
在妇科肿瘤临床研究中,应用ICI的安全性与已知其他瘤种中单药及其联合用药的安全性基本一致。ICI常见的irAE多表现为甲状腺功能异常、腹泻等,严重的irAE发生率较低,可表现为肝功能异常、结肠炎等。帕博利珠单抗联合仑伐替尼治疗致甲状腺功能减退的发生率较单药应用升高,为47.2%~57.4%;但≥G3 irAE的发生率仅为0.9%~1.2%。
在卵巢癌临床研究中,PD-L1抑制剂所有级别irAE发生率为16.8%,常见的有甲状腺功能减退和皮疹,G3 irAE发生率为2.4%,有结肠炎、2型糖尿病、肌炎,未见G4或G5不良反应[96]。在卵巢癌中,CTLA-4抑制剂常见的irAE有腹泻、结肠炎、皮疹、肝功能异常等,其中腹泻是最常见的严重irAE。此外,罕见的irAE亦有个案报道,如PD-L1抑制剂治疗后出现重症肌无力致呼吸衰竭[97]。在子宫颈癌中,PD-1抑制剂的G3及以上irAE的发生率为12%~21%,常见的有腹泻、结肠炎、皮疹、肝功能异常、关节痛等[98]。在子宫内膜癌中,常见的irAE有甲状腺功能减退、皮疹、腹泻、肌炎等[33]。当PD-1抑制剂与抗血管生成药物联用时,常见的irAE有肌痛(28.9%)、肝功能异常(26.3%)、肺炎(10.5%)、结肠炎(5.3%)等[73]。
4.3.1 皮肤毒性 皮肤毒性是最常见的irAE,多为轻、中度,PD-1/PD-L1抑制剂所致的任意级别和严重的皮肤毒性发生率分别为17%~40%和<5%,常发生在治疗早期,包括皮疹、瘙痒、白癜风、反应性皮肤毛细血管增生症,甚至严重的大疱性皮炎、Stevens-Johnson综合征/中毒性表皮坏死松解症等[90]。
4.3.2 胃肠道毒性 胃肠道毒性也是比较常见的irAE,主要表现为腹泻、结肠炎,多累及乙状结肠和直肠,发生于上消化道者罕见。临床表现为腹泻、腹痛、大便带血或黏液、发热等,此外还可表现为口腔溃疡、肛门病变(肛瘘、脓肿、肛裂)等。
4.3.3 内分泌毒性 内分泌毒性是另一常见的irAE,包括甲状腺功能异常(甲状腺功能减退、甲状腺功能亢进、甲状腺炎等)和急性垂体炎(垂体功能低下,包括中枢性甲状腺功能减退、中枢性肾上腺功能不足、低促性腺激素引起的性腺功能减退症等),其他较少见的如原发性肾上腺功能减退、1型糖尿病、高钙血症、甲状旁腺功能减退等。患者在ICI治疗期间,如出现乏力、体重增加、脱发、畏寒、便秘、抑郁等症状,需考虑甲状腺功能减退的可能;如出现心悸、出汗、食欲增加、排便增多、体重减轻等症状,需考虑甲状腺功能亢进的可能,进行甲状腺功能检查可确诊。
4.3.4 免疫性肺炎 免疫性肺炎是一类相对少见但有致命危险的irAE,主要临床表现有呼吸困难、咳嗽、发热、胸痛,偶有致呼吸衰竭者,而约1/3的患者无明显症状,仅为影像学异常[98]。在接受PD-1/PD-L1抑制剂治疗的患者中,肺炎发生率<5%,G3及以上的肺炎发生率为0~1.5%[99-103]。但在最近的真实世界研究中,免疫性肺炎的发生率高达19%[103-104]。既往患有慢性阻塞性肺疾病、肺纤维化等,或现患肺部感染者,是免疫性肺炎的高危人群。
4.4 irAE的处理原则 基线评估、仔细筛查、定期监测是基础,早期识别和及时干预是关键。
4.4.1 基线评估 在开始治疗前,应对患者基线情况进行全面评估(附录2),一方面排查有无ICI治疗禁忌,另一方面通过了解基线情况有助于后期判断是否发生了irAE。此外,还应充分告知患者及其家属ICI治疗的潜在风险和不良反应,进行irAE的宣教,当出现相关症状或体征时,患者应及时向医生报告,并及时就诊,防止irAE进一步恶化。因糖皮质激素的使用是否影响ICI疗效仍不明确,故不推荐在ICI治疗前预防性使用糖皮质激素。

附录2 基线评估
4.4.2 监测 在ICI治疗过程中,监测irAE与评价疗效同样重要,特别是联合治疗时,推荐酌情增加监测频次。irAE的监测包括ICI治疗期间的监测和治疗结束后的随访(附录3)。由于部分irAE出现时间较晚,可发生在治疗完成后,故应重视ICI治疗后的随访,推荐:(1)irAE相关检查项目的随访需持续至ICI治疗结束后1年,如甲状腺功能、肝肾功能等;(2)irAE相关症状的监测需持续至ICI治疗结束后的2年。

附录3 irAE监测
4.4.3 处理 应注意早期识别irAE,并按照分级原则进行处理,糖皮质激素是大多数严重irAE治疗的主要药物,irAE处理基本原则见表9[105]。G1~G2一般以对症处理为主,局部外用或口服糖皮质激素,但心、肺、肝和神经系统的irAE来势凶险,首选高剂量静脉滴注糖皮质激素[100]。G3~G4常需要住院治疗,以口服或静脉使用全身糖皮质激素治疗为主。糖皮质激素的使用需及时,否则会影响部分irAE的处理效果,如腹泻、结肠炎等。此外,为防止irAE反复,糖皮质激素治疗应注意遵循足疗程使用和逐步减量的原则,糖皮质激素治疗直至症状改善至 表9 免疫相关不良事件处理基本原则CTC irAE恢复后,应慎重考虑是否再次进行ICI治疗。基于风险-获益比,与患者讨论是否恢复免疫治疗,若停用前肿瘤已达CR或PR,不建议恢复免疫治疗以免再次出现irAE。对于大多数G2~G3的irAE,若症状改善至≤G1,可考虑恢复免疫治疗。若既往为联合治疗,可恢复单药治疗。若恢复ICI治疗,需严密监测以免再次出现irAE。若再次出现,则永久停用该类免疫治疗[106]。 4.5 免疫治疗超进展问题及其处理 在ICI治疗早期,9%~29%的患者出现肿瘤反常加速增长[107-111],导致生存期显著缩短,预后较差,中位OS时间常<3个月,这种现象被称为HPD[112]。目前,HPD被初步定义为:(1)在ICI治疗后第1次评价时疾病进展,或治疗失败时间<2个月;(2)肿瘤生长速率>2倍;(3)肿瘤体积较基线增加>50%。 HPD基本均发生于PD-1/PD-L1抑制剂单药治疗初期,很少发生于CTLA-4抑制剂治疗后,几乎无联合治疗或多疗程治疗后发生HPD的报道。HPD的发生与高龄(>65岁)、肿瘤局部复发、多个转移病灶、肝脏转移、女性患者等因素相关,而抑制性免疫调节、调节性T细胞聚集、异常炎症反应、原癌基因激活、抑癌基因突变等可能是HPD的发生机制,因此,合理筛选ICI患者、密切监测、联合治疗可能是降低HPD发生风险的手段。 一项针对125例接受ICI治疗患者的回顾性研究中,HPD组和非HPD组中几乎相同比例的患者接受了化疗,而化疗后两组患者总体反应率、PFS和OS时间比较差异均无统计学意义,这表明HPD并未显著影响ICI治疗后化疗的效果。进一步分析发现,在HPD组中,ICI治疗后接受化疗的患者OS时间显著长于未接受化疗者(12.3个月 vs 3.2个月,P=0.021)[113]。 一旦出现HPD,患者继续使用免疫治疗获益较少,推荐立即停止免疫治疗,可尝试化疗作为挽救治疗。 5.1 合并自身免疫病患者 自身免疫病是可以累及全身各个器官的疾病,如类风湿关节炎、重症肌无力、系统性红斑狼疮、银屑病、溃疡性结肠炎等,这类患者(如重症肌无力患者)使用ICI可能会加重病情,甚至危及生命,因此,临床应用一定要慎重。然而,肿瘤合并自身免疫病的患者并非完全不能使用ICI,临床应用时需将可能的获益与潜在的风险一并考虑。美国NCCN指南指出,未接受或接受较低剂量免疫抑制剂治疗的自身免疫病患者和病情得到控制的自身免疫病患者可以考虑接受ICI治疗;而神经系统自身免疫病,如重症肌无力、威胁生命的自身免疫病等,则不被视为ICI的适应证[91]。此外,接受高剂量的糖皮质激素治疗或病情处于活动期的自身免疫病患者也应慎用ICI。这是由于二者之间可能存在相互影响:一方面,启动ICI治疗时高剂量的免疫抑制剂可能会影响ICI的疗效[91];另一方面,病情处于活动期的患者接受PD-1抑制剂治疗后,发生自身免疫病反弹或暴发的可能性更大[114],并且这些患者是否以及何时出现毒性反应很难预测和控制。因此,对于合并自身免疫病的肿瘤患者,临床应用ICI时一定要密切监测,尽可能将激素类药物减量至最低时再考虑应用ICI。 5.2 体弱、高龄和人类免疫缺陷病毒感染患者 一般状况较差的患者使用ICI的获益有限,建议临床谨慎使用;而高龄患者可使用ICI。CheckMate 171和CheckMate 153研究分析了体弱和高龄(≥70岁)患者使用PD-1抑制剂治疗的安全性和疗效。在CheckMate 171研究中,103例体弱(美国东部肿瘤协作组体力状况评分为2分)患者的安全性与总人群相似,然而其中位OS时间仅为5.2个月,而总人群为10.0个月。CheckMate 153研究得到了相似的结果。对于高龄患者,在这2项研究中发现其不良事件发生率和中位OS时间与总人群一致,表明单纯高龄并不影响PD-1抑制剂的安全性和疗效[115-116]。但考虑到CTLA-4抑制剂有较高的G3~G4毒性反应,老年患者应慎重使用。 由于临床应用ICI的前提需要有一个功能尚好的免疫系统,因此一般不纳入人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者进行治疗。而前瞻性多中心Ⅰ期临床研究(NCT02595866)和DURVAST Ⅱ期临床研究表明,HIV感染者使用ICI的安全性和疗效与普通人群相比并无差异,且未发现治疗期间HIV被激活[117-118],故认为HIV感染者也可接受ICI治疗,但强调治疗期间仍需继续进行抗病毒治疗。 5.3 骨髓和器官移植、长期使用激素者 进行实体器官或造血干细胞移植的患者需要长期服用免疫抑制剂,以维持同种异体移植的耐受性,并防止排斥所导致的移植物抗宿主病(graft versus-host disease,GVHD)。而临床应用ICI治疗很可能打破免疫耐受,诱发GVHD,甚至可能加快肿瘤进展,因此,移植患者应谨慎使用ICI。一项针对83例实体器官移植患者使用ICI治疗的有效性和安全性的回顾性研究发现,39.8%的患者发生了同种异体移植排斥反应,导致其中71.0%的患者较快发生移植器官衰竭。其中,肾移植患者因采用了血液透析作为器官替代方法,无论是否发生排斥反应,肾移植受者死亡率均相似,从而肯定了在这些患者中使用ICI的安全性;而在肝脏和心脏移植患者中,由于目前尚无器官替代方法,则必须考虑排斥反应的发生风险,考虑移植器官损害的可能性及对患者生存的威胁。因此,建议移植患者在接受ICI治疗前,由移植专家和肿瘤专家共同讨论ICI治疗的风险和可能的获益,并共同制订抢救措施[119]。 另外,长期使用激素者不建议使用ICI。已有研究表明基线使用皮质类固醇(≥10mg泼尼松)的患者在接受PD-1抑制剂治疗后,其PFS和OS时间均明显缩短[120]。 5.4 肝炎患者 肝炎患者可以使用ICI。对于合并乙型肝炎病毒(hepatitis B virus,HBV)感染的患者,需在HBV-DNA载量低于2000U/mL后再开始ICI治疗。若HBV-DNA载量不高,但乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)(+)和(或)乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)(+),也推荐在第1次应用ICI前先给予抗病毒治疗(恩替卡韦或替诺福韦酯),并定期监测HBV-DNA、HBsAg和乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)。对于合并丙型肝炎病毒(hepatitis C virus,HCV)感染者,无需在ICI治疗的同时接受直接抗病毒药物或干扰素抗病毒治疗,但仍需定期监测HCV-DNA水平[121]。 5.5 更换免疫检查点抑制剂 一般不建议患者更换ICI,如既往使用PD-1抑制剂,更换为CTLA-4抑制剂,疗效不会有太大改变,且可能会增加G3~G4 irAE的发生率[91]。 5.6 免疫接种 一项针对127例接受纳武利尤单抗治疗的肺癌患者的回顾性研究表明,未接种疫苗的患者与接受疫苗接种的患者,irAE发生率分别为22%和26%,二者比较差异无统计学意义。此外,疫苗接种与否与治疗中止率没有关系,与对癌症治疗的客观反应性也无关[122]。因此,在ICI治疗过程中可以使用灭活疫苗或灭活制剂的疫苗,如流感疫苗、人乳头瘤病毒疫苗、乙型肝炎疫苗,但不能接种活疫苗。建议注射疫苗前应先咨询疫苗的类型。 5.7 妊娠与哺乳期 妊娠母体对胎儿有天然的免疫耐受,PD-1/PD-L1的相互作用在维持胎儿耐受性中发挥关键作用。因此,孕妇在妊娠期使用ICI尤其是PD-1/PD-L1抑制剂,可能会打破免疫耐受,导致自然流产、死胎和新生儿死亡的巨大风险,而对于孕产妇的风险和新生儿出生缺陷的风险未知,故不推荐妊娠患者使用ICI。但也有案例报道了转移性黑色素瘤孕妇接受纳武利尤单抗和伊匹木单抗联合治疗后顺利分娩的良好结局[123]。目前美国FDA将PD-1抑制剂归为妊娠D类,将伊匹木单抗归为妊娠C类。因此,建议育龄期女性在ICI治疗期间和治疗结束后至少5个月进行严格避孕;有生育需求者在开始ICI治疗前,应到专科进行生育力保护和生殖内分泌咨询;而孕妇在应用ICI治疗前则要根据潜在风险和获益做出个性化的治疗决定。 美国NCCN指南建议哺乳期女性在接受ICI治疗期间和末次给药后至少5个月禁止母乳喂养[91]。不同PD-1抑制剂药代动力学有所差异,其停药时间可能有所不同。目前无法排除帕博利珠单抗和纳武利尤单抗对婴儿和新生儿造成的风险,哺乳期女性应停止哺乳或停止治疗;哺乳期女性接受特瑞普利单抗和卡瑞利珠单抗治疗期间和末次给药后至少2个月停止哺乳,而信迪利单抗至少5个月停止哺乳[121]。 ICI治疗对部分妇科恶性肿瘤患者显示出一定的临床疗效,目前主要用于晚期和复发性癌经常规治疗失败的患者。在三大妇科恶性肿瘤中,以子宫内膜癌疗效较好,其次是子宫颈癌,卵巢癌疗效最差。对于复发耐药的滋养细胞肿瘤患者应用ICI治疗,部分患者可取得显著疗效。应用ICI治疗获得疗效者,可有较长的有效期。应用ICI治疗,筛选治疗优势人群至关重要。目前ICI单药治疗妇科肿瘤临床疗效有限,其与化疗、抗血管生成治疗、PARP抑制剂联合治疗有望提高疗效。临床应用中需严格掌握适应证,排除禁忌证,考虑指南推荐级别。应用ICI可能出现延迟效应、混合效应、psPD或HPD,其疗效评价具有特殊性,应进行合理的疗效评估。ICI在使患者获益的同时,也伴有irAE的发生,可累及全身组织和器官,其不良事件谱独特,大多数不良事件可控,但有少数患者可出现严重不良事件,甚至危及生命。因此,应加强治疗前基线检查评估,提前预防不良事件的发生,做到早期诊断、全程监测、恰当处理。 执笔专家组: 孔北华 刘继红 周 云 高庆蕾 宋 坤 王登凤 陈丽莉 蒋 芳 张国楠 向 阳 谢 幸 马 丁 编审专家组(以姓氏笔画为序): 万小平 马 丁 王丹波 王世宣 王建六 王登凤 王新宇 孔北华 曲芃芃 吕卫国 向 阳 刘继红 杨兴升 杨佳欣 吴小华 吴令英 汪 辉 沈 铿 沈源明 宋 坤 张国楠 陈 刚 陈丽莉 周 云 赵 霞 哈春芳 姜 洁 徐丛剑 高庆蕾 高雨农 郭瑞霞 崔 恒 康 山 梁志清 蒋 芳 程文俊 谢 幸
5 免疫检查点抑制剂应用的注意事项
