SIRT6 对前列腺癌细胞株增殖能力和凋亡水平的影响
2021-11-16王振兴周儒奎杨李旺储开博翟晓艳
裴 亮 ,王振兴 ,周儒奎 ,杨李旺 ,储开博 ,武 赟 ,翟晓艳
(1.山西医科大学第二医院泌尿外科,山西太原030001; 2.山西中医药大学基础医学系,山西晋中030619)
在世界范围内,前列腺癌发病率在男性癌症中排名第二,死亡率排名第六,严重威胁男性的生命健康,随着世界人口老龄化日益严重,发病率和死亡率会持续增长[1]。对于前列腺癌的治疗方式有手术、放射、内分泌和化学治疗等方法。对于晚期的前列腺癌患者主要以改善临床症状和延长生存期为主,基因治疗为前列腺癌的治疗提供了一个新的思路[2]。
SIRT6 属于 SIRT 家族(SIRT1-7)成员之一,主要位于细胞核异染色质中,具有NAD 依赖的组蛋白去乙酰化酶活性和ADP 核糖基转移酶活性。在遗传变异和氧化应激时具有维持基因组稳定性、碱基切除修复和DNA 双链断裂修复的作用,参与细胞的凋亡、炎症、代谢和衰老等过程[3]。
癌症以持续的细胞增殖、能量代谢改变、炎症反应为特点,被认为是一种衰老相关的疾病,SIRT6近年来被认为是一种抗衰老因子,同时对多种肿瘤具有抑制作用。有研究发现在某些肿瘤中SIRT6 的表达下降,同时SIRT6 缺失可引起糖酵解增加和肿瘤生长[3]。然而SIRT6 对前列腺癌的作用如何目前研究很少,本研究拟探讨SIRT6 对前列腺细胞增殖能力和凋亡水平的影响。
1 材料与方法
1.1 主要细胞与试剂
细胞:本实验中所用的前列腺癌细胞株(LNCAP、PC-3、DU145)和前列腺上皮细胞系(RWPE-1)均于上海中国科学院细胞库购买。
主要试剂:CCK-8 试剂盒购买于日本同仁化学研究所,Annexin V-PI 凋亡试剂盒购买于美国Invitrogen 公司,兔抗人SIRT6 多克隆抗体购买于英国 Abcam 公司,鼠抗人 β 肌动蛋白(ACTB)单克隆抗体购买于美国Santacruz 公司,辣根过氧化物酶标记山羊抗兔IgG、山羊抗小鼠IgG 抗体购自北京中杉金桥生物技术有限公司,高灵敏度化学发光检测试剂盒购买于上海汉恒生物科技有限公司,DUB00 型核酸蛋白分析仪购买于美国Beckman Coulter 公司。
1.2 实验方法
1.2.1 Western 印迹法检测细胞中SIRT6 蛋白表达 分别收集前列腺癌细胞株(LNCAP、PC-3、DU145)和前列腺上皮细胞系(RWPE-1)后,用预冷的PBS 冲洗3 次,加入RIPA 裂解液提取总蛋白,冰上孵育 30 min,期间每 10 min 混匀 1 次。4 ℃,12 000 g,离心15 min,用BCA 法检测蛋白浓度。取 30 μg 蛋白加入,经 10% SDS-PAGE 凝胶电泳后,转移至PVDF 膜上,加5%脱脂牛奶常温封闭2 h。加入一抗兔抗人 SIRT6 抗体(1∶1000)和鼠抗人 ACTB 抗体(1∶500),4 ℃过夜,TBST 清洗 3 次,加入1∶2000 辣根过氧化物酶标记的IgG 二抗,室温孵育2 h,加入显影液用图像分析系统采集图像,Image J 软件以ACTB 为参照分析相对灰度值。SIRT6 蛋白相对表达水平=SIRT6 灰度值/ACTB 灰度值。
1.2.2 SIRT6 基因转染 将前列腺癌细胞株PC-3 分为对照组和SIRT6 转染组,委托广州赛业生物科技有限公司构建过表达SIRT6 的质粒。SIRT6 转染组加入SIRT6-过表达质粒转染,使其SIRT6 的表达增高,对照组加入空质粒转染。取对数生长期的PC-3 细胞,按照1×106细胞/孔浓度接种到6 孔板中,当细胞培养至40%~50%融合度时,按照质粒转染说明书,分别加入SIRT6 过表达质粒和空白质粒后,加入Lipofectamine 2000 助染剂,转染72 h后,用Western 印迹法检测转染是否成功(方法同上)。
1.2.3 CCK-8 法检测细胞的增殖能力 将转染72 h 后的PC-3 细胞(对照组和SIRT6 转染组)制备成1×104/mL 的细胞悬液,按照100 μL/孔接种入 96孔板中,置入37 ℃,5% CO2培养箱中培养,分别在培养 0、12、24、36、48 h 后,每孔加入 10 μL CCK-8 试剂,在 37 ℃,5%CO2培养箱中孵育 2 h,在酶标仪测定450 nm 波长处的吸光值(OD450),每组细胞的每个时间点3 个复孔,取各孔平均值,绘制生长曲线。
1.2.4 Annexin V-PI 染色法检测细胞的凋亡水平将转染72 h 后的PC-3 细胞(对照组和SIRT6 转染组),采用细胞刮轻刮细胞,离心收集所有贴壁及死亡后未贴壁的细胞,PBS 清洗3 遍,调整细胞为 5×106/mL,按照说明书,取 100 μL 细胞,分别加入 5 μL 的 Annexin V 工作液和 1 μL PI 工作液,轻轻混匀后,室温避光孵育15 min,流式细胞术检测细胞凋亡水平,凋亡细胞为Annexin-V 阳性细胞。
1.3 统计学方法
使用SPSS 18.0 软件进行统计分析,实验数据均为计量资料,以均数±标准差()表示,两组资料比较采用t-test 分析法,两组以上资料比较采用单因素方差分析。
2 结 果
2.1 SIRT6 在前列腺癌细胞中的表达
本研究采用Western 印迹法检测了3 种前列腺癌细胞株(LNCAP、PC-3、DU145)与正常前列腺上皮细胞系(RWPE-1)中SIRT6 蛋白的表达,结果发现,无论是哪种前列腺癌细胞,其SIRT6 的表达均低于正常前列腺上皮细胞(P<0.01)。其中PC-3 细胞SIRT6 表达相对较低,但3 种前列腺癌细胞SIRT6 的表达比较差异无统计学意义。本研究选择PC-3 细胞作为SIRT6 过表达的目标细胞。结果见图1。

图1 SIRT6 在3 种前列腺癌细胞中的表达
2.2 过表达SIRT6 后前列腺癌细胞的增殖能力
为了验证SIRT6 对前列腺癌细胞的作用,本研究通过质粒转染使PC-3 细胞中SIRT6 的表达升高。SIRT6 过表达后,通过CCK-8 法我们可以看到,SIRT6 转染组细胞与对照组相比,细胞培养12 h 和24 h 增殖活性比较差异无统计学意义,培养至36 h 和48 h 增殖活性下降,差异有统计学意义(P<0.05)。结果见图 2、图 3。
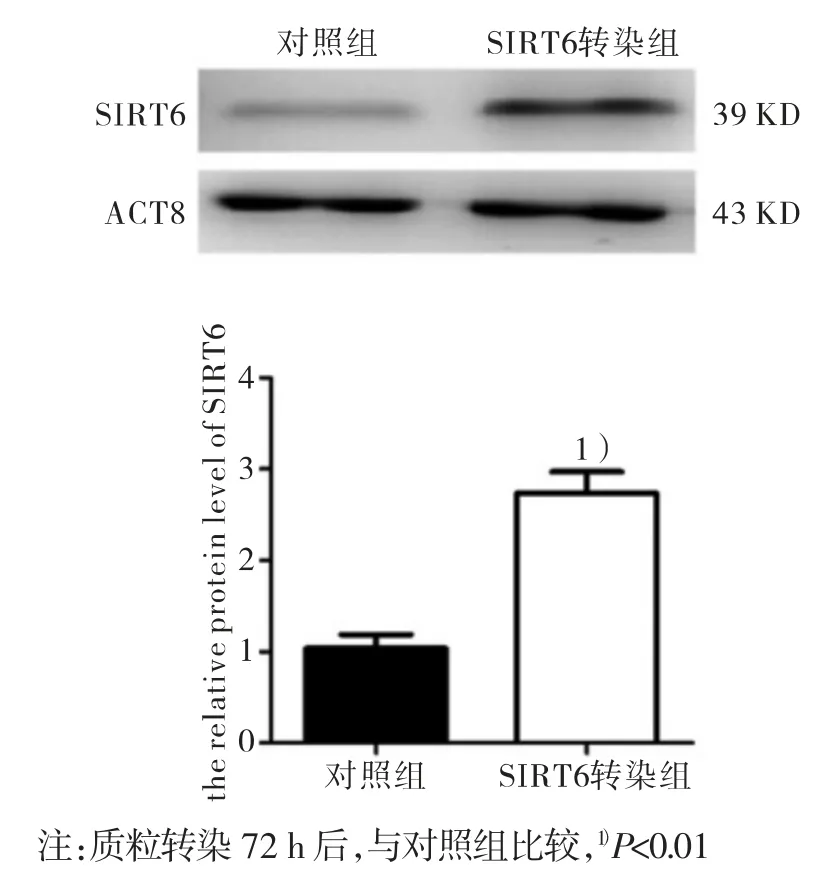
图2 转染后PC-3 细胞中SIRT6 的表达量

图3 SIRT6 过表达后PC-3 细胞增殖活性的改变
2.3 过表达SIRT6 后前列腺癌细胞的凋亡水平
PC-3 细胞过表达SIRT6 后,通过Annexin V-PI 双染检测细胞的凋亡率,结果发现对照组细胞的凋亡率为(5.72±1.28)%,SIRT6 转染组细胞的凋亡率为(12.45±2.35)%,SIRT6 转染组细胞的凋亡率显著高于对照组细胞,差异有统计学意义(P<0.01)。结果见图4。

图4 SIRT6 过表达后PC-3 细胞凋亡水平的改变
3 讨 论
肿瘤细胞与正常细胞最主要的区别就是细胞的无限增殖能力,为了满足细胞生长的能量需求,肿瘤细胞的代谢与正常细胞有所不同,这种不同主要表现为糖代谢异常:肿瘤细胞即使在有氧条件下也优先进行糖酵解,因此可以增加葡萄糖摄入量,肿瘤细胞与普通细胞在糖代谢上的差别被称为“瓦博格效应”。SIRT6 在代谢方面参与葡萄糖的代谢,SIRT6 基因敲除使小鼠肌肉和棕色脂肪组织对葡萄糖的摄入大幅增加,出现严重的低血糖[3-4];SIRT6 基因敲除后,引起细胞膜上葡萄糖载体-1 表达增加,小鼠葡萄糖摄入增加,糖酵解增加,同时线粒体呼吸收也受到抑制[5-6]。综上所述,SIRT6 敲除后,小鼠体内葡萄糖代谢与肿瘤细胞的代谢方式一致。因此,SIRT6 可能是一个肿瘤抑制因子。
为了证明SIRT6 的表达与前列腺癌有关,本研究首先比较了3 种前列腺癌细胞与正常前列腺上皮细胞中SIRT6 的表达,结果发现SIRT6 在前列腺癌细胞中的表达较正常前列腺上皮细胞降低,这与本研究的假设一致。
为了进一步证实SIRT6 在前列腺癌细胞中表达的差异与其细胞的功能有关,本研究在前列腺癌细胞过表达SIRT6 后,观察其增殖能力和凋亡水平的变化,结果证实过表达SIRT6 后,前列腺癌细胞的增殖能力下降,同时前列腺癌细胞的凋亡水平升高。提示SIRT6 参与前列腺癌细胞增殖和凋亡,可能是治疗前列腺癌的一个有效靶点。
Sebastian C 等[7]研究发现:SIRT6 缺失后,小鼠胚胎成纤维细胞的增殖能力提高,注射入小鼠体内可成瘤,不仅如此,还增加细胞的葡萄糖摄入量,糖酵解相关的基因表达增高。抑制糖酵解后,SIRT6 缺失的小鼠胚胎成纤维细胞其成瘤性也受到抑制,因此,SIRT6 可能通过抑制癌细胞的有氧糖酵解从而达到抑制肿瘤生长的目的[7]。SIRT6 在多种肿瘤都有抑制肿瘤细胞生长的作用[3],但是,SIRT6 对前列腺癌细胞的作用机制是否也是通过抑制糖酵解来完成的,其中哪些通路参与了抑制糖酵解的过程,这些都有待后续的研究进一步去证实和探索。
