脂质体主动载药技术研究进展
2021-11-16顾华芳朱柯武沈润溥席眉扬周艳艳
顾华芳,徐 歌,朱柯武,沈润溥,席眉扬,周艳艳,骆 翔*
(1. 绍兴文理学院,浙江 绍兴,312000;2. 浙江创新生物有限公司,浙江 绍兴,312000)
自从 1964 年 Bangham 发现并报道了脂质体结构以来[1-2],由于其良好的生物相容性[3-5]、体内可降解性[6-8]与肿瘤靶向性[9-13]等优点,已经越来越被视为靶向药物传递系统的理想载体。然而,在当前产业化过程中,影响脂质体药物递送系统的主要障碍是稳定性不理想、载药量不够高、药物易渗漏等[14-19]。另外,脂质体主动载药技术易于实现,其制备工艺简单。两亲性药物通过主动载药的方式被包封后,其包封率一般 > 80 %,因此无需清除游离药物。此法适合于在生理 pH 条件下具有一定脂溶性的两亲性药物,其 pKa 应在人生理 pH 范围之内,以便能够得到较高的包封率。跨膜梯度主动载药法主要有 pH 梯度法、硫酸铵梯度法、醋酸钙梯度法、离子载体建立梯度法。近年来,随着对脂质体主动载药技术(Remote/Active loading)的深入研究和广泛应用,研究人员发现该技术能够制备高载药量和高包封率的脂质体,并显著提高脂质体的稳定性,减少药物泄露[20-25]。如图1所示,采用 PubMed 数据库,以“remote loading”or“active loading”为关键词进行搜索,相关文献数量呈现增长趋势。因此,脂质体主动载药技术的优越性已经引起了越来越多研究者的关注,并成为制备脂质体过程的首选方法[26-30]。
1 主动载药简介
1.1 主动载药历史
众所周知,弱酸或弱碱的中性分子形式可以跨越脂质双层膜,而其解离形式却不能。早期研究中,Jacobs 等对红细胞膜渗透性的研究,以及 Chappel 和 Crofts 对线粒体膜和叶绿体膜的研究,论证了当膜两侧存在跨膜 pH 梯度时,羧酸、醋酸和胺等以中性分子形式可以快速穿越磷脂双分子层促使跨膜浓度梯度的形成和维持[31-33]。1976 年,Nichols 和 Deamer 等[34]首次采用 pH 梯度法主动载药技术制备了儿茶酚胺脂质体。1989 年,Gabizon 等[35]利用硫酸铵梯度法主动载药技术制备了两种不同膜材的盐酸多柔比星脂质体。此后,有研究者采用了 Ca2+[36-38]、Mg2+[39-41]、Mn2+[42-44]、Cu2+[45-47]、Na+-K+[48-51]等一系列离子梯度主动载药技术制备脂质体。

Fig. 1 Statistical results of literatures on active drug delivery technology of liposomes, 1973-2020 图 1 1973-2020年脂质体主动载药技术相关文献数统计结果
1.2 主动载药主要方法
1.2.1 pH 梯度法[52]
pH 梯度法(pH gradient method)是通过调节脂质体内外水相的酸碱性,从而建立一定的跨膜 pH 梯度差,利用弱酸或弱碱性药物在不同 pH 环境中解离状态的差异,使药物在外水相中以分子型低极性状态存在。当建立了 pH 梯度的脂质体在接近或超过相变温度时,磷脂双分子层由排列有序的“胶晶态”(Gel crystalline phase)向无序的“液晶态”(Liquid crystalline phase)过渡中,磷脂脂肪链中的“全反式构象”碳-碳单键转换为“邻位交叉式构象”,使脂肪链转动半径大幅增加,导致脂质体膜流动性与通透性增大,有利于分子型药物渗透穿过磷脂双分子层,以高极性的离子型药物稳定包封于脂质体的内水相中[53]。
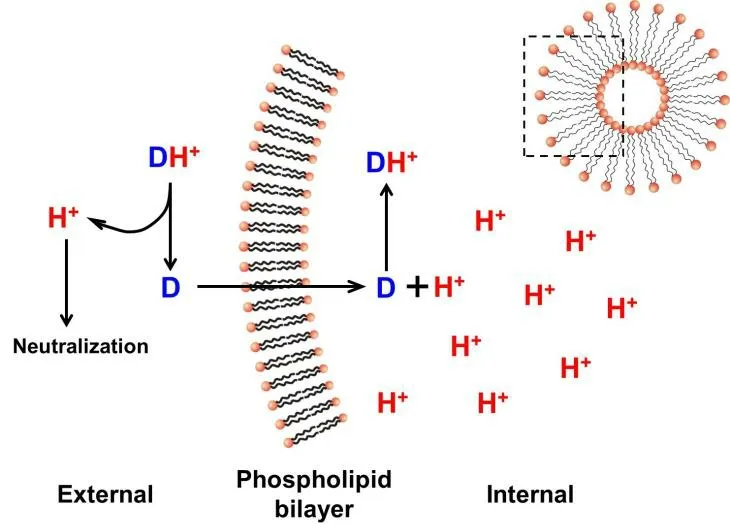
Fig. 2 Principle of active drug loading by pH gradient method (D, weak alkaline drug; H+, hydrogen ion) 图 2 pH 梯度法主动载药原理(D,弱碱性药物;H+,氢离子)
1.2.2 硫酸铵梯度法[35]
硫酸铵梯度法(Ammonium sulfate gradient method)适用于两亲弱碱性药物,特别是蒽醌类抗肿瘤药物(如多柔比星[54]、表柔比星[55]、柔红霉素[56]、米托蒽醌[57])。硫酸铵梯度法的作用机理较复杂,现主要有两种解释[58]:①化学平衡驱动。由于硫酸铵电离和水解产生的分子及离子对磷脂双分子层的渗透系数不同,H+的渗透系数较小(10-3~10-5cm·s-1),而 NH3具备较大的渗透系数(0.13 cm·s-1),因此,NH3能快速扩散至外水相,而 H+的几乎不能通过磷脂双分子层,滞留在内水相。通过降低外水相 NH3的浓度,促使内水相的 NH3不断外溢和 H+逐渐累积,间接形成“内酸外碱”的 pH 梯度,通过控制[NH4+]out/ [NH4+]in可以调整梯度大小。当两亲性弱碱药物进入脂质体内水相后,弱碱性药物离子化过程消耗大量 H+,促使内水相 pH 升高,导致更多 NH3外溢,不断推动药物载入脂质体,直至脂质体内水相 NH4+耗竭;②扩散电势驱动。随着内水相 NH3的快速溢出,H+也能够产生向外水相扩散的趋势,形成“内正外负”的跨膜扩散电势,驱动弱碱性药物跨膜并聚集在内水相,这可以部分解释用硫酸铵梯度法使蒽醌类药物聚集到脂质体中的动力学过程为什么比单纯使内水相酸化的脂质体(pH 梯度法)包封慢。近年来,以硫酸铵梯度法为基础的铵梯度法发展迅速,并且逐渐衍生出蔗糖八硫酸酯三乙胺梯度法[59]、NH4EDTA 梯度法[60]等。

Fig. 3 Principle of active drug loading with ammonium sulfate gradient 图 3 硫酸铵梯度法主动载药原理
1.2.3 醋酸钙梯度法[36]
醋酸钙梯度法(Calcium acetate gradient method)通过透析、超滤、离子交换等方法将外水相中的醋酸钙除去,形成跨膜醋酸钙浓度梯度,通过醋酸钙电离和水解,促使大量醋酸分子(HAc)从浓度较高脂质体内水相扩散至浓度较低的外水相,升高脂质体内水相 pH,间接产生跨膜 pH 梯度。HAc 的渗透参数(6.6 × 10-4cm·s-1)是 Ca2+(2.5 × 10-11cm·s-1)的 2 640 万倍,所以相较于 HAc,Ca2+几乎不能穿越磷脂双分子层,而保留在脂质体内部,HAc 则参与了质子转运。醋酸钙跨膜浓度梯度的建立(内部的浓度高于外部),导致 HAc 携带大量质子从脂质体的内部转运到外部产生內碱外酸的 pH 环境,而该 pH 环境为装载和聚集弱酸药物提供了高效的驱动力。

Fig. 4 Principle of active drug loading with calcium acetate gradient 图 4 醋酸钙梯度法主动载药原理
1.2.4 离子载体建立梯度法
缬氨霉素(Valinomycin)能够使 K+扩散系数提高,而不提高 Na+的扩散系数来形成 Na+/ K+梯度[61];尼日利亚菌素(Nigrericin)专一性催化 K+和质子间的转化[45];卡西霉素 A23187(Calcimycin)[46,62,63]和离子霉素(Ionomycin)[64]选择性的催化二价金属离子(Ca2+,Mg2+,Mn2+,Fe2+等)和质子间的交换;拉沙里菌素(lasolocid A)可以催化从一价到三价的各种离子与质子间的交换[65]。

Fig. 5 Principle of active drug loading by ion carrier gradient method 图 5 离子载体梯度法主动载药原理
2 主动载药的影响因素
众多研究者为了寻找最优的主动载药条件,针对不同的主动载药方法和条件进行了考察。通过对近年来国内外脂质体主动载药的文献进行分析,我们归纳出以下一些共性的关键条件。
2.1 跨膜梯度
根据 Henderson-Hasselbalch 理论[66-67],每个 pH 单位的变化,会产生分子型与离子型药物浓度比值 10 倍的变化,当脂质体存在 3 个单位的跨膜 pH 梯度时,理论上能够维持药物分子与离子浓度的 1 000 倍之差。同理,对于硫酸铵梯度和醋酸钙梯度也符合此理论。
有文献报道[36,58,68],跨膜梯度是影响脂质体包封率的最主要因素,通常梯度越大,产生的跨膜驱动力越大,载入脂质体内的药物越多,脂质体包封率也越高。制备马来酸匹杉琼脂质体时,当跨膜 pH 梯度差为 3~4 时,脂质体包封率达到 80% 以上;但当跨膜 pH 梯度差 ≤ 2 时,脂质体包封率不足 40%[69];多柔比星脂质体也具有相似的包封效果,当跨膜 pH 梯度差达到 3.5 时,药物包封率超过 98%[68]。适当降低内水相缓冲液的 pH 可增大 pH 梯度,但过强的酸性环境易造成药物和磷脂的水解,导致脂质体的不稳定[70]。
2.2 孵育温度和时间
虽然 Arrhenius 方程[71]常用于解释化学动力学过程,但是对于脂质体主动载药过程同样适用。可由 lnk = -Ea/RT + lnA 式中,k 为速率常数,R 为摩尔气体常数,T 为热力学温度,A 为指前因子(也称频率因子),Ea 为表观活化能。对于脂质体主动载药过程,k 可视为脂质体装载药物的速率常数,Ea 可认为是药物跨越磷脂双分子层的活化能,即跨膜活化能。对于确定的脂质体处方组成和装载药物,Ea(跨膜活化能)为定值,当T(孵育温度)升高时,k(载药速率)增大,载药时间缩短,脂质体也较快达到载药平衡[72]。
当孵育温度大于脂质体的相变温度时,磷脂双分子层的通透性增加,可以促进载药。但通透性的增加也造成了载药时 pH 梯度的破坏。因此,国外有人加入乙醇,并在 37 ℃ 条件下进行载药,最终取得了良好的效果[73]。
王绍宁等[74]考察了在不同温度条件下孵育对盐酸环丙沙星脂质体包封率的影响。实验结果表明,当孵育时间固定时,盐酸环丙沙星脂质体的包封率随孵育温度的升高而增大,但当温度超过50 ℃ 以后,其包封率便趋于稳定。
邓意辉等[75]研究发现,脂质体进行盐酸小檗碱 pH 梯度载药时,当孵育温度为 60~70 ℃ 时,脂质体包封率随着孵育温度升高而增大,当孵育温度达到 80 ℃ 时,脂质体包封率下降。随着孵育时间的延长,脂质体包封率逐渐增大,当孵育时间超过 20 min,脂质体包封率趋于稳定。
Chou 等[76]采用 pH 梯度法制备伊立替康脂质体,在 40 ℃ 时孵育 5 min,脂质体中伊立体康的装载量即达到最大值,当孵育时间为 30 min 时装载量趋于平衡,脂质体包封率达 97% 以上。
2.3 药脂比
药脂比与脂质体的包封率存在密切联系,通常随着药脂比的降低,单个脂质体内装载的药物减少,药物更容易包封入脂质体[74]。
王绍宁等[74]采用硫酸铵梯度法制备盐酸环丙沙星脂质体,当药脂比小于 0.2(w / w)时,加入的盐酸环丙沙星较少,对内水相中 H+和 SO42-的浓度改变较小,硫酸铵梯度法制备了高包封率的盐酸环丙沙星脂质体;但继续增大药脂比后,硫酸铵梯度不能有效维持,导致脂质体包封率显著下降。
Tatsuaki 等[77]分别采用硫酸铵梯度法和 pH 梯度法(枸橼酸缓冲液)制备多柔比星温敏脂质体。硫酸铵梯度法制备的多柔比星脂质体随着药脂比的降低而增加,当药脂比为 1/40(w/w)时,多柔比星包封率接近 100%;利用 pH 梯度法制备多柔比星脂质体时,药脂比为 1/20(w/w)时,多柔比星包封率达到最大值,当包封率继续增加至 1/40(w/w)时,其包封率反而降低至 80% 左右。
牟琳琳等[78]研究发现药脂比在 1/20~1/10(w/w)时,盐酸小檗碱脂质体包封率达 98% 以上;当药脂比增大至 1/8(w/w)时,脂质体包封率下降至 87%;当药脂比增大至 1/5(w/w)时,脂质体包封率仅为 62%。
Stensrud 等[79]研究发现,以 200 mmol·L-1枸橼酸缓冲液(pH 4)作为水化介质,采用 pH 梯度法制备伯氨喹脂质体时,药脂比对脂质体包封率影响较大。当药脂比低于 0.15(mol/mol)时,脂质体包封率才能维持在 95% 以上。
王宇等[80]考察了不同质量浓度的氢化大豆卵磷脂(Hydrogenated soy phosphatidylcholine, HSPC)对吉非替尼脂质体包封率和稳定性的影响,当 HSPC 在质量浓度为 50g·L-1时,药脂比为1/10(w/w),脂质体的包封率最高,当磷脂浓度更高时脂质体不稳定,容易形成沉淀。
2.4 外水相 pH 调节剂
外水相 pH 调节剂通过中和外水相弱酸或弱碱,使外水相保持中性状态。由于磷脂分子中存在对碱性条件敏感的酯键,因此不宜将外水相 pH 调至碱性。
邓意辉等[81]尝试采用 NaOH 或 Na2CO3作为外水相 pH 调节剂,由于 NaOH 是一元强碱,加入脂质体外水相时,易造成局部碱性过高,导致磷脂快速降解,不利于脂质体的稳定;而 Na2CO3调节过程中易产生 CO2,造成药物损失;因此,研究者选择采用 Na2HPO4作为外水相 pH 调节剂。牟琳琳等[78]采用 pH 梯度法制备盐酸小檗碱脂质体时,以 NaHCO3调节外水相 pH 至 7.0(跨膜 pH 梯度为 3.0),由于其缓冲能力小,加入盐酸小檗碱溶液(显酸性)后,跨膜 pH 梯度减小,无法有效驱动药物进入脂质体,盐酸小檗碱脂质体包封率仅为 85 ± 1.52%。最终,研究者采用 Na3PO4缓冲液调节外水相 pH 至 7.0 进行载药,结果脂质体包封率达 95% 以上。
邓意辉研究团队后续多篇研究报道,均采用 Na3PO4溶液调节脂质体外水相 pH 至中性,然后进行孵育载药,获得了高包封率的马来酸匹杉琼脂质体[69,82,83]、盐酸多柔比星脂质体[84-85]、盐酸表柔比星脂质体[86-87]等。
2.5 内水相缓冲能力
随着脂质体主动载药过程的进行,跨膜离子梯度会逐渐被消耗。因此,内水相缓冲能力对载药过程中跨膜离子梯度的维持具有重要作用,并显著影响药物的包封率。
She 等[69]制备马来酸匹杉琼脂质体时,当枸橼酸缓冲液浓度从 100 增至 300 mmol·L-1时,脂质体包封率先升高后下降;当枸橼酸缓冲液浓度为 200 mmol·L-1时,脂质体包封率超过 97%,达到最大值。这说明枸橼酸缓冲液浓度不宜过大,一方面,外水相大量的枸橼酸根离子易与药物形成低溶解度复合物,导致载药过程受阻,脂质体包封率下降;另一方面,高浓度的枸橼酸易与血浆中 Ca2+形成配合物,影响机体正常生理功能。
刘汉清等[88]考察了不同浓度硫酸铵溶液对苦参碱脂质体主动载药的影响。研究发现,硫酸铵浓度能够显著影响苦参碱脂质体包封率,两者之间呈现一定的正相关性。必须注意的是,由于硫酸铵具有较高离子强度,当其浓度达到 250 mmol·L-1时,易破坏脂质体的稳定性,导致脂质体聚集。
李哲等[89]选用不同浓度的 NH4EDTA 作为水化介质制备盐酸伊立替康脂质体。结果表明,当NH4EDTA 浓度在 200 mmol·L-1以下时,脂质体包封率随浓度的增大而增大,最高达到 91.23%;继续增加 NH4EDTA 的浓度,脂质体包封率基本不变,但粒径增大并出现沉淀,稳定性较差。Ma 等[60]同样用 NH4EDTA 梯度法制备拓扑替康脂质体,结果表明水化介质浓度为 200 mmol·L-1时,脂质体包封率达到最大。
2.6 药物 Log P 值和 pKa 值
在确定脂质体处方和制备工艺的情况下,药物的性质对脂质体的包封率有重要影响,主要包括:(1)油水分配系数(Log P),指示药物在脂-水两相中的溶解度[90-91];(2)解离常数(pKa),指示药物的解离能力和极性[92-93]。
Haran 等[58]比较了吖啶橙、柔红霉素、表柔比星和多柔比星 4 种化合物制备成脂质体后的包封率。结果表明,吖啶橙 pKa 较高(约 9.25),外水相中性条件下,其多以分子型存在,能迅速穿越磷脂双分子层并在内水相酸性条件下离子化,稳定包封于脂质体;其他 3 种药物的脂溶性与 Log P值正相关,脂质体包封率随 Log P 值的增大而升高。
邓英杰等[94]指出一般只有 Log P > 4.5 的脂溶性药物或者 Log P < -0.3 的水溶性药物,才能包封成具有稳定高包封率的脂质体。Log P > 5 的油酸为包封脂质体的理想药物,油酸多相脂质体贮存超过两年,其包封率基本不变。
郑庆忠等[95]研究发现氧化苦参碱水溶性较强,脂溶性较弱,其 Log P 仅为 -0.66[96],该药物的分子型也不能轻易通过磷脂双分子层,因此采用 pH 梯度法制备脂质体包封率只有 50%。
3 结语
总之,通过研究主动载药技术的跨膜 pH 梯度、合适的孵育时间和孵育温度、合适的外水相pH 调节剂、控制内水相缓冲能力、调整类脂的组成和比例等方法,筛选尽可能安全与温和的主动载药离子梯度,提高脂质体的包封率,为主动载药脂质体制剂产业化提供强有力的保障。
综上所述,脂质体主动载药技术经过 40 多年的研究和发展,其在药学领域已经取得了长足的进步,包括在主动载药的方法拓展、机制研究、条件优化和产品开发等方面。随着脂质体主动载药技术的成熟,该技术已成为脂质体制备的主流趋势。其中,FDA 批准上市的产品包括:多柔比星脂质体(Doxil®/Caelyx®[97],Myocet®[98])、柔红霉素脂质体(DaunoXome®[99])、长春新碱脂质体(Marqibo®[100])、伊立替康脂质体(Onivyde®[101])等。通过漫长而又曲折的发展,主动载药技术势必将脂质体药物日臻完善,拓展主动载药技术应用范围和领域,为新型纳米药物递送系统的开发奠定坚实的基础,同时也为脂质体药物的临床转化提供了强大技术保障。
