肝损伤代谢组学模型的构建及其中药提取物水飞蓟宾治疗的评价
2021-11-15钱婷婷朱旭婷卢吟秋李依桐喻春皓谢洪平
钱婷婷, 朱旭婷, 卢吟秋, 李依桐, 喻春皓, 谢洪平*
(1.淮阴工学院制药工程系,江苏淮安,223000;2.苏州大学医学部药学院,江苏苏州,215123;3.江南大学附属医院,江苏无锡,214000)
代谢组学在肝脏疾病研究中获得了一定的应用,包括诊断、治疗和机制研究[1]。由于中药及其提取物在肝功能调节和肝病治疗中具有独特疗效,因此基于代谢组学的研究被关注[2 - 8],包括复方中药对肝纤维化[2]和肝损伤的干预[3]、单味中药对肝损伤的干预和保护[4]、单味中药提取物对肝功能的调节[5 - 7]和肝损伤的治疗[6,8]。在代谢组学模型中均能够发现中药可以阻止肝功能的失调和肝损伤治疗的回调,因此,代谢组学可以用于中药疗效的评价。
水飞蓟宾(Silybin,SIL)为单味中药提取物,属黄酮木脂素类化合物[9],临床上常用于急慢性肝炎、肝中毒和肝硬化的治疗,同时它也有肝功能保护和调节作用[7]。对于代谢组学的研究,包括基于核磁共振代谢谱的降低脂质合成[5],利用气相色谱-质谱(GC-MS)作为代谢谱的肝损伤预防和治疗[6],以及基于液相色谱-质谱(LC-MS)检测尿液样本作为代谢谱的肝损伤治疗[8]。众所周知,代谢组学模型的准确性主要取决于代谢谱的准确表达和多变量分析方法的正确选择两个因素[10,11]。为了让代谢谱尽可能准确地表征因药物毒性导致的偏离正常生理状态(稳态),或者因药物治疗导致的回调至正常生理状态,也主要由两方面的因素决定:第一,检测方法能够让代谢样本中的“所有组分”尽可能地出现“选择性”的检测信号,如大量的分离色谱峰,这是正确表征组分含量变化的前提,正是基于此,LC-MS比GC-MS更为广泛地应用于代谢物检测;第二,代谢物谱中包括了内源性和外源性代谢物信号,而内源性代谢物谱偏离稳态或者回调至稳态才是代谢组学模型的基础,因此准确表达药物毒性或者药物治疗的代谢谱只能包含内源性代谢物信号和稳定的不变信号。然而,LC-MS检测信号中,必须消除外源性代谢物信号和色谱基线漂移[10,11],否则相对于正常对照组,模型组所包含的这些差异性信号将导致模型动物组偏离正常组的程度被扩大化,即模型组的毒性被放大;在对模型组动物进行治疗时,向正常组的回调程度又会被弱化,即药效被弱化,而更多的是表现为“既偏离模型组又偏离正常组”[8]。事实上,仅仅从模式识别来看,当预测样本的分类行为与校正样本不一致时,表明模式识别模型是不正确的。当然,基于此的代谢组学模型对药物毒性或者药效的预测也就是不可靠的,甚至是错误的。而中药的组分含量普遍较低,决定了疗效的温和性以及毒性的不显著性,代谢组学模型中的病理或者毒理差异将会更小,外源性代谢物信号和色谱基线漂移的影响将更为显著。
本文拟用LC-MS为检测技术,以尿液为检测样本,利用本课题组建立的外源性代谢物信号的消除方法[10]和基线漂移校正方法[11],获取内源性代谢物谱,以此表达代谢轮廓,建立主成分分析(PCA)代谢组学模型,拟发现代谢标记物,并以此标记物为基础建立偏最小二乘-判别分析(PLS-DA)代谢组学模型。对水飞蓟宾组在治疗前和治疗后的代谢组学行为进行研究,拟实现水飞蓟宾治疗肝损伤疗效的准确评价。建立的中药治疗评价方法将具有非损伤性、灵敏性、方便性和持续性的显著特点。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪(Acquity UPLC)-三重四极杆质谱仪(Quattro Premie XE),美国Waters公司。低温高速离心机(Avanti J-26XP),美国贝克曼库尔特有限公司。高速离心机(TGL-16B),上海安亭科学仪器公司。
甲醇、乙腈和甲酸购自Merck公司。
1.2 动物实验与检测样本获取
取健康雄性SD大鼠15只(清洁级,体重150±20 g)由苏州大学实验动物中心提供。每天置于控制光照12 h、黑暗12 h、室温25±2 ℃、相对湿度40%~60%条件下,自由摄食和饮水。实验前适应性饲养一周,再随机分为对照组(Con组,n=5)、模型组(Mod组,n=5)和水飞蓟宾组(Sil组,n=5),单只动物单个代谢笼饲养。
在0~24 h,模型组和水飞蓟宾组,用20%的四氯化碳橄榄油溶液,按2 mL/kg单剂量灌胃[12];对照组给予相同体积的橄榄油溶液。24 h后即得肝损伤动物模型。在24~48 h,水飞蓟宾组按治疗剂量100 mg/kg(50 mg/mL水溶液),分上午和下午2次灌胃给药;模型组和对照组给予相同体积的蒸馏水。分别收集每只动物在0~24 h和24~48 h的尿液,每只接尿器中加入1.0 mL 1%的叠氮钠溶液作为防腐剂。
在采血前12 h,实验大鼠禁食。实验后,腹腔注射10%水合氯醛(4 mL/kg)麻醉,下腔静脉采血,在不加抗凝剂的EP管中静置1 h后,3 000 r/min、4 ℃离心10 min,取上清液即血清,置于-20 ℃冰箱保存,用于生化指标测定。同时将大鼠肝脏组织去除边缘5 mm后,剪切相同部位一小块,置于10%甲醛溶液的容器中固定24 h以上,送苏州大学病理实验室制作病理切片,待显微镜检测。
1.3 尿液样本预处理与检测
预处理:同一尿液样本分别取1.4 mL于2只EP管中,在13 000 r/min、4 ℃离心10 min,各取上清液1.0 mL合并入15 mL离心管中,加入6.0 mL的甲醇,涡旋,振摇,10 000 r/min、4 ℃离心10 min,取上清液分装入1.5 mL EP管中,置-80 ℃冰箱保存待测。超高效液相色谱-质谱(UPLC-MS)检测前,将样品从-80 ℃冰箱中取出。加体积比1∶1 的甲醇,涡旋混匀后13 000 r/min、4 ℃离心10 min,取上清液用0.22 μm 微孔滤膜过滤,滤液于13 000 r/min、4 ℃离心10 min,取上清液转入进样小瓶,即刻检测。
UPLC-MS检测:色谱柱ACQUITY UPLC BEH C18柱(50 mm×2.1 mm,1.7 μm;Waters公司),柱温30 ℃;流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液,流速0.2 mL/min;进样量1 μL。梯度程序以流动相A表示为:0→1→3→7→11→12→14 min对应为99%A→99%A→85%A→50%A→5%A→99%A→99%A。每10个样本间穿插一个质控样本,以监测仪器的稳定性。离子源为电喷雾离子源,正离子模式检测;脱溶剂气温度为350 ℃,脱溶剂气流速1 000 L/h;毛细管电压为2 000 V;锥孔电压为30 V。每0.5 s采集一次谱图,质量扫描范围m/z50~1 000。
2 结果与讨论
2.1 消除色谱基线漂移
代谢谱准确表达的首要前提是代谢样本中各组分的含量变化要尽可能地准确表达,这就要求检测时各组分色谱峰要尽可能地分离,为此在选定色谱柱及流动相后,采用梯度洗脱,以保证尽可能多地分离出色谱峰,严重的基线漂移也就不可避免,见图1A。众所周知,基线漂移不但有等性的,还有非等性的。而这些非等性的漂移基线是随信号的增强而增强,见图1B。采取常用的拟合等性漂移基线去扣除信号峰中包含的基线漂移,对于高含量组分准确度的影响是可以忽略不计的,但是对于代谢组学中所关注的内源性代谢物信号的增加或者降低,通常这种变化的程度是较弱的,特别是中药毒性或者药效引起的变化会是更弱,因此组分峰中基线漂移的准确消除就显得特别重要[11]。我们研究组基于LC-MS中MS的高度选择性(即近似于线状的质谱峰)提出了一种确定真实色谱基线并消除基线漂移的方法[11]。其基本思想和方法为:在LC-MS/MS的二维数据矩阵中,每一个m/z均对应一个色谱矢量,在所检测的m/z范围内,由于MS的高度选择性,必然导致了大量的被检的m/z处并没有碎片离子的质谱信号,这些m/z处的色谱矢量即就是色谱基线,它是全部保留时间范围内的色谱基线,即真实的色谱基线;以信噪比(S/N)≥3为标准,对一个色谱矢量的所有元素进行比较,当均为噪声时,该色谱矢量即为相应m/z下的色谱基线矢量;对确定的所有m/z下的色谱基线取平均,作为该检测样本的色谱基线,以实现基线扣除。对于Sil组,以此方法获得了所有样本的总离子流色谱的平均基线,结果参见图1B。可以发现,基线漂移的非等性特别严重,将会导致代谢组学模型的严重偏离。以此基线,扣除基线漂移,结果参见图1A。可以发现,色谱的基本形状没有改变,但是相对高度发生了变化,这正是非等性所引起的;同时,基线的漂移也被有效消除。
2.2 消除外源性代谢物信号
相对稳定的内源性代谢物谱是机体正常生理状态的反映,当发生病理性或者毒理性变化时,它将发生偏离,这就是代谢组学模型的基础。然而,机体的代谢样本,比如常用的尿液和血液,既有内源性代谢物,又有外源性代谢物,如常见的药物代谢物,多出来的外源性代谢物的检测信号明显降低了代谢组学模型的准确度。对于本文中大鼠尿液样本,检测结果参见图2。可以发现,与对照组比较,给药组由于药物代谢物的存在,导致多出现了色谱峰(图2A)。以6~9 min为例,在其放大图(图2A内插图)中可明显地观察到,给药组中多出了保留时间约为6.9、7.6、7.8和8.5 min的4个外源性代谢组分峰(图中箭头标注)。与对照组比较,给药组中内源性代谢物信号的增强或者减弱程度,明显小于多出来的外源性代谢物信号强度,它将严重削弱内源性代谢物信号的变化对代谢组学模型的贡献率,从而导致代谢组学模型对毒性和药效的准确表征和灵敏表征。对于中药的弱毒和弱效,这种影响将更为严重,甚至代谢组学模型将可能得出错误的结论。
据此,基于组分间质谱信号正交性,我们研究组建立了基于质谱的正交投影(MSOP)方法,消除给药样本数据中的外源性代谢物检测信号[10]。该方法的基本思想和方法为[10]:在LC-MS矩阵数据中,对于同一保留时间的质谱矢量,与对照组比较,给药样本中包括了两类碎片离子。第1种,m/z与对照组相同,但质谱强度可以相同,也可以不同,这些碎片离子就是“内源性代谢物组分质谱”,它们仅仅是表征了浓度的变化;第2种,比对照组多出的碎片离子,即就是外源性代谢物组分的质谱。此时,当用对照样本的质谱矢量构建的MSOP去投影给药样本的同一保留时间的质谱矢量时,给药样本中与对照样本相同组分(内源性代谢物)的质谱就被消除,残差矢量即为给药样本中多出现的差异性组分的信号,即外源性代谢物的质谱。不同保留时间重复该正交投影,将获得给药样本检测信号矩阵中包含的外源性代谢物信号矩阵。通过信号扣除,即可获得给药样本的内源性代谢物信号矩阵。对于本文的尿液样本,从检测信号中用MSOP法消除外源性代谢物信号,结果参见图2B。同样也以6~9 min为例,在其放大图(图2B内插图)中可以发现,与对照组比较,给药组中明显多出来的那4个外源性代谢组分峰已经被消除,同时所有的组分能够基本对应,仅仅表现出的是“量的多与少”,这也正是代谢组学所关注的组分。从整个色谱(图2B)来看,也是反映的这种“量的多与少”的特征,由此说明给药样本中的药物代谢物信号已经被有效消除。

图2 消除外源性代谢物前(A)和后(B)的总离子流平均色谱图Fig.2 Average total ion chromatograms before(A) and after(B) eliminating exogenous metabolitesLine a:Group Sil;Line b:Group Con;Inset:partially enlarged.
2.3 代谢组学模型与治疗评价
对于获得的内源性代谢物谱,常用PCA和PLS建立代谢模型。PLS是有监督的分类,适用于变量对分类贡献明确的情况,如以标记物作为变量。而无监督的分类方法PCA适用于变量对分类贡献不明确的情况,以此进行模型分类,并以此模型去发现标记物[10,11]。据此,我们以获得的内源性代谢物总离子流色谱为识别变化,经浓度归一化处理后,利用PCA方法,建立了四氯化碳肝损伤代谢组学模型(图3)。从图3A可以发现,与对照组比较,模型组发生了明显偏离,它们被分为了两类模式识别样本,表明四氯化碳肝损伤导致了内源性代谢物谱偏离正常的生理状态,表现出了明显的肝损伤病理特征。在正常对照组中,其中一个样本被分类到了模型组中,其统计行为与正常组不一致,应该作为奇异样本。事实上,PCA模型的分类与肝组织显微成像特征是一致的。对照组(图3B)肝细胞肝小叶和肝细胞核结构完整清晰,肝细胞索以中央静脉为中心呈放射状规则有序排列;四氯化碳造模后(图3C)肝细胞出现了较大程度的脂肪性病变,肝细胞肿胀呈圆形,呈现空泡样变性,细胞核体积增大被挤向一侧,胞浆内充满大小不等的脂滴,中央静脉及汇管区大量炎症细胞浸润,说明四氯化碳致大鼠肝组织损伤造模成功,这与代谢组学PCA模型的结论一致。与血清生化指标的结论也相符合。在四氯化碳造模后,与对照组比较,谷丙转氨酶(ALT)和谷草转氨酶(AST)酶活性有明显升高,分别从33.13±9.13升高到86.90±36.76 IU/L,以及从48.95±12.18升高到145.22±32.02 IU/L,均表现出了明显的统计学差异。上述结果表明,获得的内源性代谢物谱能够准确地表征机体的毒理状态,据此建立了准确的肝损伤代谢组学模型。
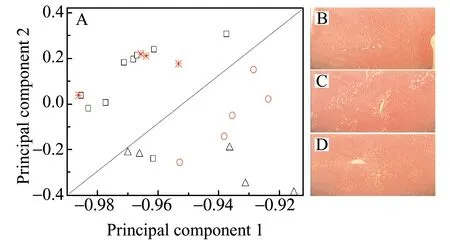
图3 水飞蓟宾治疗肝损伤的基于PCA的代谢组学模型(A)及其Con组(B)、Mol组(C)和治疗后的Sil组(D)的肝组织显微图像:Con组;:Mol组;治疗前(Ο)的后(*)的Sil组Fig.3 Silybin-treated PCA based metabonomics model of liver injury(A) and their microscopic images of liver tissue for Groups Con(B),Mol(C),and treated Sil(D)▯:Group Con;△:Group Model(Mol);Groups Sil before(Ο) and after(*) treating with silybin.
对于水飞蓟宾治疗的同一组动物,为了与临床治疗一致,也首先四氯化碳造模,结果见图3A中给药组治疗前的样本,这些样本与模型组的分类一致,表明给药组治疗前的内源性代谢物谱特征与模型组一致。当给予水飞蓟宾治疗之后,样本分类与正常对照组重叠,表明经过治疗后的内源性代谢物谱特征与正常对照组一致,给药组的肝损伤回调到了正常对照组,说明肝损伤得到了恢复。肝组织显微成像(图3D)也证实了此结论。可以发现,四氯化碳造模导致的肝细胞脂肪性、形态学以及炎性病变均消失,与对照组没有显性差异(图3B)。从血清生化指标可见,与模型组比较,ALT及AST酶活性有一定回调,分别从86.90±36.76 IU/L降低到74.99±24.98 IU/L,以及从145.22±32.02 IU/L,降低到88.08±36.25IU/L,但是均未回调至正常对照组的水平。这种回调是具有统计学差异的,也说明给药组模型动物的肝损伤获得了一定疗效。众所周知,“非损伤性的”血清生化检测的敏感性明显弱于“损伤性的”肝组织显微成像,也正是如此,组织活检通常作为临床诊疗的金标准。而PCA代谢组学与活检结论是一致的,这也从此实例证实了通常所认为的“代谢组学具有高灵敏度”的结论。这种疗效评价的灵敏性对于中药“温和”疗效的评价尤其重要。说明代谢组学还具有了血清生化检测作为常规检测的显著特征“方便性、持续性”。这也是组织活检不能作为常规检测的根本原因。综上可知,内源性代谢物谱也能够准确地表征治疗过程的病理状态,构建的代谢组学模型评价水飞蓟宾治疗肝损伤疗效的方法具有非损伤性、准确性、灵敏性和方便持续性的显著特点。
经过PCA分析后,获得了分类模型的载荷矩阵,其中的每一个载荷矢量表征了相应的保留时间点对应的内源性代谢物的色谱组分(即质谱矢量)对分类的贡献,也就是对药效或者毒性表达的贡献,该矢量模的数值越大贡献就越大,据此可计算得到每一个色谱组分的贡献率。以贡献率值≥0.15%为标准,从1 667个色谱组分中找出了119个,作为高贡献组分(图4A),这也仅仅占到7.1%的色谱组分数,其它92.9%的色谱组分作为低贡献组分。以高贡献组分作为标记物,建立了有监督的模式识别模型,即PLS-DA代谢组学模型(图4B)。可以发现,在PCA模型中的结论同样也能够在此模型中呈现,说明以极少的标记物是可以实现对中药疗效的灵敏评价。
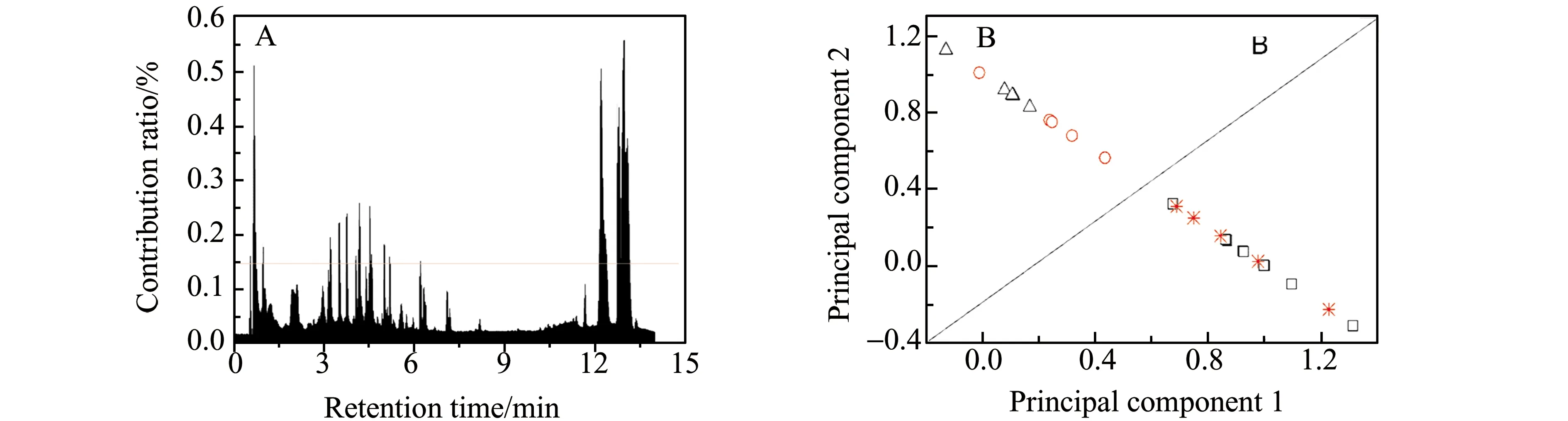
图4 色谱组分对分类的贡献率(A)及其基于标记物的PLS -DA代谢组学模型(B)Fig.4 Contribution ratios of chromatographic components to the classification(A) and the marker basedPLS-DA metabonomics model(B) ▯:Group Con;△:Group Mol;Groups Sil before(Ο) and after(*) treating with silybin.
3 结论
利用四氯化碳致肝损伤动物模型,以尿液为样本,获得了色谱-质谱二维矩阵数据。利用基于质谱选择性和正交性构建的色谱基线漂移和外源性代谢物信号的消除方法,获得了内源性代谢物总离子流色谱,据此建立了肝损伤的代谢组学模型。模型表达的四氯化碳致毒特征与组织细胞显微特征和血清学指标一致。对于肝损伤的模型动物,当给予中药提取物水飞蓟宾治疗时,肝损伤具有明显的回调趋势,治疗前的代谢组学分类特征与模型组一致,治疗后与正常对照组一致,均与肝组织显微成像特征一致。然而,血清学指标虽然也明显回调,但还未回调到正常状态。由此表明,代谢组学肝损伤疗效评价的灵敏性与“损伤性的”作为“金标准”的组织显微成像一致,而明显高于常规的血清学检测。因此,本文获得的内源性代谢物谱准确地表征了致毒过程的毒理状态和治疗过程的病理状态。建立的代谢组学模型实现了非损伤、准确、灵敏、方便持续的中药治疗评价。
