sST2在经皮冠状动脉介入治疗ACS患者危险分层及预后评估中的价值
2021-11-13严健华杨俊瑶张广慧
杜 坤, 严健华, 陈 铭, 杨俊瑶, 张广慧
(1.上海交通大学医学院附属新华医院检验科,上海 200092;2.上海交通大学医学院附属新华医院心内科,上海 200092;3.上海交通大学医学院附属新华医院长兴分院检验科,上海 201913)
急性冠状动脉综合征(acute coronary syndrome,ACS)是由急性心肌缺血引起的一组临床综合征,包括ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)、非ST段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)和不稳定型心绞痛(unstable angina,UA)3种类型。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术是目前对急性心肌梗死(acute myocardial infarction,AMI)有效的治疗方式之一[1]。由于ACS病因不同,临床表现、冠状动脉闭塞程度和缺血梗死的部位也不尽相同,因此进行及时而准确的危险分层评估对于ACS患者的治疗和预后都有十分重要的意义[2]。目前,临床上最常用的危险评分系统是全球急性冠状动脉事件注册(the Global Registry of Acute Cornary Events,GRACE)评分[3],该评分系统主要是根据患者的临床表现及冠状动脉血管狭窄或闭塞程度来进行评分,使用较为烦琐。目前使用的评分系统对于心脏生物标志物的纳入仍较少[4]。如果纳入与ACS相关的生物标志物进行综合评估,可以在简化评估流程的基础上,从分子水平反映ACS的发病机制,进而更加全面、准确地反映病情和评估预后,有效提高诊断效率,指导治疗[5]。可溶性生长刺激表达基因2(soluble growth stimulating express gene 2,sST2)是近年来发现的新型心血管疾病生物标志物,但国外学者对其应用于ACS预后评估的价值存在一定的争议[6-7]。目前,关于sST2在我国ACS人群中的表达及其在疾病分层和预后评估中的价值的研究较少。因此,本研究拟通过分析ACS患者血清sST2水平及其与GRACE 评分、Gensini评分等的相关性,评价sST2用于评估ACS患者6个月内发生主要不良心血管事件(major adverse cardiovascular event,MACE)风险的价值。
1 材料和方法
1.1 研究对象
选取2018年3月—2019年7月胸痛发作12 h内至上海交通大学医学院附属新华医院急诊就诊并确诊为ACS的患者285例(ACS组),其中男182例、女103例,年龄(68.17±13.86)岁,包括UA患者84例(UA组)、NSTEMI患者86例(NSTEMI组)、STEMI患者 115例(STEMI组)。ACS参照美国心脏病协会制定的标准[8],根据患者入院时的临床症状、缺血胸痛病史、心电图检查及相关实验室检查结果确诊。所有ACS患者均在发病12 h内行急诊PCI,使用Gensini评分系统对ACS患者的血管病变程度进行评分。根据《非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)》[9],以GRACE评分≤108分为低危、109~140分为中危、>140分为高危。
选取同期上海交通大学医学院附属新华医院因胸痛就诊,经冠状动脉造影排除ACS的患者80例(对照组),其中男53例、女27例,年龄(62.4±11.5)岁。排除标准:来院后经抢救无效死亡者,曾接受过冠状动脉介入治疗和冠状动脉旁路移植术者,有严重肝、肾功能损伤者以及自身免疫性疾病、严重心肌病、先天性心脏病、心瓣膜病、严重心力衰竭患者。ACS组与对照组性别、年龄差异均无统计学意义(P>0.05)。
1.2 样本采集
患者入院后,立即采集其静脉血5 mL,4 ℃ 1 500×g离心10 min,分离血清,置于-80 ℃保存,统一检测sST2、心肌肌钙蛋白I(cardiac troponin I,cTnI)、氨基末端B型钠尿肽原(amino-terminal pro-B-type natriuretic peptide,NT-proBNP)。所有血清样本仅复溶1次。另收集所有患者的一般临床资料[体质量指数(body mass index,BMI)、吸烟史、饮酒史、高血压史、糖尿病史等] 及生化项目[高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、糖化血红蛋白(glycated hemoglobin A1c,HbA1c)]检测结果。
1.3 方法
sST2采用酶联免疫吸附试验检测,试剂盒购自美国Critical Diagnostics公司,第99百分位点的临界值为18.8 ng/mL,线性范围为3.1~200.0 ng/mL,变异系数(coefficient of variation,CV)为5%,标准曲线r2=0.993 9,参考区间为14.5~25.3 ng/mL。采用cobas e411电化学发光免疫分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)测定NT-proBNP。采用ACCESS 2全自动免疫分析系统(美国贝克曼库尔特公司)及配套试剂(微粒子化学发光法)测定cTnI。所有操作均严格按照试剂和仪器说明书进行。采用适用于我国人群的改良MDRD方程计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR),eGFR[mL/(min·1.73 m2)]=186×血肌酐(mg/dL)-1.154×年龄(岁)-0.203×1.233×0.742(女性)。
受检患者取左侧卧位,在二维超声心动图模式下,取标准四腔心切面,采用Simpson法测得左心室舒张末期容量、左心室收缩末期容量和每搏输出量,再根据公式计算得出左心室射血分数(left ventricular ejection fraction,LVEF),LVEF=(左心室舒张末期容量-左心室收缩末期容量)/左心室舒张末期容量×100%。
1.4 随访
所有患者出院后,采用门诊、电话、再住院的形式对其进行随访,随访时间为6个月。记录所有患者在随访过程中是否发生MACE事件。MACE事件包括心源性死亡、再发AMI、心力衰竭等。随访期间,除去心源性死亡,因其他系统并发症所致的死亡或意外死亡均归类为非MACE导致的死亡。
1.5 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的计量数据以±s表示,多组间比较采用单因素方差分析。计数资料以率表示,组间比较采用χ2检验。采用Spearman相关分析评估sST2与各项指标之间的相关性。采用Kaplan-Meier生存曲线分析随访期间患者的总生存率。采用二分类Logistic回归分析评估随访期间MACE的独立影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 UA组、NSTEMI组、STEMI组及对照组之间一般资料的比较
UA组、NSTEMI组、STEMI组及对照组高血压史、吸烟史、糖尿病史、入院时Gensini评分及GRACE评分、NT-proBNP、hs-CRP、cTnI、HbA1c、LVEF差异均有统计学意义(P<0.05),4组之间BMI、饮酒史、TC、TG、HDL-C、LDL-C及eGFR差异均无统计学意义(P>0.05)。见表1。
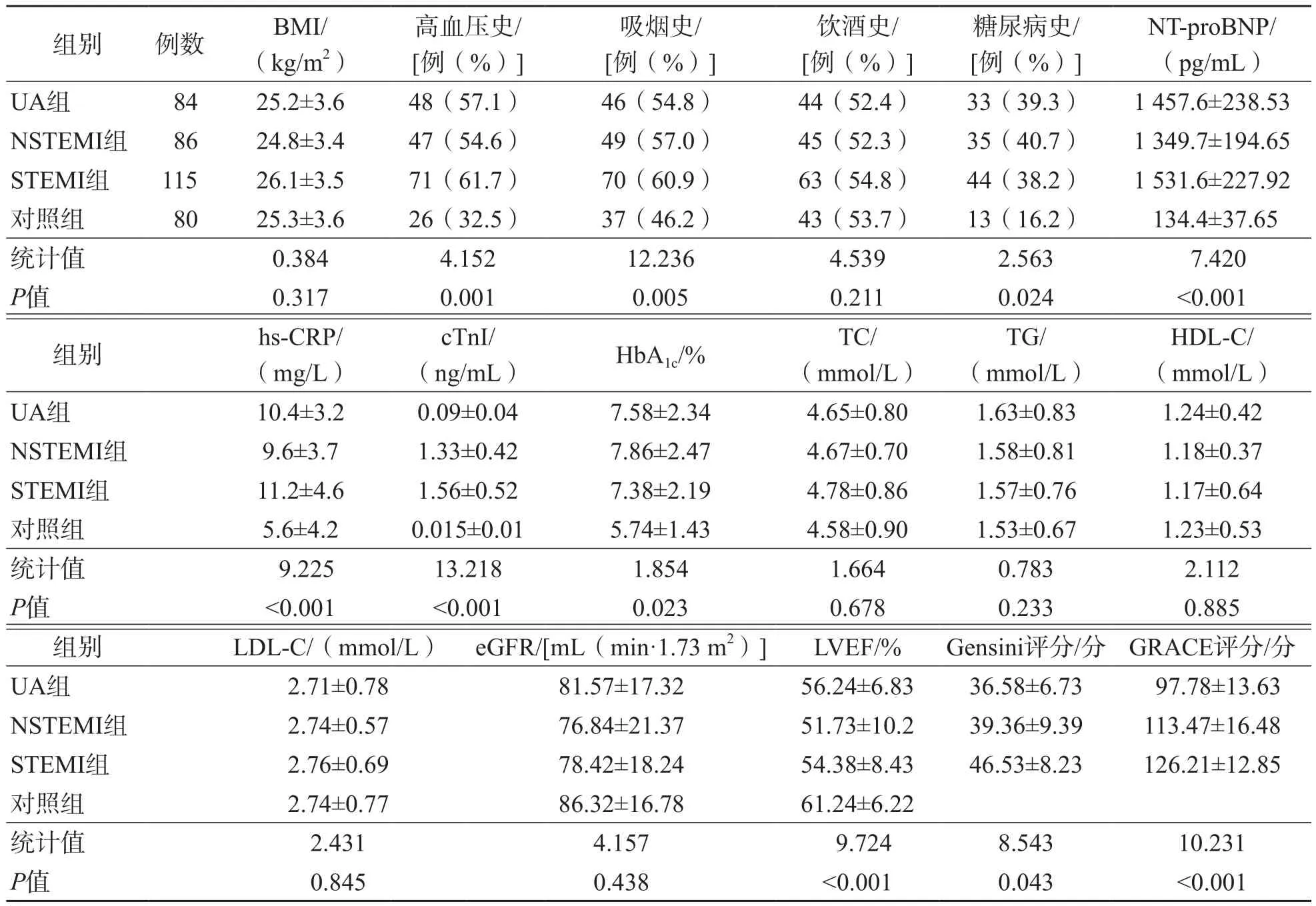
表1 UA组、NSTEMI组、STEMI组及对照组之间一般资料的比较
2.2 ACS组与对照组血清sST2水平的比较
A C S组血清sST2水平高于对照组(P<0.001)。UA组、NSTEMI组、STEMI组之间血清sST2水平差异均有统计学意义(P<0.05)。见表2。
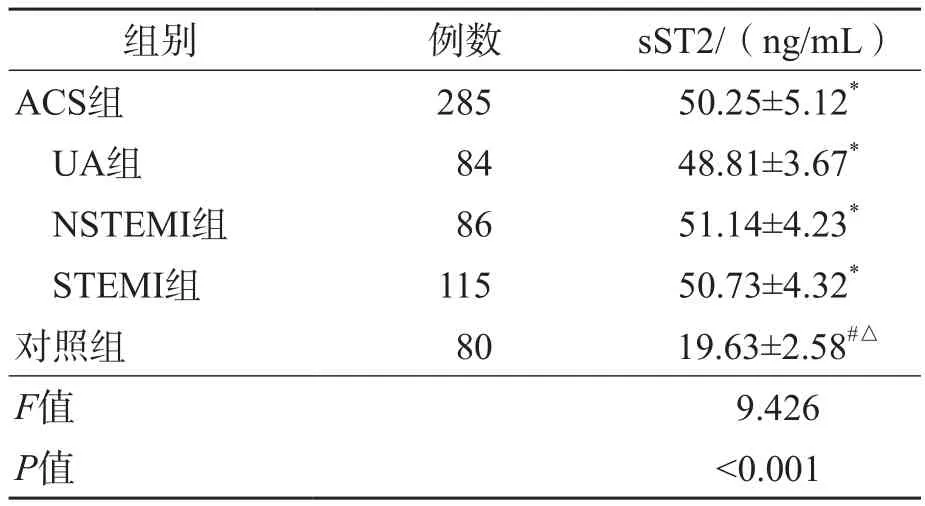
表2 ACS组与对照组血清sST2水平的比较
2.3 发生MACE和未发生MACE的ACS患者死亡率比较
285例ACS患者中,有61例(21.4%)在随访期间发生了MACE,发生MACE的ACS患者死亡率为14.75%(9/61),明显高于未发生MACE的ACS患者[5.8%(13/224)](P<0.05)。
2.4 MACE影响因素分析
以是否发生MACE(是=0,否=1)为因变量,sST2、NT-ProBNP、cTnI、LVEF、GRACE评分和Gensini评分为协变量进行二分类Logistic回归分析。结果显示,血清sST2、NT-ProBNP、cTnI、LVEF及GRACE评分是ACS患者近期发生MACE的独立危险因素[比值比(odds ratio,OR)值分别为1.004、1.019、0.995、0.898、1.009,95%可信区间(confidence interval,C I)分别为1.004~1.011、1.011~1.022、0.958~1.044、0.879~0.966、0.998~1.025]。见表3。
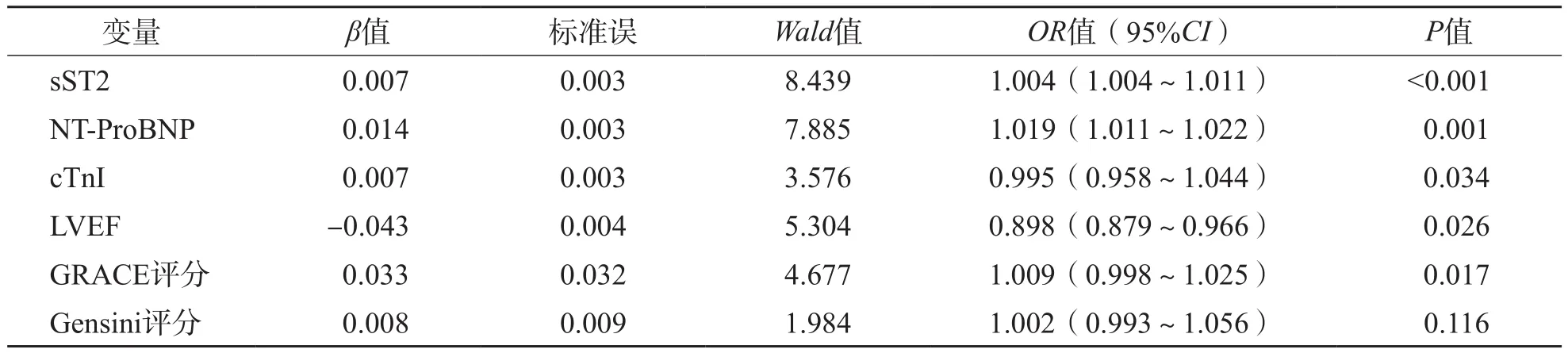
表3 MACE独立影响因素的Logistic多因素分析
2.5 ACS患者sST2水平与6个月生存率的相关性
根据sST2水平的四分位数将ACS患者分为sST2中低水平组[187例,sST2≤第75百分位数(56.35 ng/mL)]和sST2高水平组[98例,sST2>第75百分位数(56.35 ng/mL)]。采用Kaplan-Meier生存曲线分析ACS患者入院时血清sST2水平、GRACE评分与6个月生存率的关系。在6个月的随访期中,sST2中低水平组的死亡率为4.28%(8/187),sST2高水平组的死亡率为14.28%(14/98)。
根据sST2水平和GRACE评分将ACS患者分为4种情况:sST2中低水平+GRACE评分低危组、sST2中低水平+GRACE评分中高危、sST2高水平+GRACE评分低危、sST2高水平+GRACE评分中高危。sST2中低水平+GRACE评分低危的ACS患者总生存率最高,sST2高水平+GRACE评分中高危的ACS患者总生存率最低,二者比较差异有统计学意义(P<0.05)。见图1、图2。
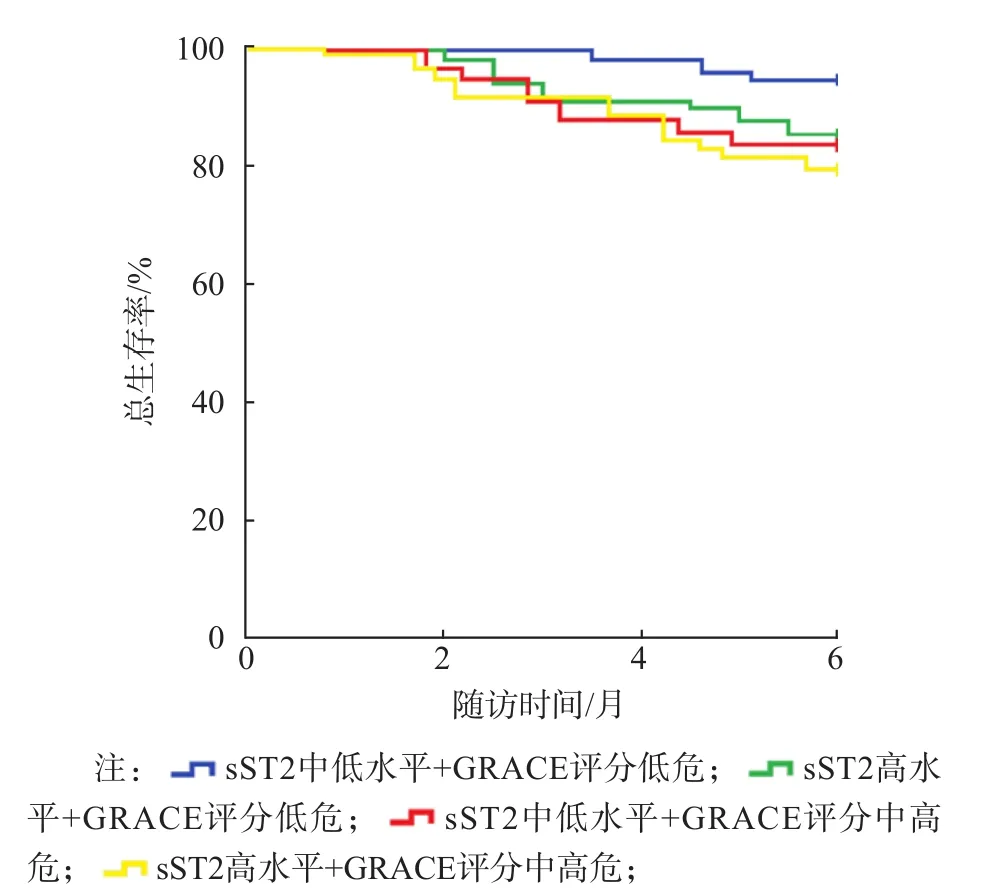
图1 不同sST2水平和GRACE评分ACS患者的Kaplan-Meier生存曲线
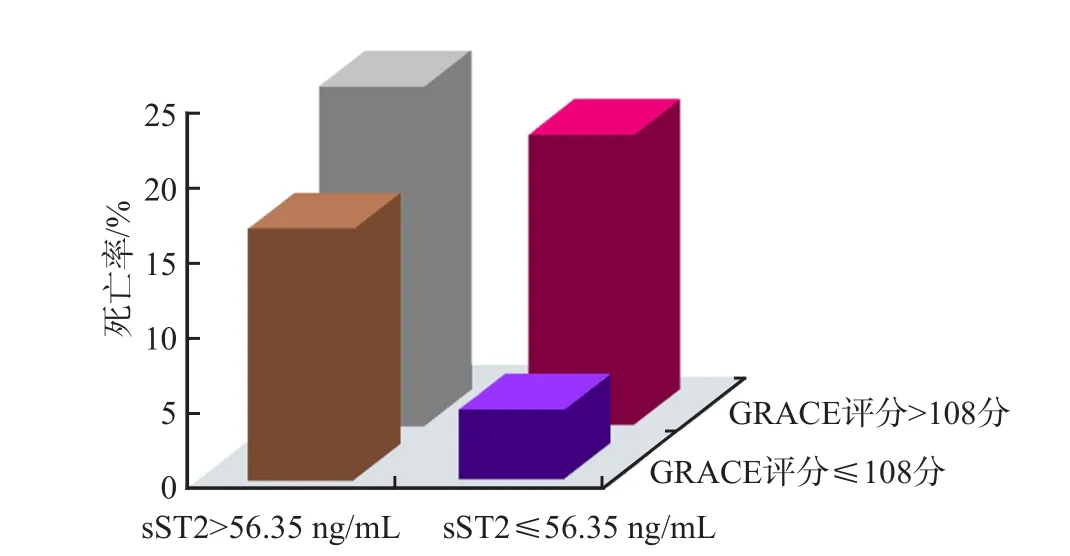
图2 不同sST2水平和GARCE评分ACS患者的死亡率
3 讨论
大多数出现胸痛的ACS患者首次就诊是在急诊室,进行快速诊断和危险分层是治疗ACS的关键。一些特异性和敏感性较高的心脏生物标志物,如肌钙蛋白用于ACS的诊断和危险分层评估具有十分重要的价值,已被欧洲心脏病学会和美国心脏病学会发布的ACS诊疗指南推荐用于临床[10]。关于肌钙蛋白对ACS患者近期或远期发生MACE的预测作用目前已达成广泛的国际共识[11-12]。
然而,ACS是由多因素共同作用诱发的一组疾病,各致病危险因素具有不同的病理生理机制、信号通路以及不同的疾病转归。由于缺乏对相关疾病病理生理机制的系统性认识,因此应用单一生物标志物目前尚无法同时评估心肌细胞的生物机械应力改变、血管内炎症性因素以及心肌细胞外基质结构的完整性等变化。目前已在临床上应用的心脏生物标志物不足以弥补临床上对ACS治疗和评估的空缺,需要联合应用多种生物标志物检测和疾病风险评估系统为临床决策提供有价值的参考依据。
白细胞介素(interleukin,IL)33/ST2信号通路在自身免疫性疾病、变态反应性疾病以及慢性炎症等疾病中均发挥着重要的作用。ST2作为IL-1受体家族成员,参与了T细胞介导的免疫应答,并发挥重要作用,sST2作为IL-33的诱骗受体,可以和跨膜ST2竞争结合IL-33,阻断IL-33/跨膜ST2信号通路,导致心肌细胞发生凋亡、重塑和心脏血管内慢性炎症反应[13-14]。ACS患者循环中的sST2水平与ACS冠状动脉内不稳定粥样斑块局部炎症、心肌组织坏死和纤维化、机械负荷升高以及心肌重塑有关,损伤的细胞和组织中的炎性因子进一步表达sST2,从而激活炎症状态,启动心肌细胞的凋亡程序,导致心肌纤维化及心脏功能恶化[15]。
本研究发现,ACS组血清sST2水平明显高于对照组(P<0.001),提示sST2有助于ACS患者的危险分层。对患者进行6个月的随访后发现,患者入院时基线sST2水平增高,其6个月内发生MACE的概率增大。Logistic多因素分析结果显示,入院时sST2、NT-ProBNP、cTnI水平以及LEVF、GRACE评分是ACS患者6个月内发生MACE的独立预测因素。统计MACE组和非MACE组的死亡率,发现MACE组死亡率高于非MACE组(P<0.05)。另外,分析ACS患者入院时sST2水平和GRACE评分与生存率的相关性,发现入院时sST2高水平且GRACE评分为中高危的ACS患者6个月内发生MACE的风险明显升高,提示入院时sST2水平较高的患者可能预后不良。血清sST2水平或可作为GRACE评分的补充,为患者的预后评估提供有价值的信息。
本研究尚有不足之处。首先,本研究是单中心研究,样本量较小;其次,本研究只检测了患者入院时的基线值,未动态监测住院期间及出院后各项指标的变化,未进一步研究不同治疗时期标志物水平与患者预后的关系。
综上所述,ACS患者血清sST2水平与心肌缺血和坏死的严重程度有关,是患者发生MACE的独立危险因素。sST2作为新型的心脏生物标志物,可以在目前应用的临床风险评估体系的基础上提供更多有价值的信息。
