泡球蚴腹腔感染小鼠肝脏组织中MAPK通路相关分子表达分析
2021-11-12杨晨晨李志强熊鑫鑫段明军
杨晨晨,李志强,熊鑫鑫,寿 玺,段明军,魏 琴,姜 涛*
(1.无锡太湖学院护理学院基础医学教研室,江苏无锡 214600;2.新疆医科大学动物实验中心,乌鲁木齐 830011;3.新疆医科大学第一附属医院影像中心,乌鲁木齐 830011)
泡型包虫病(Alevolar echinococcosis,AE)和囊型包虫病(Cystic echinococcosis,CE)是严重的人畜共患寄生虫病,由多房棘球绦虫(Echinococcusmulticocularis,EM)的幼虫(泡球蚴)寄生于人体所致[1-2],其广泛分布于北半球,中间宿主为啮齿动物,犬科动物为终末宿主,AE和CE是两种完全不同的疾病,具有不同生命周期和不同地理分布,AE尤其在中国分布居多[3]。AE是一种破坏性疾病,主要影响肝脏,如不及时治疗,会有恶性肿瘤样发展和致命的后果[4-5]。泡球蚴病几乎原发于肝脏,寄生后的泡球蚴可发展为一个个相连的囊泡,囊泡浸润至肝实质,会形成由组织细胞或淋巴细胞形成的坏死带,直接侵犯并取代正常肝组织[6]。由于90%以上的泡球蚴都寄生在肝脏,研究泡球蚴引起的肝脏损伤特点、肝纤维化特征,可为研究泡球蚴感染机制奠定基础。有研究显示,MAPK信号转导通路参与泡球蚴感染所致肝脏病理损伤过程[7-8]。为了研究泡球蚴感染对肝脏的损伤作用及MAPK信号转导途径参与泡球蚴感染所致宿主肝脏病理损伤的过程,本研究拟采用新疆株和青海株的泡球蚴腹腔感染小鼠,观察不同来源地泡球蚴感染小鼠后肝脏损伤的特点和机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 Balb/c小鼠,购自新疆医科大学动物实验中心;沙鼠,新疆医科大学动物实验中心自繁殖。动物生产许可证号:SCXK(新)2018-0001,
1.1.2 主要试剂 二甲苯、无水乙醇,福晨化学试剂有限公司产品;α-SMA抗体(货号ab18460),美国Abcam公司产品;ERK1/2抗体(货号4695T)、P38MAPK抗体(货号8690T),美国CST公司产品;DAB显色试剂盒,北京中杉金桥生物技术有限公司产品;4%多聚甲醛通用型组织固定液(biosharp,白鲨物)、Masson三色染色试剂盒、1×PBS(pH7.2-7.4),北京索莱宝生物技术有限公司产品;Trizol试剂,美国Thermo Fisher公司产品;荧光定量PCR试剂盒、反转录试剂盒,德国Roch公司产品。
1.1.3 主要仪器 手术器械,上海医疗器械集团有限公司产品;石蜡切片机(RM2235),德国Leica公司产品;高速离心机(5424),德国Eppendorf公司产品;倒置显微镜(IX71),日本Olympus公司产品;荧光定量PCR仪(IQ5),罗氏诊断产品(上海)有限公司产品。
1.2 方法
1.2.1 实验动物分组 沙鼠用于传代,Balb/c小鼠用于制作动物模型,8周龄,雌雄不限,SPF级,体重18 g~22 g。将Balb/c小鼠分为3个组,对照组(10只)、EM-1组(青海株)、EM-2组(新疆株)。EM-1组、EM-2组统称为造模组,每组10只小鼠,感染期为6个月。动物使用许可证号为SYXK(新)2018-0003,伦理审批号为IACUC20170706-01。
1.2.2 新疆及青海来源地的泡球蚴动物模型的制备 麻醉新疆、青海来源地的长爪沙鼠种鼠,然后将其断颈处死,在无菌条件下解剖,取出完整的组织团块,置于含抗生素盐水的培养皿中,将培养皿移至生物安全柜内,剔除组织块表面的组织,用PBS清洗泡状组织块3~5遍,然后经匀浆器研磨,再用滤筛过滤,收集过滤液于无菌离心管中,静置5 min,弃上清后用PBS洗涤原头节多次至澄清,肉眼观察原头节呈白色细沙样均匀颗粒。用生理盐水制成泡状棘球蚴原头节混悬液,按2 000个/只/mL经腹腔注射接种于Balb/c小鼠以制备泡球蚴动物模型,对照组腹腔注射等体积的生理盐水,于6个月采集全血,采集肝脏组织。
1.2.3 肝脏标本HE染色 6个月后,麻醉小鼠,采用颈椎脱臼法处死对照组、EM-1组、EM-2组小鼠,取肝脏组织,将一半肝脏组织置于40 g/L多聚甲醛48 h,石蜡包埋,3 μm切片,进行苏木素-伊红(HE)染色;另一半肝脏组织保存于液氮,置-80℃冰箱保存。
1.2.4 肝脏标本Masson染色 石蜡切片脱蜡至水,根据Masson染色试剂盒说明书进行操作,用显微镜观察肝脏纤维化染色结果,胶原纤维、软骨呈蓝色,胞浆、肌肉、纤维素呈红色,胞核呈蓝色。
1.2.5 免疫组织化学染色检测各组小鼠肝脏组织中α-SMA、ERK1/2、P38MAPK的表达 采用免疫组织化学S-P法检测各组小鼠肝脏组织中α-SMA、ERK1/2、P38MAPK的表达,α-SMA、ERK1/2、P38MAPK的一抗浓度分别为1∶200、1∶200和1∶100,DAB显色,中性树胶封片,200倍光镜下每片随机选取不同的5个视野,采集图像,用每张染色片中阳性区域占每张片子的面积的百分比,计算和比较各指标的相对表达量。
1.2.6 荧光定量RT-PCR检测肝脏组织中α-SMA、ERK1/2、P38MAPK指标的mRNA表达水平 取出对照组及EM-1组、EM-2组小鼠肝脏组织100 mg,将肝组织在液氮中研磨,加入Trizol提取总RNA,测定OD260/OD280值,并记录浓度(OD260/OD280值在1.8~2.0),采用反转录试剂盒在PCR中反转录,反应条件为:42℃ 60 min;70℃ 5 min,4℃中止反应,置-20℃保存备用。取2 000 ng的cDNA与Fast Start Universal SYBR Green Master(Rox)进行荧光定量RT-PCR。△Ct(N)=目的基因CT(n)均数-参照基因CT(n)均数;△△CT(n)=△Ct(n)-△Ct(1);然后算出2-△△CT。以β-actin为内参。各基因的上下游引物序列见表1。

表1 各基因的引物

2 结果
2.1 各组小鼠感染情况分析
对照组没有发生死亡,EM-1组小鼠有1只死亡,EM-2组小鼠有2只死亡,6个月后,解剖小鼠,对照组小鼠肝脏无异常,颜色鲜红,呈红棕色,肝脏质地柔软,EM-1组、EM-2组小鼠肝脏表面可见明显的大小不一的囊泡,包囊一般呈半透明状,肝脏表面可肉眼观察到黄灰色的坏死灶。3组小鼠肝脏病灶大体观察见图1。
2.2 3组小鼠肝脏HE染色结果
正常组肝脏组织表现为正常的肝小叶结构,分界明显,肝细胞核大而居中,异染色质少而着色浅,能看到核仁,肝细胞胞浆丰富,嗜酸性,胞质内可见嗜碱性物质。EM-1组、EM-2组小鼠可以观察到肝细胞点状坏死,有的肝脏已看不到正常的肝小叶结构细胞排列,汇管区有大量炎性细胞浸润,如淋巴细胞、浆细胞和嗜酸性粒细胞,有的组织切片可以观察到生发结构,周围存在慢性炎症细胞浸润,周围还有肉芽肿形成。3组小鼠肝脏HE染色结果见图2。

A.对照组;B.EM-1组;C.EM-2组A.Control group;B.EM-1 group; C.EM-2 group

A1.对照组; B1.EM-1感染的Balb/c小鼠模型;C1.EM-2感染的Balb/c小鼠模型A2.对照组; B2.EM-1感染的Balb/c小鼠模型;C2.EM-2感染的Balb/c小鼠模型A1.Control group; B1.EM-1 infected Balb/c mouse model; C1.EM-2 infected Balb/c mouse modelA2.Control group; B2.EM-1 infected Balb/c mouse model; C2.EM-2 infected Balb/c mouse model
2.3 3组肝脏Masson染色
对照组见少量网状纤维,胶原纤维稀疏,见于汇管区和中央静脉管壁,EM-1组、EM-2组汇管区网状纤维及胶原纤维增生,纤维条索较粗、间隔变宽,部分形成假小叶,中央静脉周围纤维化,胶原纤维束向小叶内延伸。3组小鼠肝脏Masson染色结果见图3。
2.4 α-SMA、ERK1/2、P38MAPK在小鼠肝脏组织中的表达
对照组α-SMA、ERK1/2、P38MAPK均呈阴性表达,EM-1、EM-2组α-SMA、ERK1/2表达阳性,P38MAPK呈阴性表达。2组在肝组织增生汇管区、中央静脉的周围有阳性表达的棕色颗粒,见图3。α-SMA、ERK1/2、P38MAPK在小鼠肝脏组织中的阳性表达率见表2。3组间各指标经单因素方差分析,α-SMA、ERK1/2阳性表达面积百分比差异显著(P<0.05),各组间P38MAPK阳性面积比无显著差异(P>0.05)。EM-1、EM-2组α-SMA、ERK1/2阳性表达面积百分比显著高于对照(P<0.05)。EM-1、EM-2组-SMA、ERK1/2阳性表达面积百分比差异不显著(P>0.05)。

表2 α-SMA、ERK1/2、P38MAPK在小鼠肝脏组织中的阳性表达面积百分比Table 2 The percentage of positive expression areas of α-SMA,ERK1/2 and P38MAPK in mouse liver tissues
2.5 α-SMA、ERK1/2、P38MAPK mRNA的表达水平
采用2-△△CT方法计算各组小鼠中肝脏α-SMA、ERK1/2 mRNA相对表达量。3组间各指标经单因素方差分析,α-SMA、ERK1/2 mRNA的相对表达量差异显著(P<0.05),P38MAPK mRNA表达水平差异不显著(P>0.05)。EM-1、EM-2组α-SMA、ERK1/2 mRNA高于对照组(P<0.05)。EM-1、EM-2组-SMA、ERK1/2 mRNA相对表达量差异不显著(P>0.05,见图5。

A1.对照组; B1.EM-1感染的Balb/c小鼠模型;C1.EM-2感染的Balb/c小鼠模型A2.对照组; B2.EM-1感染的Balb/c小鼠模型;C2.EM-2感染的Balb/c小鼠模型 A1.Control group; B1.EM-1 infected Balb/c mouse model; C1.EM-2 infected Balb/c mouse modelA2.Control group; B2.EM-1 infected Balb/c mouse model; C2.EM-2 infected Balb/c mouse model
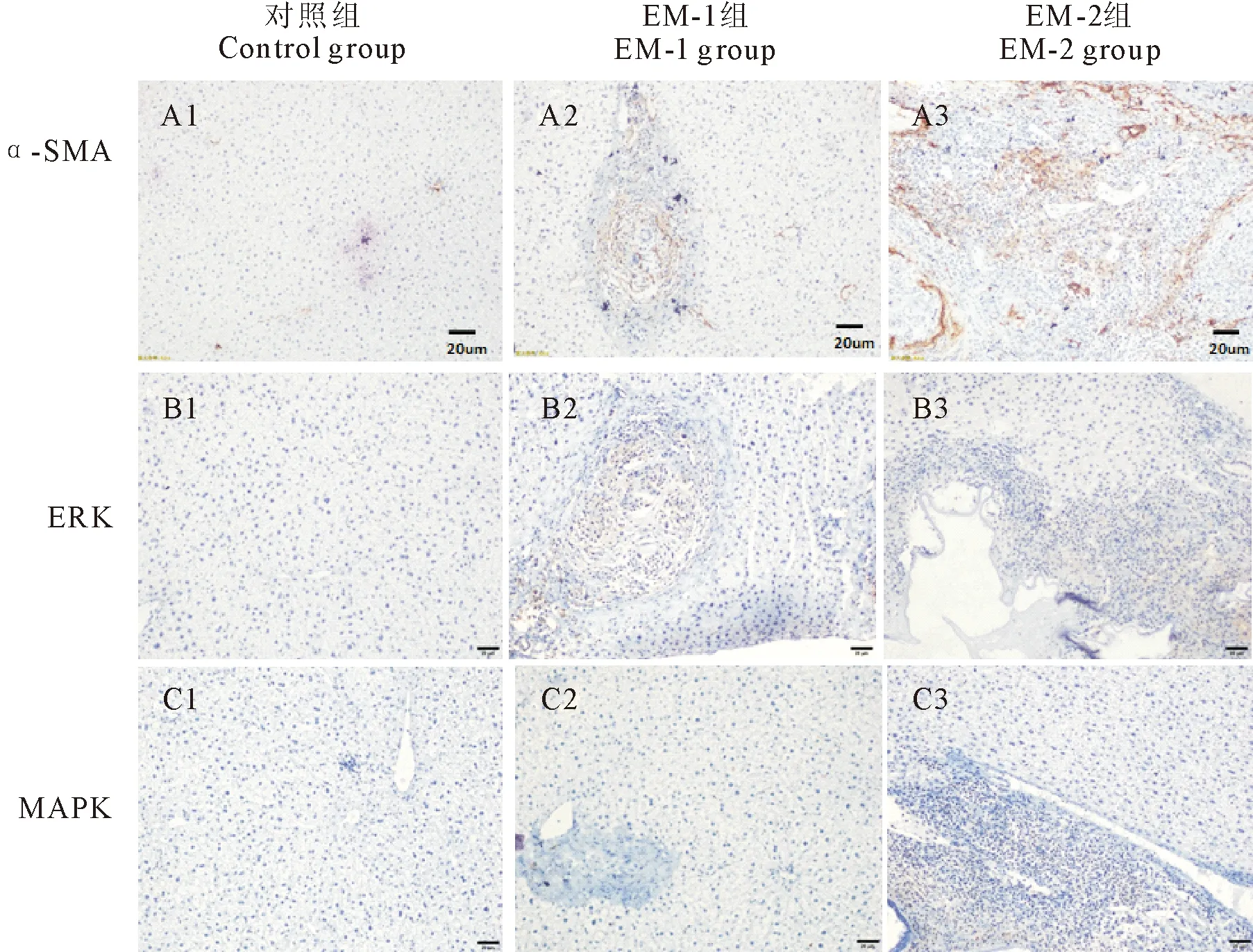
A1.对照组α-SMA表达;A2.EM-1组α-SMA表达; A3.EM-2组α-SMA表达;B1.对照组ERK1/2表达;B2.EM-1组ERK1/2表达;B3.EM-2组ERK1/2表达;C1.对照组P38MAPK表达; C2.EM-1组P38MAPK表达; C3.EM-2组P38MAPK表达A1.Expression of α-SMA in control group;A2.Expression of α-SMA in EM-1 group; A3.Expression of α-SMA in EM-2 group;B1.Expression of ERK1/2 in control group;B2.Expression of ERK1/2 in EM-1 group; B3.Expression of ERK1/2 in EM-2 group;C1.Expression of P38MAPK in control group;C2.Expression of P38MAPK in EM-1 group; C3.Expression of P38MAPK in EM-2 group
3 讨论
多房棘球绦虫形态和生活史均与细粒棘球绦虫相似,但成虫主要寄生在狐,中间宿主是啮齿类或食虫类动物,幼虫期是多房棘球蚴(亦称泡球蚴)。终宿主主要是狐,其次是犬、狼、獾和猫等。在多房棘球绦虫寄生的终宿主体内,可同时有细粒棘球绦虫寄生,中间宿主为野生啮齿类动物,有40多种小型哺乳动物(啮齿类动物和鼠兔)是已知的中间宿主,如田鼠、仓鼠、小沙鼠、长爪沙鼠等。当体内带有泡球蚴的鼠或动物脏器被狐、犬和狼等终宿主吞食后。约经45 d,原头蚴可以发育为成虫并排出孕节和虫卵。宿主误食虫卵,虫卵经消化液作用后六钩蚴脱壳而出,经肠系膜静脉进入血液循环到达肝脏并寄生于此。成虫寄生在终宿主小肠,孕节及虫卵随粪便排出,鼠类因觅食终宿主粪便而受感染,人因误食虫卵而感染。根据研究分析,我国西部七省区(新疆、青海、四川、宁夏、甘肃、西藏、内蒙古)为高流行区[9],泡球蚴在我国的牧民聚集区仍不能得到有效控制,早期AE临床症状及体征不明显,因此诊断缺乏特异性,发现时已经处于中晚期,病灶已逐渐侵及肝脏各部,对大部分农牧地区的居民身体健康带来严重危害[10]。西藏自治区农牧厅对西藏22个县的牛、羊棘球蚴流行病学调查结果显示,牛、羊棘球蚴平均感染率为13.06%和44.72%[11]。阳爱国等[12]2016年对四川省家畜包虫病的流行情况调查显示,甘孜州牛、羊包虫病感染分别为12.21%和11.30%。提示泡球蚴属地不同,其对人类及家畜的感染率也有很大差异,这是一个值得探究的问题,以便针对不同属地的泡球蚴对症治疗。本研究对两种不同来源地的泡球蚴致肝损伤特点及病理损伤的机制进行了研究,可为不同来源地的泡型包虫病临床治疗提供思路。
通过对小鼠肝脏HE及Masson染色结果分析,泡球蚴对小鼠肝脏有损伤,肝组织发生坏死,汇管区可见炎性细胞浸润,肝小叶结构可观察到病灶边缘带区域和坏死区。Masson染色也可观察到纤维化病灶边缘带肝组织胶原染色增多,胶原纤维呈致密环状结构,围绕囊壁周围广泛分布。肝纤维化是泡型包虫病主要特征之一,主要表现为肝内细胞外基质过度沉积以及肝实质细胞弥漫芽生生长,并逐渐蔓延到整个肝脏,是一个复杂的全身病理生理过程,在肝纤维化过程中,肝星状细胞会在遇到毒素等外界刺激时被激活,最终分化为肌成纤维细胞。从病理学特征观察,泡球蚴感染小鼠肝脏发生了损伤,发生了一定程度的肝纤维化。
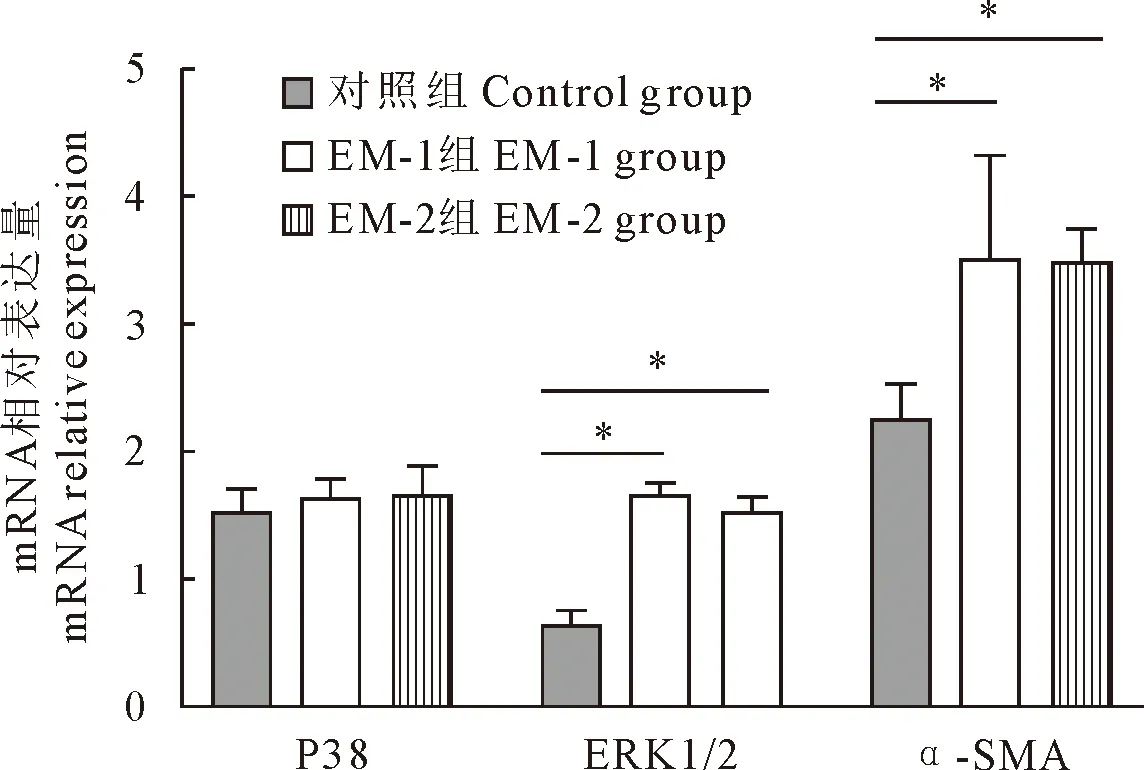
注:与对照组比较,*P<0.05Note:Compared with control group,*P<0.05
α-平滑肌肌动蛋白(alpha-SMA,α-SMA)是位于干细胞和前体细胞中的42 ku的肌动蛋白同工型蛋白。α-SMA是一种众所周知的特征蛋白,用于评估在包括肺在内的多个组织和器官中激活成纤维细胞[13-14],可以间接反映肝星状细胞活化的强度,推测肝纤维化的进展[15-16]。本研究通过免疫组织化学染色检测各组小鼠α-SMA的表达水平。α-SMA在正常小鼠肝脏中呈阴性表达,在EM-1、EM-2组呈阳性表达,采用定量分析发现,EM-1、EM-2组阳性表达面积百分比高于对照组,但2组间α-SMA的表达量无差异。从mRNA水平也证实了以上结果。提示泡球蚴感染,促进了肝纤维化的进程。肝纤维化病灶越多,泡球蚴对宿主的损伤越重,但是两种不同来源地的泡球蚴的肝纤维化程度没有发现差别,提示对肝脏纤维化的影响没有区别。而判断肝纤维化的指标。不止α-SMA一种,Ⅲ型胶原可作为肝纤维化的标志区[17-18],在泡球蚴感染小鼠中,与肝纤维化有关的还有Ⅰ、Ⅲ型胶原。王俊华等[19]研究发现,Ⅲ型胶原是引起肝纤维化的主要胶原,阳丹才让等[20]也发现泡球蚴病的肝纤维化是由Ⅲ型胶原增多引起的。游志远[21]也有类似的研究,发现泡球蚴感染患者病灶周围组织主要胶原为Ⅰ型胶原和Ⅲ型胶原。相关研究表明,骨桥蛋白金属蛋白抑制因子(TIMP-1)、金属蛋白酶(MMP-9)在肝包虫囊壁及周围组织中高表达[22]。肝纤维化进程受多种因子影响和通路的调控,本研究只是对肝纤维化的一种指标α-SMA进行研究,后期应继续开展肝包虫其它肝纤维化指标的相关研究。
泡状棘球蚴等多种寄生虫疾病发生都与MAPK信号通路有关,通过MAPK信号转导通路,促进多房棘球蚴细胞间信息交流,从而影响其生长和发育[23]。MAPK信号转导途径是将细胞外刺激信号传至细胞核进而介导细胞信息传递的共同通路。在肝损伤以及感染、炎症状态下,TGF-β1介导MAPK信号转导途径参与肝细胞生长、增殖、存活、凋亡等反应[24]。研究表明,ERK1/2是受外界刺激时决定细胞命运的关键性因素和关键位点,激活的ERK1/2由胞质转位到核内,激活核内转录因子(Elk-1,ATF,NF-κB,Ap-1,c-fos和c-Jun等),这些转录因子进一步调节它们各自靶基因的转录,参与细胞增殖与分化、细胞形态维持和细胞存活等多种生物学反应。P38MAPK是一类胞内信号转导蛋白,有研究表明其在棘球幼感染的肝旁组织表达增高。而P38MAPK在肝脏炎症以及氧化应激的过程中都起着重要作用,且有相关研究表明,P38MAPK可明显促进smad2蛋白的磷酸化,另外P38MAPK可作为TGF-β1的信号通路蛋白而发挥氧化应激作用,进一步刺激肝细胞的活化增殖形成纤维化[25]。可见在肝包虫病纤维化的发展中P38MAPK发挥重要调控作用。
本研究采用半定量逆转录聚合酶链反应(RT-PCR)及免疫组织化学(immunochemistry)的方法,对感染泡球蚴的小鼠及对照组小鼠肝脏组织中的ERK1/2和P38MAPK的表达水平进行检测,发现与对照组相比,EM-1组和EM-2组小鼠肝脏组织中的ERK1/2蛋白和mRNA表达水平明显升高,而P38MAPK的表达在3组中无明显差异,EM-1组和EM-2组与对照组比较未发现有差异。纪静等[26]研究发现,感染组小鼠肝脏组织中ERK1/2表达水平显著升高,P38MAPK表达两组没有差异,本研究与之报道一致。而李振伟等[27]观察20例经手术诊断为AE的肝纤维化患者,观察P38MAPK蛋白在人肝正常肝组织及病变组织P38MAPK表达水平或整个肝组织均与纤维化程度呈正相关,P38MAPK的表达水平随纤维化程度的增加而增加。研究结果的不一致,可能与感染物种、剂量和时间不同有关,后续还需要进一步验证。
本研究所选用的泡球蚴来自不同源地,我们发现新疆株和青海株对α-SMA、ERK1/2、P38MAPK表达的影响没有差异,提示其对肝脏纤维化和MAPK调控作用是相似的。
综上所述,本试验通过腹腔注射新疆株、青海株不同来源的泡球蚴,观察小鼠肝组织形态变化。发现肝脏发生了病理性损伤,伴有大量胶原纤维化的标志物α-SMA阳性表达,同时发现泡球蚴激活了MAPK信号转导途径,引起ERK1/2活化,促进细胞增殖,其对肝细胞生长、增殖、活化的影响,还有待于进一步研究。
