长链非编码RNAEIF3J-AS1通过上调肌动蛋白结合蛋白表达促进肝癌细胞侵袭和迁移能力
2021-11-12张迪张惠娇叶剑鹏王国胜王建辉房全党李建国
张迪 张惠娇 叶剑鹏 王国胜 王建辉 房全党 李建国△
(1.福建省漳州正兴医院肝胆胰脾外科,福建 漳州 363000;2.福建省漳州市医院妇科,福建 漳州 363000)
肝癌是临床上常见的肝组织恶性肿瘤,临床上常采用手术切除及化疗等治疗方法,但由于患者病情较为隐匿,早期症状不明显,多数患者就诊时已经伴有肿瘤转移,导致患者的生存率降低[1-3]。因此,了解肝癌的发生、发展机制对早期的疾病诊断及治疗预后至关重要。长链非编码RNA(lncRNAs)[4-6],是类长度大于200bp、无编码蛋白能力的RNA,在细胞的正常生理和病理过程发挥着重要作用[7-9]。大量研究证实,异常表达的lncRNA在肿瘤的发生和进展过程中发挥着至关重要的作用[10-14]。以往研究证实lncRNA EIF3J-AS1能够促进结肠癌细胞的增殖能力并且抑制细胞凋亡[15],但是EIF3J-AS1在肝癌中的作用机制仍然没有完全阐明,需要进一步探索。本研究旨在探讨EIF3J-AS1通过上调肌动蛋白结合蛋白(ANLN)促进肝细胞癌细胞侵袭和转移中的作用机制。
1 材料与方法
1.1人肝癌细胞培养和转染 人肝癌细胞系Hep3 B、HepG2、Huh7和MHCC-97H以及人正常肝细胞 (L-02)购自武汉大学中国典型培养物保藏中心,人肝癌细胞细胞在含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基中培养。细胞株置于37 ℃、CO25%的饱和湿度培养箱中培养。lnc EIF3J-AS1干扰慢病毒细胞转染按照文献报道[16]的方法进行。根据转染物不同将细胞分为:Ⅰ:阴性对照组(MHCC-97H sh-NC)、lnc EIF3J-AS1敲减组(MHCC-97H sh-EIF3J-AS1);Ⅱ:阴性对照组(Huh7 sh-NC)、lnc EIF3J-AS1敲减组(Huh7 sh-EIF3J-AS1);Ⅲ:阴性对照组(MHCC-97H sh-NC)、ANLN敲减组(MHCC-97H sh-ANLN);Ⅳ:阴性对照组(Huh7 sh-NC)、ANLN敲减组(Huh7 sh-ANLN)。通过RTFQ-PCR检测转染后分别检测Ⅰ和Ⅱ组细胞的lnc EIF3J-AS1以及Ⅲ和Ⅳ组的ANLN表达水平,验证转染效率。
1.2组织标本 该研究组织样本来自于2013年1月-2015年12月之间在福建省漳州正兴医院肝胆胰脾外科进行手术切除的97例肝癌患者的肿瘤和对应标本的癌旁正常组织。纳入本研究的患者均为初诊且术前未行放化疗等抗肿瘤治疗,排除伴其他恶性肿瘤或有既往恶性肿瘤病史的患者。本项研究通过了福建省漳州正兴医院伦理委员会批准并取得患者的知情同意,临床资料见表1。通过电话、邮件、复查等方式进行随访,末次随访时间为2018年12月31日。在术后的前两年,患者每3个月随访一次;术后3~5年每6个月随访一次;术后5年以后,每年随访一次。
1.3RTFQ-PCR实验 Trizol一步法提取细胞总RNA,后续实验操作步骤依照参考文献进行[16]。RTFQ-PCR在LightCycler 480荧光定量PCR仪上进行,每个反应设3个复孔,40个循环,以GAPDH作为内参照,应用2-ΔΔCt计算基因相对表达量。具体引物序列如下:EIF3J-AS1-F:AAGTACCAGGCAGTGACAGC;EIF3J-AS1-R:TTCTCCACGTTCTTCTCGGC;ALNL-F:CGACTGCTGATGTAGTAATTT;ANLN-R:CGTCGAATTAAGGCTGATGT;GAPDH-F:GAGTCAACGGATTTGGTCGT;GAPDH-R:TTGATTTTGGAGGGATCTCG。
1.4蛋白[质]印迹法(Western blot)检测 蛋白抽提参照碧云天蛋白抽提试剂盒说明书进行,后续配胶、电泳、转模、赋予一抗、二抗参照参考文献[16],最后根据ECL试剂盒说明,于暗室中进行显影。ANLN以及GAPDH均购自美国Abcam公司。
1.5细胞迁移与侵袭实验 细胞侵袭和迁移实验步骤参照参考文献[16],简言之,将各处理组肝癌细胞放在胰蛋白酶溶液下进行消化,3 500 r/min条件下离心10 min后,计数后将细胞浓度调整至50 000 个/mL。分别将含有Materigel培养基(侵袭实验)或不含有Materigel培养基(迁移实验)包被的Transwell上室放入6孔板中,上室添加200μL不含血清的DMEM培养基细胞悬液,下室添加900 μL含20%血清浓度的DMEM培养基,将含小室的6孔板放置在37℃恒温培养箱继续培养48 h。最终取出Transwell小室加入100%甲醇进行细胞固定,采用0.1%结晶紫进行1 h的染色,在显微镜下拍照并记录穿膜细胞数量,染色后拍照计数。
1.6统计学方法 采用IBM SPSS version 24(Chicago,USA)软件进行统计学分析。采用t检验、χ2检验或Fisher精确概率法对两组计数资料进行比较。采用Kaplan-Meier生存分析方法进行估计并且采用Log-rank检验方法进行显著性检验。检验水准α=0.05。利用单因素和多因素Cox比例风险模型分析影响患者总生存的独立预测因子。多因素Cox比例风险模型纳入的变量为单因素Cox分析中有统计学意义(P<0.05)的变量。
2 结 果
2.1lncRNA EIF3J-AS1在肝癌患者肿瘤组织中上调表达 应用RTFQ-PCR技术检测了lncRNA EIF3J-AS1在91例肝癌患者配对癌和癌旁组织中的表达情况。结果提示,lncRNA EIF3J-AS1在癌和对应的癌旁组织中的相对表达量分别为(0.097±0.006)和(0.062±0.003);与对应的癌旁组织相比,lncRNA EIF3J-AS1在癌组织中上调表达,差异有统计学意义(图1,P<0.01)。

图1 RTFQ-PCR检测lncRNA EIF3J-AS1在肝癌组织中的表达情况
2.2lncRNA EIF3J-AS1的相对表达量与肝癌患者临床病理特征的相关性 根据lncRNA EIF3J-AS1在91例肝癌患者配癌组织平均表达水平,将91例肝癌患者分为45例lncRNA EIF3J-AS1高表达组和46例lncRNA EIF3J-AS1低表达组。lncRNA EIF3J-AS1的高表达与肿瘤癌栓(P=0.022)、肿瘤大小(P=0.016)显著相关,而与年龄、性别、肿瘤数目、血清病毒复制程度、肿瘤的分化程度、血清甲胎蛋白、淋巴结转移和远处转移不存在统计学显著的相关性,见表1。

表1 lncRNA EIF3J-AS1的表达量与肝癌患者临床病理特征的相关性
2.3lncRNA EIF3J-AS1的相对表达量与肝癌患者总体之间关系 Kaplan-Meier生存分析所有患者的中位随访时间是32.1个月(95%CI:24.1~40.1)。lncRNA EIF3J-AS1高表达组的中位总生存期是24.6个月(95%CI:19.2~30.0),其1年、3年、5年的估计总生存率分别是73.3%、46.7%、7.0%。而lncRNA EIF3J-AS1低表达组的中位总生存期是38.6个月(95%CI:31.6~45.6),其1年、3年、5年的估计总生存率分别是73.9%、35.8%、20.4%。Kaplan-Meier生存曲线图分析显示EIF3J-AS1低表达组患者的总生存时间显著优于高表达组患者(P=0.007),见图2。 多因素Cox比例风险模型分析显示血清甲胎蛋白含量(P=0.011)、肿瘤大小(P=0.036)和EIF3J-AS1表达量(P=0.038)是影响肝癌患者总生存的独立预测因子,见表2。
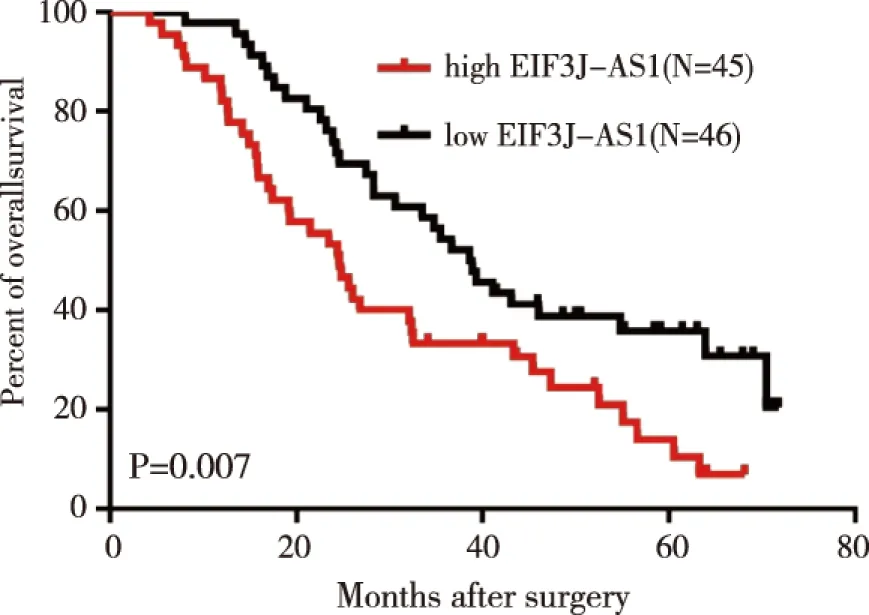
图2 lncRNA EIF3J-AS1表达量与肝癌患者总生存的Kaplan-Meier 生存曲线分析图

表2 肝癌患者总生存的单因素和多因素Cox比例风险模型分析
2.4敲减lncRNA EIF3J-AS1抑制Huh7和MHCC-97H细胞的侵袭和迁移能力 为了探讨lncRNA EIF3J-AS1对肝癌细胞的增殖能力的影响,首先应用定量PCR技术检测了lncRNA EIF3J-AS1在正常肝细胞(LO2)以及肝癌细胞系(Huh7、MHCC-97H、Hep3B、和HepG2)中的表达,分别为(1.000 ± 0.012),(6.756 ± 0.761),(6.467 ± 0.4807),(4.487 ± 0.509),以及(3.377 ± 0.482),结果表明肝癌细胞系中lncRNAEIF3J-AS1表达高于正常肝细胞表达,差异以统计学意义(图3A,P<0.05)。考虑lncRNAEIF3J-AS1在肝癌细胞系Huh7和MHCC-97H细胞中相对表达最高,将lncRNA EIF3J-AS1干扰慢病毒转染至Huh7和MHCC-97H细胞中,并采用RTFQ-PCR检测lncRNA EIF3J-AS1的表达。结果表明,在阴性对照组(sh-NC)相比,转染EIF3J-AS1干扰慢病毒组EIF3J-AS1在Huh7和MHCC-97H细胞中表达量显著降低,有统计学意义(图3B,P<0.001)。EIF3J-AS1干扰慢病毒转染Huh7和MHCC-97H细胞后,应用transwell实验检测肝癌细胞的增殖情况,结果提示,在Huh7和MHCC-97H细胞中,用transwell实验检测肝癌细胞的迁移和侵袭能力情况,结果提示,在Huh7和MHCC-97H细胞中,EIF3J-AS1干扰组的迁移和侵袭能力明显低于性对照组(Huh7迁移组:sh-NC vs.sh- EIF3J-AS1; MHCC-97H迁移组:sh-NC vs.sh- EIF3J-AS1 ; Huh7侵袭组:sh-NC vs.sh- EIF3J-AS1; MHCC-97H侵袭组:sh-NC vs.sh- EIF3J-AS1),差异有统计学意义(图3C 和 D,P<0.05)。
2.5敲减lncRNA EIF3J-AS1表达可抑制ANLN蛋白表达水平 最后探讨lncRNA EIF3J-AS1作用Huh7和MHCC-97H细胞中的分子机制,通过在线数据库GAPIA(Gene Expression Profiling Interactive Analysis)表明EIF3J-AS1与ANLN蛋白在肝癌肿瘤组织中表达正相关(r=0.31,P=1.2e-0.9,图4A),提示EIF3J-AS1可能调控ANLN表达。通过RTFQ-PCR检测证实ANLN mRNA表达水平在转染EIF3J-AS1干扰慢病毒组的Huh7和MHCC-97H细胞中表达量显著降低,差距有统计学意义(图4B,P<0.05)。蛋白[质]印迹法实验的结果表明,在Huh7和MHCC-97H细胞中,与阴性对照组相比,EIF3J-AS1干扰慢病毒组ANLN蛋白水平显著下降,差异有统计学意义(图4C,P<0.05)。以上结果证实,在肝癌细胞中,敲减lncRNA EIF3J-AS1表达可抑制ANLN蛋白表达水平。
2.6敲减ANLN抑制Huh7和MHCC-97H细胞的侵袭和迁移能力 最后我们探讨ANLN对肝癌细胞的迁徙和侵袭能力的影响,首先将ANLN干扰慢病毒转染至Huh7和MHCC-97H细胞中,并采用RTFQ-PCR检测ANLN的表达。结果表明,在阴性对照组(sh-NC)相比,转染ANLN干扰慢病毒组ANLN在Huh7和MHCC-97H细胞中表达量显著降低,有统计学意义(图5A,P<0.001)。ANLN干扰慢病毒转染Huh7和MHCC-97H细胞后,应用transwell实验检测肝癌细胞的迁移和侵袭能力情况,结果提示,在Huh7和MHCC-97H细胞中,ANLN干扰组的迁移和侵袭能力明显低于性对照组(Huh7迁移组:sh-NC vs.sh-ANLN.; MHCC-97H迁移组:sh-NC vs.sh-ANLN ; Huh7侵袭组:sh-NC vs.sh-ANLN; MHCC-97H侵袭组:sh-NC vs.sh-ANLN),差异有统计学意义(图5B 和 C,P<0.05)。
3 讨 论
在美国,癌症的总体5年相对存活率超过60%,而肝癌的5年相对存活率只有30%左右[3]。当肿瘤局限于原发部且只在局部淋巴结扩散的时候,最有效的治疗方法是手术。但是大多数肝癌患者在初次诊断时就已经出现远处转移或被为局部晚期,并不符合手术切除的条件,这是肝癌总体预后不良的一个重要原因[2]。因此,关于寻找新的肝癌治疗靶标或预后生物标志物的研究,对于提高肝癌患者总体生存率和改善其预后,将具有十分重要的意义。
长链非编码RNA(Long non-coding RNA,lncRNA)是一类长度大于 200个核苷酸的单链非编码RNA,在细胞分化、增殖和存活中发挥重要作用[]。LncRNA似乎参与癌症发展的所有阶段,包括肿瘤发生、发展和转移,并且lncRNA的失调是某些癌症的主要特征[5],因此,随着越来越多的lncRNA的功能被验证,大量的证据表明,失调或突变的lncRNA在各种神经变性、心血管疾病、代谢疾病和各种器官癌症的病因学及预后中起重要作用。lncRNA与肿瘤发生、临床分期、转移及预后密切相关,表明lncRNA具有成为肿瘤标志物的前景。在本研究中,我们发现EIF3J-AS1在肝癌肿瘤组织中上调表达,与肿瘤癌栓(P=0.022)和肿瘤大小(P=0.016)显著相关。我们通过单因素Cox比例风险模型分析发现,甲胎蛋白含量(P=0.017)、肿瘤分化程度(P=0.035)、肿瘤癌栓(P=0.025)、肿瘤大小(P=0.014) 、远处转移(P=0.033) 、EIF3J-AS1表达水平(P=0.012)与患者的总生存相关。进一步将这些变量纳入多因素Cox比例风险模型进行分析,发现EIF3J-AS1表达水平(P=0.038)、甲胎蛋白含量(P=0.011)、以及肿瘤大小(P=0.036)是影响患者总生存的独立预测因子。同时,Kaplan-Meier生存分析显示EIF3J-AS1高表达组患者的总生存显著差于低表达组患者(P=0.007),表明EIF3J-AS1在肝癌中可能发挥着癌基因的作用。功能研究证实,敲减EIF3J-AS1表达可抑制肝癌细胞的侵袭和迁移能力。在本项研究中,为了探索EIF3J-AS1促进肝癌肝癌细胞侵袭和迁移的潜在的分子学机制,我们应用了在线数据库GEPIA分析证实EIF3J-AS1与肌动蛋白结合蛋白(anillin actin binding protein,ANLN)在肝癌肿瘤组织中正向相关,定量PCR和蛋白免疫印迹实验表明在肝癌中ANLN蛋白表达收到EIF3J-AS1的正向调控。肌动蛋白结合蛋白在多数肿瘤中均存在较高表达性[17],参与着肿瘤细胞的增殖与迁移,已经成为新型生物治疗的关键点。而ANLN表达在肝癌细胞的发生发展中作用机制尚存在争议,在本研究中我们第一证实EIF3J-AS1可上调ANLN表达,且敲减ANLN表达可抑制肝癌细胞的侵袭和迁移能力。
综上所述,EIF3J-AS1在肝癌中上调表达表与肿瘤大小和癌栓显著相关,是影响总生存预后的独立预测因子。机制方面,EIF3J-AS1通过上调ANLN表达促进肝癌细胞侵袭和迁移能力。EIF3J-AS1有望成为肝癌临床治疗的一种新的治疗靶点。(图3,4,5见封三)
