生物传感检测独脚金内酯的研究与展望
2021-11-11姚瑞枫
方 园,姚瑞枫
(湖南大学生物学院化学生物传感与计量学国家重点实验室植物功能基因组学与发育调控湖南省重点实验室,中国湖南长沙410082)
植物激素独脚金内酯(strigolactones,SLs)是一类由类胡萝卜素衍生的萜类内酯。SL最初被认为是根际寄生杂草如独脚金属(Striga spp.)的萌发刺激物[1],随后被鉴定为丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)的根源共生信号[2]。直至2008年,SL被鉴定为一种新型植物激素,参与抑制植物分枝的过程[3~4]。SL由全反式-β-胡萝卜素经过一系列酶催化加工而来,主要在植物根部合成,并被运输到芽或分泌到根际。目前已鉴定的植物内源性(天然)SL在化学结构上都包含1个三环内酯(ABC-ring)和1个由烯醇醚键连接在一起的单环内酯(D-ring)。目前有30种以上天然SL分子在不同植物中被发现[5~6],不同形式的天然SL的区别主要是ABC-ring上不同形式或位置的基团修饰,但是D-ring严格保持不变[7]。如图1所示,根据其是否具有完整的ABC-ring三环结构,SLs可分为典型和非典型两大类;根据C-ring的立体化学性不同,典型SLs又可分为独角金属(strigol-type)和列当属(orobanchol-type)两类[8~9]。
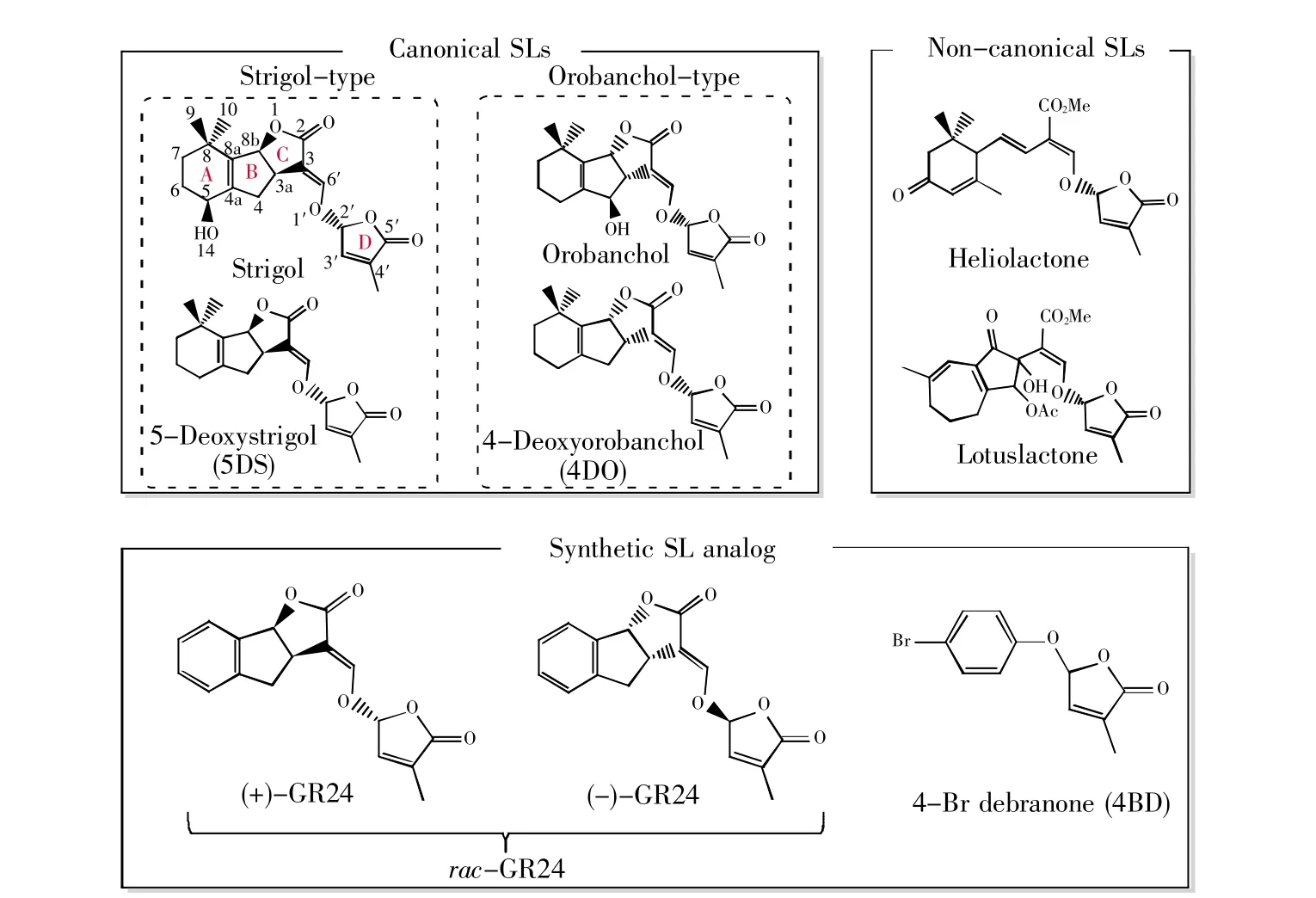
图1 天然的独脚金内酯及其合成类似物的结构和分类Fig.1 Structures and classification of natural SLs and synthetic SL analogs
研究发现,SL不仅可以调控植物的生长发育过程,包括诱导次生生长、加速叶片衰老、刺激节间生长和根系伸长,抑制腋芽的生长、不定根和侧根的形成等[10],还能介导植物对营养匮乏和病原菌等逆境胁迫的抗性反应[11]。寄生杂草独脚金属和列当属植物利用SL促进自身种子萌发并寄生于宿主植物根部,威胁宿主的生存。该类植物可寄生大多数主要粮食作物,在世界范围内感染了超过6千万公顷农田,因此导致每年上百亿美元的经济损失,影响世界粮食安全[12]。现已开发出一些SL受体激动剂和拮抗剂用于寄生杂草控制[13~16],其也可用于调节植物株型,通过改善农作物农艺性状而提高产量[17~19]。此外,SL还可用作植物-微生物共生调节剂,通过促进菌根共生,提高农作物在逆境时的产量。
虽然SL的生物合成、运输和信号转导机制已取得了一系列的突破进展[9,20~21],但是SL在调控植物生长发育机制及其与其他激素的交互作用方面还有待进一步研究,可能还有新的未鉴定的SL或有农业价值的类似物,SL化学合成体系也仍需进一步开发完善[22],这些工作都依赖于SL定量检测方法学的辅助。植物激素在植物体内含量很低(通常约pg/g鲜重),丰度高的其他化合物可能对检测结果造成显著干扰,且当这些干扰物与靶标分析物具有相似结构或物化性质时,对检测结果的影响更大。另外,植物基质的高度复杂性,激素的化学、光和温度稳定性等也增加了分析的难度。相较于其他植物激素,SL在根部分泌物中或植物体内浓度极低[23]。而且,由于烯醇醚键不稳定,SL即使在温和的环境下也易被剪切或水解[24],在纯化过程中很不稳定[25]。因此,植物激素特别是SL的定性和定量分析一直是研究难点。
目前,SL的定量检测主要依赖气相色谱(gas chromatography,GC)或高效液相色谱(high-performance liquid chromatography,HPLC)与串联质谱(tandem mass spectrometry,MS/MS)技术联用,这些基于谱学的检测方法具有高准确度和高灵敏度[26~29]。但是,此类方法在很大程度上依赖于中心化的实验室设备和经验丰富的操作人员,操作繁琐、耗时长、价格高,不适用于原位检测和实时测定[30~32]。另外,虽然快速取样使色谱分析能够提供时间分辨率,但是由于提取物反映的是一个器官(如叶片)中众多细胞的激素浓度平均值,因此无法提供激素水平的空间分辨率,如浓度梯度分布[30]。研发具有较高的灵敏度、特异性和时空分辨率的SL快速检测方法,对于深入阐明SL感知和信号传递机制、调控植物生长发育及对环境变化的响应机制等十分重要。
1 生物传感器
生物传感器是一种对特定生物物质敏感,并可将其浓度转换为定量信号的分析工具或系统。如图2所示,生物传感器由生物敏感材料识别器(bioreceptor)、换能器(transducer)和信号读取系统构成[33]。其中,接受器/识别器需要与换能器具有直接空间连接,而标记物(label)可以被认为是换能器或换能器的一部分。生物传感器的分类方式较多,主要依据识别元件(如酶、抗体、适配体、分子印迹聚合物等)或者换能器(如电极、热电偶、光电管等)进行分类。此外,也依据生物传感器的特性(如微流控)进行分类,或以检测对象进行分类。
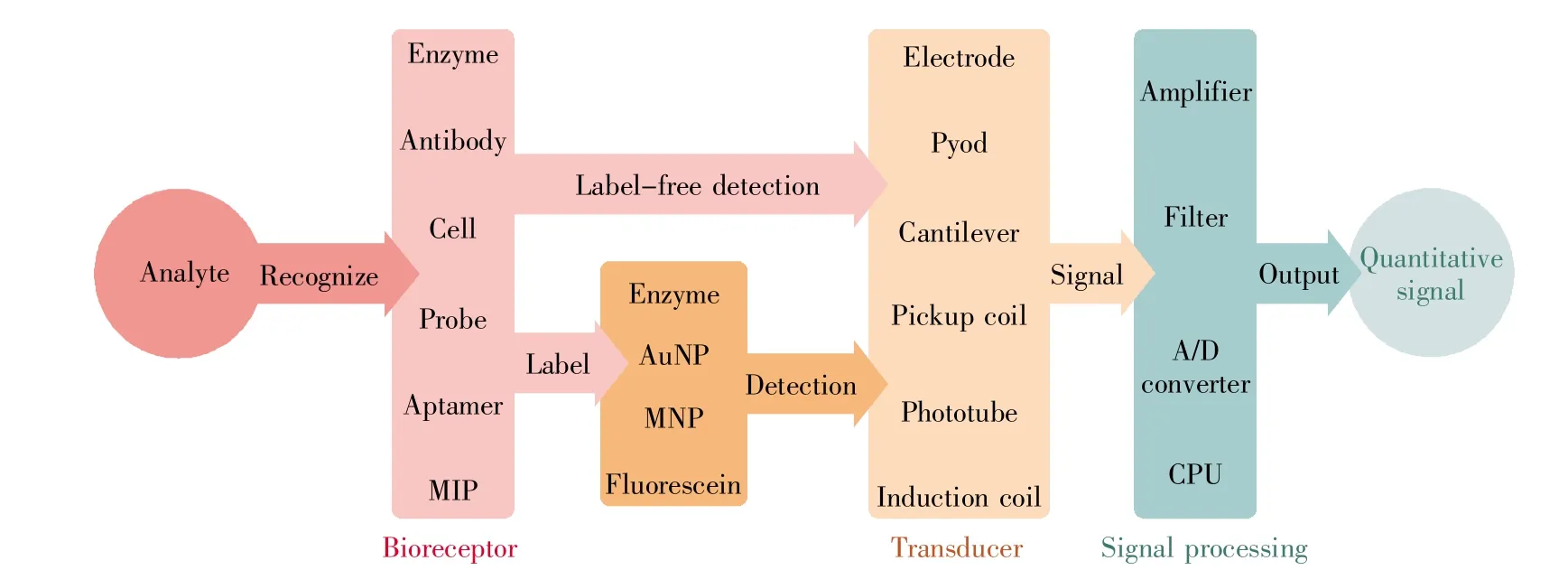
图2 生物传感器示意图MIP:分子印迹聚合物;AuNP:金纳米颗粒;MNP:磁性纳米颗粒。Fig.2 Schematic representation of a biosensorMIP:Molecular imprinting polymer;AuNP:Au nanoparticle;MNP:Magnetic nanoparticle.
生物传感器具有操作简便、响应快速、价格低廉、可选择性高、可重复性高、稳定、特异性好、线性度高等诸多优点[32~33],为灵敏、特异性定量检测SL提供了一种新思路。基于上述诸多优点,生物传感器已被广泛应用于环境监测、疾病检测、食品安全、药物开发等众多领域[33]。生物传感器也广泛应用于小分子如植物激素[34~42]的特异性识别和定量检测(表 1)。
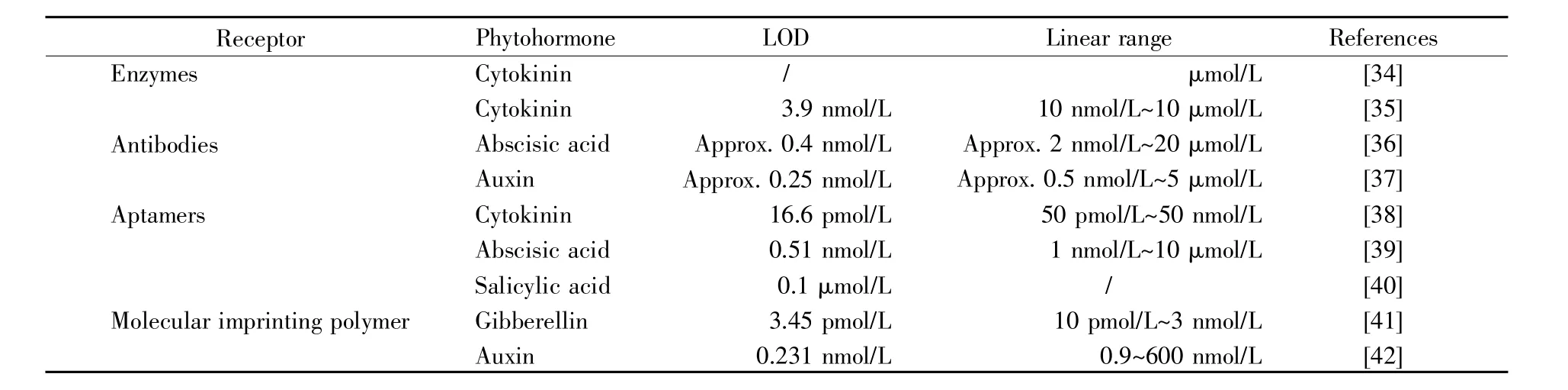
表1 生物传感器在植物激素检测中的应用Table 1 Typical application of biosensors in phytohormone detection
基于酶识别的生物传感器灵敏度高、特异性强、反应迅速,可以在复杂的生物介质(如细胞裂解液和血液)中直接对靶标进行定量检测[43]。然而目前只有有限的分析物(如葡萄糖、乙醇、乙酰胆碱)可用作定量检测体系中酶的底物,且酶对温度敏感、保质期短,因此酶传感器在植物激素检测中的应用较少。另一类常见的生物传感策略为免疫检测,即以抗体作为识别元件检测抗原。抗体可以高亲和力地结合特定分析物,在复杂的生物样本中实现高灵敏度的分析物检测。但是,抗体制备周期长、费用高、对小分子物质识别能力有限,限制了相关策略在植物激素生物传感器方面的应用[32]。分子印迹聚合物(molecular imprinting polymer,MIP)也是一种用于生物传感器的识别元件。MIP是在聚合物材料中引入分子识别位点产生的在空间上与特定模板分子相匹配的、具有高选择性的高分子化合物。MIP与模板分子的结合类似于抗体-抗原反应。MIP性质稳定,制备过程简单、可重复性强,但是制备过程毒性较大。近些年来新型的适配体是通过指数富集配基系统进化(systematic evolution of ligand by exponential enrichment,SELEX)技术从体外随机文库反复筛选获得的DNA或RNA寡链核酸,能够高亲和力、高特异性结合靶标[44]。目前已有数千种适配体被鉴定用于识别蛋白质、多肽、氨基酸、抗生素、小分子化合物、病毒、完整或部分细胞,甚至金属离子等多种靶标,并应用于诊断、治疗、生物传感器和生物分析领域[45]。适配体筛选周期短、识别靶标范围广、批间差小、价格便宜、性质稳定易保存,因此,基于适配体识别的生物传感器是分析检测领域目前重要的研究方向之一[32,45~46]。
2 生物传感器在SL测定中的研究进展
生物传感器虽然为组织内和胞内快速定量SL提供了新的策略,但目前已开发的高灵敏度、高特异性检测SL的生物传感方法十分有限。现已报道的SL生物传感器都是基于内源性SL的感知机制(图3),即当SL存在时,SL被受体蛋白D14/DAD2/RMS3(水稻 Oryza sativa DWARF 14,或拟南芥Arabidopsis thaliana DWARF 14,或矮牵牛Petunia hybrida DECREASED APICAL DOMINANCE 2,或豌豆 Pisum sativum RAMOSUS 3)感知,招募下游信号元件F-box蛋白D3/MAX2(水稻DWARF 3,或拟南芥MORE AXILLARY GROWTH 2)和抑制蛋白D53/SMXL[水稻DWARF 53,或拟南芥SUPPRESSOR OF MAX2 1(SMAX1)-LIKE],形成信号转导蛋白复合体(D3/MAX2-D14/DAD2/RMS3-D53/SMXL)。其中,F-box蛋白家族成员D3/MAX2是SCFD3/MAX2泛素连接酶复合体的底物识别亚基。抑制蛋白D53/SMXL被SCFD3/MAX2泛素化,然后通过26S蛋白酶体降解,从而解除D53/SMXL蛋白对下游转录因子及其自身基因启动子的抑制作用,SL信号从而得以向下游进一步传递并发挥生理作用[22,47]。值得一提的是,SL信号也会导致D14/DAD2的降解[22,48]。基于合成生物学理念,研究人员开发了基因编码的生物传感器,可间接或直接检测SL。

图3 SL信号感知和传递机制模型SCF:Skp1-Cullin-F-box;E2:泛素连接酶 2;Ub:泛素;TPR:TOPLESS-related repressor;SPL:Squamosa promoter binding protein-like。已申请获得该图[22]的电子/印刷版使用授权。Fig.3 A simplified model of strigolactone perception and signal transductionSCF:Skp1-Cullin-F-box;E2:Ubiquitin ligase 2;Ub:Ubiquitin;TPR:TOPLESS-related repressor;SPL:Squamosa promoter binding protein-like.Reprinted with permission from Reference[22].Copyright 2020 American Chemical Society.
2.1 基于合成生物学的SL间接检测
起初研究人员基于SL诱导抑制蛋白D53/SMXL6/SMXL7的降解,通过为该类蛋白质添加荧光蛋白标签,实现了SL的定性检测。Zhou等[49]在水稻根系中外源添加5 μmol/L rac-GR24(合成的SL类似物),引起了D53-GFP的降解。在拟南芥根系中,5 μmol/L rac-GR24处理也诱导了SMXL6-YFP[50]和SMXL7-YFP[51]的降解。首个基于合成生物学的SL定量检测是由Samodelov等[52]制备的一种荧光比率式SL生物传感器(StrigoQuant),该工作构建了REN-2A-SMXL6-FF融合表达体,通过外源添加SL诱导SMXL6-FF降解而导致FF/REN荧光比率下降,从而实现了在拟南芥原生质体内高特异性、高灵敏度的SL定量分析(图4)。对于rac-GR24、rac-orobanchol和 rac-5-deoxystrigol 3种靶分子,StrigoQuant的检测限分别为10 pmol/L、10 nmol/L和100 fmol/L,线性范围约10 pmol/L~1 nmol/L。基于类似理念,Sanchez等[48]开发了一种基因编码的SL生物传感器。不同的是,该传感器是基于SL感知机制引发的受体D14降解,通过SL处理后的转基因拟南芥D14-FF降解致使荧光信号降低,而实现对SL的定量测定。该传感体系的半最大效应浓度(50%maximal effective concentration,EC50)为 1.62 μmol/L(rac-GR24),线性范围为μmol/L级别。相比于StrigoQuant,该传感器使用了植物自身的D14启动子来表达D14-FF,而没有采用外源强启动子,更接近于植物细胞天然的生理环境,但这可能是其灵敏度低于Strigo-Quant的原因之一[48]。另外,灵敏度低也有可能是由于SMXL6是SCFMAX2的直接靶标,比D14更快发生降解;或者外源添加SL处理原生质体或植株时,SL的吸收、运输和分布的情况有差别[48]。

图4 StrigoQuant检测原理示意图P35S是组成型35S启动子;REN是一种绿色荧光素酶,在该传感体系中作为内参元件;FF是一种黄色荧光素酶;SMXL6是拟南芥中参与SL感知信号通路的抑制蛋白;2A是一种自剪切肽,使该体系的REN和SMXL6-FF能够按照化学计量比共表达。已申请获得该图[52]的电子/印刷版使用授权。Fig.4 Schematic of StrigoQuant biosensor designP35S:A constitutive 35S promoter;REN:A renilla luciferase (green,as a normalization element here);FF:A firefly luciferase(yellow);SMXL6:AtSMXL6;2A:A self-processing 2A peptide,leading to stoichiometric coexpression of REN and SMXL6-FF.Reprinted with permission from Reference[52].Copyright 2016 Science Advances.
2.2 基于合成生物学的SL直接检测
Chesterfield等[22]于2020年开发了另一种荧光比率式生物传感器,即rDAD2cpGFP和rSh-HTL7cpGFP,是目前已报道的唯一直接定量检测SL的生物传感器。该工作(图5)将cpGFP(circularly permuted green fluorescent protein)与矮牵牛SL受体DAD2或独脚金(Striga hermonthica)SL受体HTL7整合,使cpGFP可以将外源SL结合其受体引起的构象重排转化为荧光强度变化。为了克服蛋白质表达量和蛋白质降解等差异造成的影响,该传感体系引入了一个对SL不敏感的荧光蛋白LSSmOrange作为内参。LSSmOrange融合到DAD2cpGFP和ShHTL7cpGFP的C端。在表达该传感体系的大肠杆菌裂解液中,rDAD2 cpGFP的EC50为 25.9 nmol/L(rac-GR24)或 70.5 nmol/L(rac-5-deoxystrigol)或 124 nmol/L(rac-orobanchol),线性范围约为 50~500 nmol/L(rac-GR24);rShHTL7 cpGFP的EC50为8.9 nmol/L(rac-GR24),线性范围约为10~100 nmol/L(rac-GR24)。而在烟草原生质体中,rDAD2 cpGFP的EC50为119.3 nmol/L(rac-GR24)。该传感器体外检测SL的灵敏度与目前MS检测限相当:Boutet Mercey等[26]报道使用UHPLCEI-MS/MS分析rac-GR24的检测限为4.94 μg/L(16.6 nmol/L)。该传感体系实现了对SL的高特异性、高灵敏性检测,还可能应用于高通量筛选除草剂(促进寄生杂草自杀性萌发的SL类似物)。相比于现有的其他依赖于SL感知机制的生物传感器,该SL传感器首次实现了在体外和植物原生质体内直接定量检测SL,并且降低了SL感知信号通路中多组分以及D14降解可能涉及未知的基因转录过程对检测结果可能造成的干扰。该工作对于SL的定量检测研究具有重要意义。
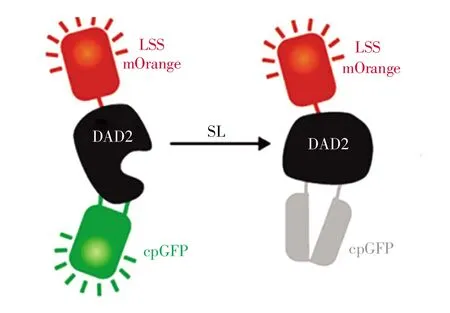
图5rDAD2 cpGFP检测原理示意图SL与受体结合引起的构象变化会使得cpGFP的构象发生重排,导致cpGFP/LSSmOrange荧光比值下降。其中,LSSmOrange对SL不敏感,在此传感体系中作为内参荧光。已申请获得该图[22]的电子/印刷版使用授权。Fig.5 Schematic of the ratiometric DAD2 cPGFP biosensor designThe fluorescence ratio(cpGFP/LSSmOrange)is decreased when strigolactone-induced conformational change is propagated into cpGFP.LSSmOrange,insensitive to strigolactone,is included as an internal flurescent control.Reprinted with permission from Reference[22].Copyright 2020 American Chemical Society.
3 讨论与展望
目前已报道的定量检测SL的生物传感器都是基于合成生物学方法和内源性SL感知机制,不过它们的灵敏度差异较大。基于SMXL6降解的StrigoQuant具有非常高的灵敏度,可以检测的浓度低至 10 pmol/L(rac-GR24)、100 fmol/L(rac-5-deoxystrigol)和 10 nmol/L(rac-orobanchol);基于构象变化的生物传感器(rDAD2 cpGFP和rShHTL7 cp-GFP)的灵敏度次之,对低-中纳摩尔浓度范围的rac-GR24有明显的EC50值;而基于D14降解的生物传感器灵敏度较低,仅对μmol/L浓度范围的rac-GR24有明显的EC50值。这些差异可能是由于上述生物传感器对其他细胞过程的依赖程度不同[22]。比如,在StrigoQuant传感体系中,带有荧光素酶标记的SMXL6蛋白被SCFD3/MAX2泛素连接酶复合体泛素化,可能介导其信号放大。相反,SL感知引起D14降解的过程还有待进一步研究,该过程可能抑制检测信号。而且,不同SL生物传感器采用的各植物物种的SL受体灵敏度可能有差别,同时生物传感器构建过程中对受体的修饰或改造而引起的变化各异,这些都可能影响受体对SL的亲和力[22]。此外,虽然基于D14降解的SL生物传感器灵敏度不高,但是构建该传感器使用的是植物自身的D14启动子,更接近于植物细胞天然的生理环境。
上述生物传感器中,只有rDAD2 cpGFP和rShHTL7 cpGFP是直接和定量检测SL,为测定植物SL浓度和揭示SL信号转导过程提供了新手段。在已知的识别器中,适配体的3D折叠结构使其可与多种靶标结合形成稳定的复合物,如蛋白质、核酸和小分子等[46]。至今已筛选出数百个适配体适用于识别小分子[32]。相对于抗体,适配体具有显著的优势,如可识别低免疫原性的小分子、制备时间短、成本低、批间差小、易修饰、稳定易保存等。因此可以考虑采用适配体作为识别元件,实现体外高特异性、高灵敏度、快速准确地直接测定SL浓度。
为了深入理解SL的生理效应,实时检测SL的浓度和时空分布具有重要的意义。基因编码的生物传感器具有在转基因植物中特异性定量测定植物激素和无侵入性成像的特点[30],在分析活细胞中植物激素的浓度和分布的动态变化方面具有巨大的潜力。比如,近期Birte Höcker和Gerd Jürgens团队[53]报道了一种基于FRET的基因编码生物传感器(AuxSen),其能够在细胞和亚细胞水平实时可视化监测生长素的浓度和时空分布,以及生长素对环境变化的响应。AuxSen的构建以大肠杆菌色氨酸抑制蛋白TrpR作为识别元件,经过基因工程改造,使其仅与IAA牢固结合,而不再与TRP结合。使用异源识别元件降低了其干扰植物自身信号通路的可能性[30]。不同于传统的依赖于内源性生长素响应机制的生长素时空分布研究(如DIIVENUS[54]),AuxSen与生长素的相互作用以可逆的方式诱导FRET比值变化,因此能够监测生长素浓度的快速瞬时变化。该工作对实时、可视化、原位检测活体植物体内其他激素的浓度和分布提供了新视角。
此外,SL与其他植物激素在调控植物生长发育过程的交互作用还没完全阐明。为构建更全面的激素组学信息,未来可以开发同时检测多种类植物激素的传感体系,实现多种植物激素的高时空分辨率测定。
目前,性价比高、快速、灵敏、特异性定量检测SL的生物传感器有限,今后SL定量检测的主要趋势可能仍然以合成生物学方法为主。而适配体生物传感器由于其在小分子检测领域独特的优势,很可能将进一步推进高灵敏度、高特异性、简单、快速的SL定量检测研究。期望不久的将来,可以实现在细胞和亚细胞水平实时、可视化、动态监测SL的浓度和时空分布。SL检测方法的理论和技术研究,将有助于SL生物合成、运输、感知和信号传递机制的进一步揭示,从而为植物株型和共生特性的定向遗传改良,以及根际寄生杂草生物/化学防治提供支撑,具有重要科学意义和应用前景。
