辣椒子叶离体再生及组织细胞学分析
2021-11-11魏绍琦匡雪梅邱义兰
高 艺,魏绍琦,匡雪梅,邱义兰
(湖南师范大学生命科学学院作物不育资源创新与利用湖南省重点实验室,中国湖南长沙410081)
辣椒属茄科,富含维生素和多种矿质元素等营养成分,同时具有药用价值,是一种深受人们喜爱的重要的蔬菜作物和调味品,在世界范围内广泛栽培。采用传统育种方法选育优良辣椒品种耗时耗力,而且易造成作物遗传多样性的下降和有益基因的流失。在高效离体再生体系基础上开展的转基因技术,是定向改良辣椒目标性状和开展功能基因组学研究的有力工具,但其巨大潜力的发挥依赖于高效离体培养再生体系的建立。辣椒属于顽拗型离体再生和遗传转化的植物[1~4]。自Gunay于1978年首次开展辣椒组培工作至今四十余年,相继有关于探索辣椒离体再生的文献报道。据报道,辣椒离体再生的成功取决于辣椒基因型、培养基营养成分、植物生长调节剂浓度与组合、生长室光温条件、外植体类型等[4~6]。然而,当前辣椒离体再生技术主要停留在芽诱导阶段,仍然存在芽难以伸长、生根困难等问题。为了探索辣椒离体再生不定芽的伸长,一些研究者通过添加GA3诱导不定芽伸长,但芽的伸长效率低,且存在基因型依赖等问题[4,7~8]。因此,辣椒通过组织培养获得再生体系的技术一直未获得重大突破。这限制了辣椒遗传转化体系的建立和基因工程在辣椒遗传改良上的应用,故亟待建立高效、稳定的辣椒离体再生体系。此外,虽然有关辣椒子叶离体再生的组织细胞学研究有零星的报道[9~10],但对其起源和发育过程缺乏系统的研究。在本研究中,我们选取辣椒骨干亲本8214B子叶为实验材料,建立了一种适于辣椒离体再生的方法,同时对其发生发育过程进行了细胞学研究,为辣椒遗传转化体系的建立、进一步开展辣椒基因功能的验证和应用基因工程技术对辣椒遗传改良的有效应用等方面的工作奠定了重要基础。
1 材料与方法
1.1 材料
实验材料来自湖南省蔬菜研究所创制的辣椒骨干亲本8214B。该材料具有抗逆强、配合力高、适应广等优势,已成功育出多个优良的辣椒新品种,并在我国大面积推广,是我国应用范围最广的骨干亲本之一[11]。
外植体选用辣椒无菌苗子叶。
1.2 无菌苗培养
挑选健康无病菌的辣椒8214B种子,用纯净水浸种约48 h后转入超净工作台中进行表面消毒处理。先用75%乙醇对辣椒种子消毒60 s,然后用0.1%升汞消毒10 min,接着用无菌水冲洗4次,每次2 min,最后将种子接种于MB培养基(MS大量元素+MS微量元素+MS铁盐+B5有机成分,添加3%白糖和0.5%琼脂粉,pH=5.8)上进行光照培养(温度25℃±2℃ ,光强2 500 lx,光周期14 h光照/10 h黑暗,下同)。约10 d,种子开始萌发,生长7 d后形成无菌苗。
1.3 子叶离体再生的诱导
选取即将展开或刚展开的无菌苗子叶,用锋利的无菌刀片把子叶(带叶柄)切下,去除叶尖,将两端各有切口的子叶接种于诱导培养基上进行暗培养(温度25℃±2℃),子叶腹面朝上、背面朝下接触培养基。诱导培养基以MB为基本培养基,添加IAA(0.05 mg/L)与不同浓度配比的6-BA(0 mg/L、1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L、9.0 mg/L)和/或 ZT(0 mg/L、1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L、9.0 mg/L)组合(pH=5.8),每个组合接种子叶不超过20个,每个组合设4次重复。暗培养20 d后观察离体子叶再生的诱导和生长情况,统计再生诱导率。
离体子叶再生诱导率(%)=诱导再生的外植体数/接种的总外植体数×100%,下同。
1.4 子叶离体再生的组织细胞学观察
植物材料选取8214B带柄子叶外植体,釆用前面优化的最适诱导培养基和培养条件对子叶进行离体培养(1对子叶/瓶),每3 d取样1次,重复4次,共取样10次,进行石蜡切片制作[12],光学显微镜(Olympua-bx51,日本)观察拍照并分析结果。
1.5 离体子叶不定芽的伸长
1.5.1 GA3对不定芽伸长的影响
将子叶离体再生诱导形成的叶状体置于不同浓度GA3配比的诱导培养基中进行光照培养,10 d继代一次,20 d后观察不定芽伸长情况,并统计不定芽的伸长频率。诱导不定芽伸长的培养基以MB为基本培养基,在上述获得的适宜诱导培养基的激素组合的基础上添加不同浓度配比的GA3(1.0 mg/L、2.0 mg/L、3.0 mg/L),每个组合接种10个再生诱导形成叶状体的离体子叶,每瓶1个离体子叶,设4次重复。
不定芽伸长率(%)=诱导不定芽伸长的子叶数/接种的子叶总数×100%,下同。
1.5.2 删减叶状体对不定芽伸长的影响
用锋利的无菌刀片切除叶状体,只留1~2对呈对生状的长条形叶状体,在伸长培养基中进行光照培养,7~8 d继代一次,20 d后观察不定芽伸长情况,并统计不定芽的伸长频率。伸长培养基配方:MB为基本培养基,添加IAA(0.05 mg/L)与不同浓度配比的 6-BA(1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L、9.0 mg/L)和/或 ZT(1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L、9.0 mg/L)组合(pH=5.8)。每个处理接种6对子叶,每瓶1对子叶,重复4次。
2 结果与分析
2.1 离体子叶的再生诱导
辣椒离体子叶在再生诱导过程发生了一系列的形态变化。离体子叶先进行暗培养:暗培养3 d时可见子叶由碧绿转为黄绿;暗培养5 d时子叶增大增厚,两端切口处开始形成愈伤组织;暗培养10 d时子叶体积进一步增大,在叶柄端切口可见浅黄色透明状愈伤组织,叶尖端切口形成白色愈伤组织;暗培养21 d时子叶叶柄端切口处诱导再生形成黄色叶状体(图1A)。随后,经暗培养的离体子叶见光培养,7 d后子叶颜色由浅黄色转为绿色,在子叶背面形成白色愈伤组织,叶柄端切口处再生的叶状体转绿,且体积明显增大(图1B)。

图1 辣椒离体子叶在再生诱导过程中的形态变化(Bars=0.2 cm)(A)暗培养21 d的离体子叶,叶柄端切口处再生黄色叶状体,叶尖端切口再生白色愈伤组织;(B)暗培养21 d后再光照培养7 d的离体子叶,子叶及叶柄端再生的叶状体转绿且体积明显增大。Fig.1 Morphological changes of cotyledon explants during induction of in vitro regeneration(Bars=0.2 cm)(A)Cotyledon explants cultured in vitro in darkness for 21 days.Light yellow leafy structures can be seen at the petiole end and white calli at the opposite end;(B)Cotyledon explants cultured in darkness for 21 days and then under light for 7 days.The color of cotyledons changed from light yellow to green,and leafy structures significantly enlarged and their color changed from yellow to green.
外源激素对辣椒离体子叶再生诱导的效果见表1。从表1中可看出,带柄子叶是一种很容易诱导再生的外植体,单独添加6-BA和ZT或者不同浓度6-BA和ZT的组合均能100%诱导带柄子叶叶柄端切口再生形成叶状体,但不能形成可正常伸长的不定芽,其再生形成的叶状体的状态存在差异。单独添加1.0~9.0 mg/L 6-BA,带柄子叶的叶柄端切口分化的叶状体呈玫瑰花瓣状,且数量较多;1.0~4.0 mg/L 6-BA条件下子叶形成的愈伤组织相对少,叶状体生长缓慢,而5.0~9.0 mg/L 6-BA条件下子叶形成的愈伤组织较多,叶状体生长较快。单独添加不同浓度ZT诱导子叶再生的叶状体形态存在明显差异:低浓度ZT(1.0~3.0 mg/L)条件下形成的叶状体短小呈玫瑰花瓣状,其数量也少;ZT浓度增加至5.0~9.0 mg/L时,子叶叶柄端切口处形成的叶状体较大,大部分叶状体呈玫瑰花瓣状,少部分呈长条形。然而,由于ZT诱导子叶形成的愈伤组织少,叶状体生长缓慢。不同浓度6-BA和ZT组合能100%诱导子叶叶柄端切口再生形成叶状体,且数量较多,但是不同浓度组合诱导再生的叶状体状态及其生长存在差异:低浓度6-BA和低浓度ZT组合诱导的叶状体的体积小呈玫瑰花瓣状,数量较少,生长缓慢,随着6-BA和ZT浓度的增加,诱导的叶状体体积较大且数量多,当6-BA≥5.0 mg/L时,由于子叶形成较多的愈伤组织,叶状体生长较快。3.0~9.0 mg/L ZT和5.0~9.0 mg/L 6-BA组合均能使子叶再生较多的叶状体,大部分叶状体呈玫瑰花瓣状,少部分呈长条形(包括极少数对生的长条形),且叶状体生长快,因此该浓度组合适宜于子叶离体再生的诱导。
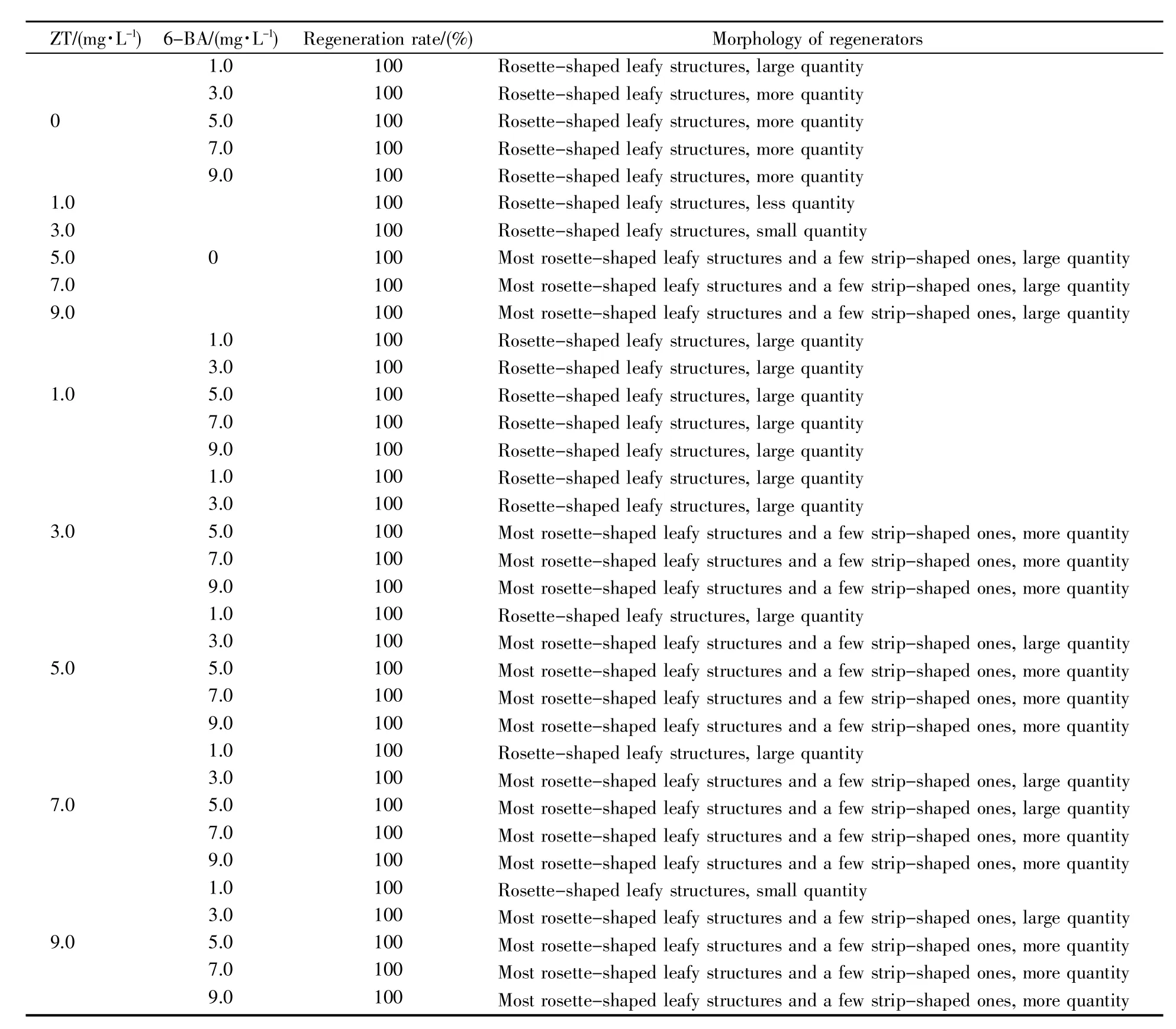
表1 不同浓度ZT和/或6-BA配比对辣椒离体子叶再生的影响Table 1 Effects of different concentrations of ZT and/or 6-BA on in vitro regeneration of cotyledons in pepper
2.2 离体子叶再生的组织细胞学观察
辣椒子叶由表皮、皮层和维管组织组成。表皮包括上表皮和下表皮,两者均由单层细胞紧密排列。皮层分为栅栏组织和海绵组织,栅栏组织靠近上表皮,细胞呈柱状紧密排列,海绵组织细胞形状不规则,排列疏松。维管束散布在皮层中,由大维管束和小维管束组成。培养3~3.5 d后,离体子叶叶柄端切口处的上表皮以及与维管束之间近腹面一侧的薄壁细胞去分化,细胞分裂活跃,尤其是上表皮及其内侧薄壁细胞染色较深,具有大的细胞核和浓厚的细胞质(图2A,B);此时,叶柄端切口附近的细胞未去分化,细胞分裂不活跃(图2C)。培养5~7 d后,离体子叶叶柄端切口处上表皮及其内侧薄壁细胞脱分化并分裂形成分生细胞团(图2D),此时叶柄端切口附近的上表皮内侧薄壁细胞也发生脱分化并进行活跃的细胞分裂,形成染色较深的分生细胞团(图2E);分生细胞团的形成具有时空分布特征,它们在上表皮不同部位先后形成(图2F)。当培养8~11 d时,分生组织细胞团明显增大,但未见典型的芽分化,随着分生组织细胞团的增大其分化形成叶状体。在子叶离体培养过程中形成两种分生细胞团:一种是单个分生细胞团,在分裂和分化过程中呈球形和心形(图2G),其随着体积的增大最后分化形成长条形的叶状体(图3H);另一种类型是在分裂和分化过程中几个相邻的分生细胞团连在一起,它们最终形成花瓣状的叶状体(图2I,J)。

图2 辣椒子叶叶柄端离体再生的组织细胞学观察(Bars=50 μm)(A)离体培养3 d的子叶切口处,上表皮及与维管束之间腹面一侧薄壁细胞染色较深;(B)图A的局部放大,上表皮及内侧薄壁细胞质浓厚,细胞核大;(C)离体培养3.5 d的子叶近切口处,表皮及薄壁细胞未见脱分化;(D)离体培养5.5 d的子叶切口处,上表皮及内侧薄壁细胞脱分化,分裂活跃开始形成分生细胞团;(E)离体培养6.5 d的子叶近切口处,诱导形成的分生细胞团;(F)离体培养6.5 d的子叶切口处,上表皮不同部位先后形成分生细胞团;(G)离体培养7.5 d的子叶诱导形成的单个分生细胞团呈球形和心形;(H)离体培养10.5 d的子叶诱导形成的分生细胞团分化成长条形叶状体;(I)离体培养10.5 d的子叶诱导形成的相邻分生细胞团连在一起;(J)离体培养11 d的子叶诱导形成的分生细胞团分化成花瓣状叶状体。Fig.2 Histocytological observation of in vitro regeneration of cotyledons in pepper(Bars=50 μm)(A)The incision of cotyledons cultured in vitro for 3 days.Some cells,including upper epidermal ones and the parenchyma ones between the upper epidermis and the vascular bundle,were deeply stained;(B)The local enlargement of Fig.A.The upper epidermal cells and their adjacent parenchyma ones had dense cytoplasm and a large nucleus;(C)A part next to the incision of cotyledons cultured in vitro for 3.5 days.The epidermal and parenchyma cells did not dedifferentiate;(D)The incision of cotyledons cultured in vitro for 5.5 days.The upper epidermal cells and their inside parenchyma ones dedifferentiated,which divided actively and began to form the meristematic cell mass;(E)A part next to the incision of cotyledons cultured in vitro for 6.5 days.The formation of meristematic cell mass was induced;(F)The incision of cotyledons cultured in vitro for 6.5 days.The meristematic cell masses were successively formed from different parts of the upper epidermis;(G)Cotyledons cultured in vitro for 7.5 days.The single meristem cell mass was sphere-or heart-shaped;(H)Cotyledons cultured in vitro for 10.5 days.The meristematic cell mass differentiated into a long strip-shaped leafy structure;(I)Cotyledons cultured in vitro for 10.5 days.The adjacent meristematic cell masses connected together;(J)Cotyledons cultured in vitro for 11 days.The meristematic cell mass differentiated into a rosetteshaped leafy structure.
2.3 离体子叶再生芽的伸长诱导
2.3.1 GA3对离体子叶再生芽伸长的影响
辣椒离体子叶在诱导培养基上可诱导再生形成不同形态的叶状体,约98%的子叶离体再生的叶状体数量多且大部分呈玫瑰花瓣状,仅有约2%的子叶形成的叶状体数量少且呈长条形。用无菌刀片将叶状体从离体子叶上切下,置于添加不同浓度GA3的诱导培养基中进行培养,结果表明:当离体子叶再生的叶状体数量多且呈玫瑰花瓣状时,在添加1.0~2.0 mg/L GA3的诱导培养基中生长7 d后,叶状体呈淡绿色,叶明显伸长且变薄,但是未形成伸长的再生芽(图3A),继续生长7 d后,子叶愈伤组织褐化,叶状体脱落;在添加3.0 mg/L GA3的诱导培养基中生长7 d后,叶状体易形成水渍状,叶明显伸长,但也未形成伸长的再生芽。当离体子叶再生的叶状体呈对生状、长条形且数量少(为1~3 对)时,在添加 1.0~2.0 mg/L GA3的诱导培养基中生长7 d后,其再生芽明显伸长,叶柄及叶片也伸长,叶片变薄呈淡绿色(图3B);3.0 mg/L GA3诱导培养的叶状体的再生芽也能明显伸长,但是易形成水渍状。因此,1.0~2.0 mg/L GA3对离体子叶再生形成的数量少且呈长条形对生的叶状体的再生芽伸长具有明显的促进作用,但是对玫瑰花瓣状叶状体及非对生叶状体再生芽的伸长作用不明显。

图3 GA3对辣椒子叶叶状体再生芽伸长的影响(Bars=0.2 cm)(A)在添加2.0 mg/L GA3的诱导培养基中光照培养7 d后,花瓣状叶状体再生芽未见伸长;(B)在添加2.0 mg/L GA3的诱导培养基中光照培养7 d后,对生叶状体的再生芽明显伸长。Fig.3 Effects of GA3on the elongation of regenerated buds from leafy structures in cotyledon explants of pepper(Bars=0.2 cm)(A)Rosette-shaped leafy structures cultured under light for 7 days in the induction medium with 2.0 mg/L GA3.The regenerated buds did not elongate;(B)An opposite strip-shaped leafy structure cultured under light for 7 days in the induction medium with 2.0 mg/L GA3.The regenerated bud obviously elongated.
2.3.2 删减叶状体对离体子叶再生芽伸长的影响
辣椒离体子叶在适宜的诱导培养基上再生形成的叶状体未删减直接在伸长培养基中继续生长,未见再生芽的伸长(图4A)。用锋利的无菌刀片将叶状体删减,只留1~2对呈对生的长条形叶状体,删减叶状体在伸长培养基中生长2周后,再生芽明显伸长,叶片碧绿呈长椭圆形,茎粗壮(图4B)。伸长培养基中不同浓度配比的ZT和BA对再生芽伸长的影响见表2。从表2中可以看出:1.0 mg/L ZT与1.0~9.0 mg/L 6-BA组合能使再生芽伸长率≤40%;随着ZT浓度的增加,叶状体再生芽的伸长率明显升高,3.0~7.0 mg/L ZT 与 5.0~9.0 mg/L 6-BA组合能使再生芽伸长率高于67%;5.0~7.0 mg/L ZT与7.0 mg/L 6-BA组合培养的再生芽伸长率最高,为88%~90%,显著高于其他组合,是适宜于再生芽伸长培养基中的激素组合。经删减仅存1~2对呈对生状的长条叶状体在适宜的伸长培养基上生长约15 d后,再生芽伸长4~5 cm,为3~4叶1心的生长阶段。
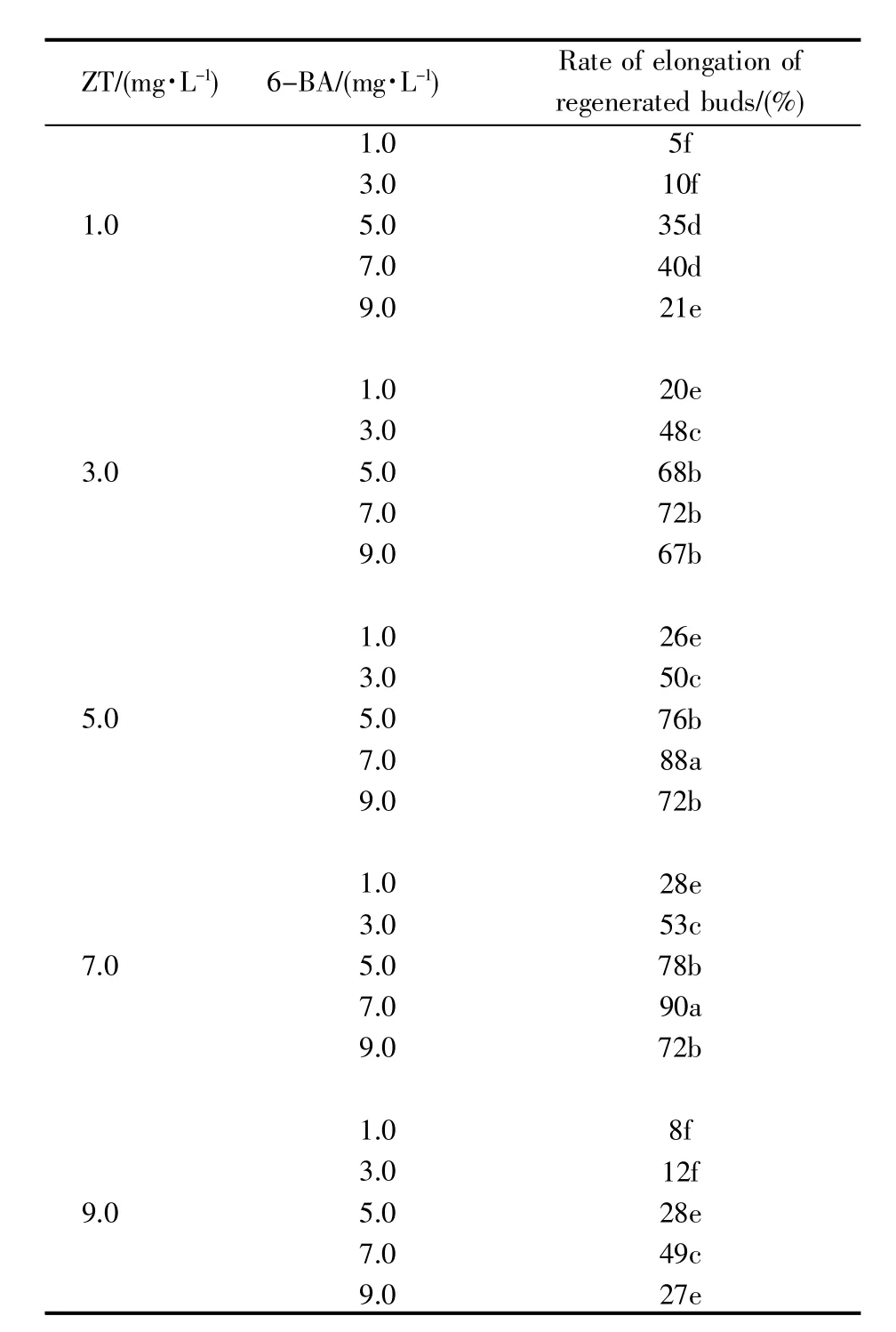
表2 不同浓度配比的ZT和BA对再生芽伸长的影响Table 2 Effects of different concentrations of ZT and/or 6-BA on the elongation of regenerated buds in pepper

图4 删减叶状体对辣椒子叶叶状体再生芽伸长的影响(Bars=0.2 cm)(A)未删减的叶状体在伸长培养基中光照培养2周后未见再生芽伸长;(B)经删减仅剩1~2对对生的长条形叶状体在伸长培养基中光照培养2周后再生芽明显伸长。Fig.4 Effect of pruning the leafy structures on the elongation of regenerated buds in cotyledon explants of pepper(Bars=0.2 cm)(A)Leafy structures not pruned and cultured under light for two weeks in the elongation medium.No buds elongated;(B)Leafy structures cultured under light for two weeks in the elongation medium after the rosette-like ones were pruned out and only 1~2 pairs of opposite strip-shaped ones remained.The bud obviously elongated.
3 讨论
3.1 辣椒子叶的离体再生
辣椒属于离体再生困难的植物,其外植体常常分化为叶状体,叶状体的芽难以伸长会限制根的形成,使其不能形成完整植株,影响离体再生体系的建立,进而影响辣椒遗传转化的研究。辣椒子叶常被用作离体再生的外植体,其愈伤组织的诱导率高于茎尖、上胚轴、下胚轴等其他外植体。据报道,处于分化状态的辣椒子叶回复到分裂状态并开始快速的分裂分化需要适宜的外源激素,细胞分裂素6-BA搭配生长素IAA可成功诱导辣椒子叶再生,但不定芽伸长困难是限制该离体再生技术体系建立的瓶颈[4,13]。在本研究中,辣椒带柄子叶是一种离体再生率非常高的外植体,生长素IAA与细胞分裂素6-BA和/或ZT搭配可100%诱导子叶再生形成叶状体,但叶状体的状态与细胞分裂素的类型及其浓度密切相关:6-BA主要诱导离体子叶叶柄端切口玫瑰花瓣状叶状体形成,ZT诱导再生的叶状体包括玫瑰花瓣状和长条形,而切口端愈伤组织的形成与6-BA密切相关。愈伤组织的快速生长有利于从培养基中获得包括植物激素在内的营养物质以供叶状体的生长。本文的研究结果显示,在辣椒离体子叶再生过程中,5.0~9.0 mg/L 6-BA 与 3.0~9.0 mg/L ZT配比组合,使离体子叶再生形成的叶状体大部分呈玫瑰花瓣状,少部分呈正常长条形,且生长速度较快。
不定芽的伸长是辣椒离体再生成苗的关键。大多数学者认为,GA3在辣椒不定芽伸长过程中是必需的,可促进不定芽伸长[4,7~9]。有研究者在辣椒子叶离体再生过程中发现,培养基中添加椰子水和AgNO3对芽的伸长有促进作用[14]。此外,有研究者发现,及时切割分离叶丛或者膨大的叶状体也有利于获得更多的伸长芽,推测其可能与叶丛的通气、光照状况有关[15]。在本研究中,GA3对离体子叶再生形成的数量少且呈对生状的长条形叶状体的再生芽伸长具有明显的促进作用,可使其形成叶色淡绿的纤细再生芽,但它们却难以生根。与此不同,GA3对花瓣状叶状体及非对生状叶状体的芽伸长的作用不明显。基于以上信息,我们创立了一种简单易行的能使再生芽伸长的方法:删减叶状体至仅存留1~2对对生状态的长条形叶状体。结果显示,经删减的叶状体在添加外源激素6-BA、ZT和IAA的培养基上被成功诱导再生芽伸长,形成叶色碧绿、健壮的再生芽,它们极易生根,形成根系发达、生长健壮的苗,经炼苗移栽后,成活率高达100%。因此,辣椒离体再生不定芽的伸长与诱导再生的叶状体状态及其数量紧密相关。
3.2 辣椒子叶离体再生诱导的组织细胞学研究
在植物离体培养中,外植体由特定部位的细胞先启动分裂形成愈伤组织产生胚性细胞,分化形成带有原套和原体的生长锥等不定芽早期结构或者原胚等体细胞胚的早期结构,这些早期结构经过一系列发育过程最终形成不定芽或者体细胞胚[12,16]。据报道,辣椒子叶离体培养诱导叶状体由子叶叶柄端切口处直接诱导的畸形凸起发育而来,它们难以形成正常的芽,推测这种畸形发育的叶状体可能与分生组织退化有关,而不是现有分生组织的芽发育缺陷[9]。在本研究中,辣椒离体子叶叶柄端诱导再生形成叶状体,大部分叶状体呈玫瑰花瓣状,少部分呈长条形(其中极少数呈对生状),未见正常芽的分化。组织细胞学分析显示,子叶叶柄端再生的愈伤组织起源于上表皮及其内侧的薄壁细胞,通过细胞分裂和分化形成分生细胞团,这些分生细胞团的形成具有特定的时空特征,它们相继突出上表皮。然而,分生细胞团未见生长锥等不定芽早期结构的分化,不能直接形成芽,而是与周围的愈伤组织细胞一起形成叶状体。值得一提的是,我们观察到极少数呈球型和心型的单独的分生细胞团,它们可能继续分化形成对生状的叶状体。在添加外源细胞分裂素6-BA和ZT以及生长素IAA的培养基的基础上,不管GA3的添加与否,均能成功诱导对生状叶状体的再生芽明显伸长,却不能诱导非对生状的叶状体再生芽伸长。因此,辣椒子叶诱导再生过程中叶状体的形成可能是其分生组织的芽发育缺陷,而非分生组织的退化所致;对生的叶状体的芽在诱导过程中能形成,但处于生长停滞而非退化状态,随着叶状体的删减,营养物质和激素的集中使芽能快速生长伸长。
