注射用白眉蛇毒血凝酶引起出血患者纤维蛋白原减少的相关因素分析
2021-11-11杨杏婷麦建志
杨杏婷,麦建志
(南方医科大学顺德医院附属杏坛医院药剂科 广东 佛山 528300)
注射用白眉蛇毒血凝酶是从我国长白山白眉蝮蛇的蛇毒中提取出来的一种血凝酶,可使血管破损处凝血速度加快,而不干扰正常生理性凝血系统,在临床各科被广泛应用[1-2]。国外文献报道,静脉注射蛇毒血凝酶5 min后,健康正常成年人血浆纤维蛋白原浓度下降[3]。因其有效降低纤维蛋白原成为纤维蛋白,连续使用不宜超过7 d。近年来国内外有多篇文献报道,出血患者在使用注射用白眉蛇毒血凝酶后出现严重低纤维蛋白原不良反应事件,需要马上停药并输注冷沉淀及新鲜冰冻血浆后可转归[4-8]。但目前尚无对发生上述事件的相关因素作出多病例系统性分析的研究,对临床使用注射用白眉蛇毒血凝酶需要注意的事项不能起到指导作用。本文就使用注射用白眉蛇毒血凝酶后致低纤维蛋白原的相关因素进行探讨,为临床安全使用注射用白眉蛇毒血凝酶提供参考的依据,防范因低纤维蛋白原的不良反应而导致患者住院时间延长和住院费用增加,规避医疗风险。
1.资料与方法
1.1 一般资料
选择我院2020年1月—12月使用注射用白眉蛇毒血凝酶的病例342例。纳入标准:注射用白眉蛇毒血凝酶的使用剂量在说明书推荐剂量范围内,使用疗程不超过7 d。排除标准:①存在肝脏疾病、血液系统疾病、免疫系统疾病患者;②使用纤维蛋白原类药物和具有严重肝毒性药物的患者;③同期未进行纤维蛋白原、血常规、凝血功能、肝肾功能检查或其他用药数据缺失的患者。根据以上纳入标准,剔除不符合标准242例,剩余100例纳入本次调查。其中发生低纤维蛋白原的患者(低于正常值2.0 g/L)29例为低纤维蛋白组,纤维蛋白原正常的患者(2.0~4.0 g/L)71例正常组。通过对两组患者的性别和年龄进行比较,两组患者年龄无显著差异(P= 0.395),低纤维蛋白原组男性的比例较纤维蛋白原正常组高,差异有统计学意义(P= 0.043)。
1.2 研究药品
注射用白眉蛇毒血凝酶(商品名:邦亭,批准文号:国药准字H20080428,规格:0.5单位KU)。
1.3 信息收集
收集两组患者的一般情况(年龄、性别)、注射用白眉蛇毒用药情况(总剂量,合并用药情况)、生化指标检测(肝功能、血常规、凝血功能)。肝功能指标包括ALT、AST、ALP、GGT、总胆红素和白蛋白;血常规指标包括白细胞计数、中性粒细胞百分率、红细胞计数、血红蛋白和血小板计数;凝血功能包括INR、PT、TT、APTT和FIB等相关信息。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析,计量资料先用t检验和Mann Whiyney U检验,再采用单因素和二项Logistic回归分析引起纤维蛋白原减少的影响因素,并对相关的连续性变量绘制受试者工作特征曲线(recciver operating characteristic curve,简称ROC曲线)筛选切点,P<0.05为差异有统计学意义。
2.结果
2.1 患者的用药情况
2.1.1 注射用白眉蛇毒血凝酶剂量 100例患者注射用白眉蛇毒血凝酶使用平均总剂量是3.53 KU,纤维蛋白原正常组患者使用白眉蛇毒血凝酶平均总剂量是2.85 KU,低纤维蛋白原组患者使用白眉蛇毒血凝酶平均总剂量是5.17 KU,两组比较差异有统计学意义(P= 0.029)。
2.1.2 合并用药 患者中合并使用的止血药有卡络磺钠、注射用维生素K1。参考说明书,注射用白眉蛇毒血凝酶与卡络磺钠和注射用维生素K1没有相互作用的记载。低纤维蛋白原组合并使用其他止血药有12例(41%,12/29),纤维蛋白原正常组合并使用其他止血药有8例(11%,8/71)。低纤维蛋白原组的患者合并用药的比例较纤维蛋白原正常组高,差异有统计学意义(P= 0.001)。
2.2 患者的血常规、肝功能、肾功能和凝血功能指标情况
两组用药前的血常规、肝功能、肾功能和凝血功能指标进行单因素分析,发现低纤维蛋白原组患者用药前的ALB、TP、PLT、FIB四项指标较纤维蛋白原正常组低,而凝血功能指标中INR、PT两项指标较纤维蛋白原正常组高,差异具有统计学意义(P<0.05)。两组患者血常规、肝功能、肾功能和凝血功能指标比较,见表1。
表1 两组患者血常规、肝功能、肾功能和凝血功能指标比较(±s)
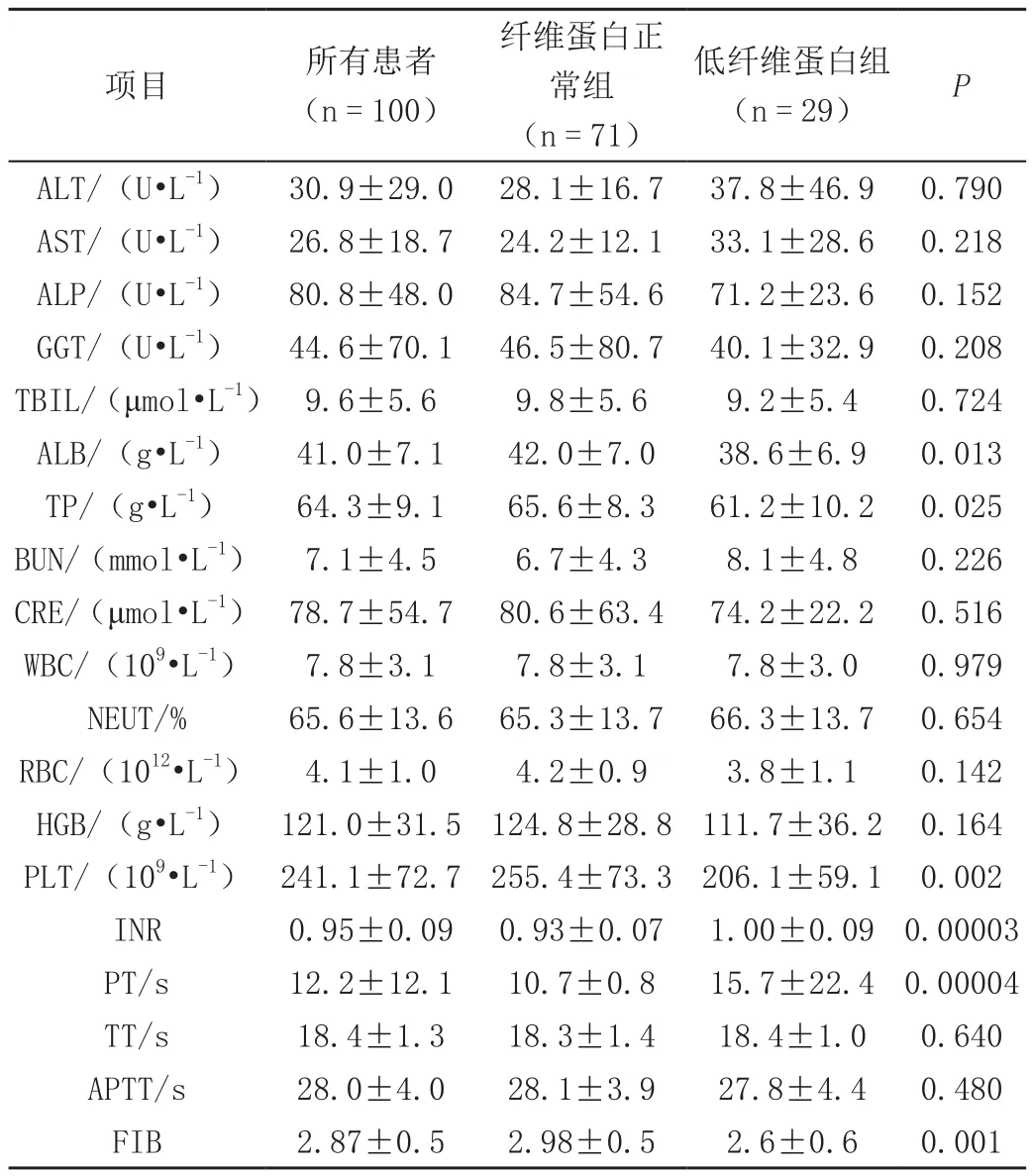
表1 两组患者血常规、肝功能、肾功能和凝血功能指标比较(±s)
项目 所有患者(n = 100)纤维蛋白正常组(n = 71)低纤维蛋白组(n = 29) P ALT/(U•L-1) 30.9±29.0 28.1±16.7 37.8±46.9 0.790 AST/(U•L-1) 26.8±18.7 24.2±12.1 33.1±28.6 0.218 ALP/(U•L-1) 80.8±48.0 84.7±54.6 71.2±23.6 0.152 GGT/(U•L-1) 44.6±70.1 46.5±80.7 40.1±32.9 0.208 TBIL/(μmol•L-1) 9.6±5.6 9.8±5.6 9.2±5.4 0.724 ALB/(g•L-1) 41.0±7.1 42.0±7.0 38.6±6.9 0.013 TP/(g•L-1) 64.3±9.1 65.6±8.3 61.2±10.2 0.025 BUN/(mmol•L-1) 7.1±4.5 6.7±4.3 8.1±4.8 0.226 CRE/(μmol•L-1) 78.7±54.7 80.6±63.4 74.2±22.2 0.516 WBC/(109•L-1) 7.8±3.1 7.8±3.1 7.8±3.0 0.979 NEUT/% 65.6±13.6 65.3±13.7 66.3±13.7 0.654 RBC/(1012•L-1) 4.1±1.0 4.2±0.9 3.8±1.1 0.142 HGB/(g•L-1) 121.0±31.5 124.8±28.8 111.7±36.2 0.164 PLT/(109•L-1) 241.1±72.7 255.4±73.3 206.1±59.1 0.002 INR 0.95±0.09 0.93±0.07 1.00±0.09 0.00003 PT/s 12.2±12.1 10.7±0.8 15.7±22.4 0.00004 TT/s 18.4±1.3 18.3±1.4 18.4±1.0 0.640 APTT/s 28.0±4.0 28.1±3.9 27.8±4.4 0.480 FIB 2.87±0.5 2.98±0.5 2.6±0.6 0.001
2.3 与低纤维蛋白原减少相关的危险因素
将患者的性别、年龄、注射用白眉蛇毒血凝酶总剂量、合并用药、血常规、肝功能、肾功能和凝血功能等多个变量引入SPSS 25.0统计软件二元Logistic回归分析计算模型,其中只有白眉蛇毒血凝酶总剂量、血小板计数、谷草转氨酶(AST)和用药前的纤维蛋白原水平对低纤维蛋白原的发生率具有意义,是构成低纤维蛋白原的相关危险因素。其中白眉蛇毒血凝酶总剂量和谷草转氨酶(AST)的相关危险因素比值比(odds ration, OR)大于1,其余2项的危险因素OR均小于1。将低纤维蛋白原与白眉蛇毒血凝酶总剂量绘制ROC曲线,结果显示低纤维蛋白原的ROC曲线下面积为0.636,敏感度为41.38%,特异度为87.3%,切点所示白眉蛇毒血凝酶总剂量为5 KU。考虑两组患者AST无显著差异(P= 0.218),不能完全证明低纤维蛋白原与AST的相关性,故不作切点计算。二项Logistic回归分析结果见表2,低纤维蛋白原与白眉蛇毒血凝酶总剂量的ROC曲线见图1。
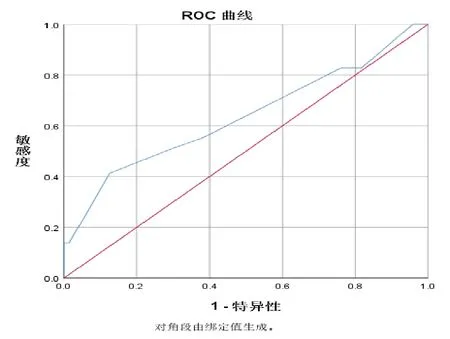
图1 低纤维蛋白原与白眉蛇毒血凝酶总剂量的ROC曲线

表2 二项Logistic回归分析结果
3.讨论
注射用白眉蛇毒血凝酶引起出血患者低纤维蛋白原的具体原因尚不明确。本次调查发现,低纤维蛋白原组和纤维蛋白原正常组两组患者年龄无显著差异(P= 0.395),低纤维蛋白原组男性的比例较纤维蛋白原正常组高,差异有统计学意义(P<0.05)。由于入组的患者男性居多,女性患者偏少,性别分布可能存在一定的偏倚,故分析结果与文献报道不完全一致[9]。
低纤维蛋白原组合并使用其他止血药物的比例较纤维蛋白原正常组高,差异有统计学意义(P<0.05)。合并使用止血药的患者均是失血较多的病例,血容量的丢失也会造成凝血因子纤维蛋白原的消耗,故发生低纤维蛋白原的概率也会增大。但二项Logistic回归分析显示合并使用其他止血药物不是引发低纤维蛋白原的相关危险因素,故不能完全证明低纤维蛋白原与其存在相关性。
低纤维蛋白原组患者用药前的肝功能指标ALB、TP两项指标较纤维蛋白原正常组低,差异具有统计学意义(P<0.05)。低纤维蛋白原组入组的患者合并慢性疾病(如糖尿病、慢性肾脏疾病5期)的比例较纤维蛋白原正常组多,疾病本身对身体中ALB、TP有一定的消耗。结合二项Logistic回归分析结果,虽然两组间的ALB、TP的差异有统计学意义,但也不能完全证明低纤维蛋白原与这两项指标的相关性。
低纤维蛋白原组患者用药前的PLT、FIB水平较纤维蛋白原正常组低,而凝血功能指标中INR、PT则较纤维蛋白原正常组高,低纤维蛋白原组患者使用白眉蛇毒血凝酶平均总剂量高于纤维蛋白原正常组,差异具有统计学意义(P<0.05)。二项Logistic回归分析也显示血小板计数、纤维蛋白原水平和白眉蛇毒血凝酶总剂量是引发低纤维蛋白原的相关危险因素。故PLT、FIB和白眉蛇毒血凝酶总剂量与低纤维蛋白原的相关性可能性大,分析结果与文献报道基本一致[10-11]。
纤维蛋白原是凝血过程中的主要蛋白质,血浆纤维蛋白原水平减少可见于DIC和原发性纤溶症,如重症肝炎和肝硬化,也见于蛇毒治疗和溶栓治疗。注射用白眉蛇毒血凝酶是从长白山白眉蝮蛇冻干蛇毒中提取分离得到的血凝酶,其中含有类凝血酶和类凝血激酶。蛇毒类凝血酶与人凝血酶有相似的药理作用,即它们具有精氨酸酯酶活性直接水解纤维蛋白原α链或β链,释放血纤肽A(FPA)或血纤肽B(FPB)。然而不同于人凝血酶,其凝血活性不受肝素干扰,在体内不激活凝血因子Ⅷ,并且它们使得纤维蛋白单体首尾聚合而不发生侧链交联,因而由此形成的血凝块对纤溶酶十分敏感而易被网状内皮系统或正常的纤溶系统所清除或降解,从而使纤维蛋白原浓度下降,表现出抗凝的效果[12-13]。白眉蛇毒类凝血酶优先释放FPB,再释放FPA的速度降低,从而影响纤维蛋白单体的聚合,使形成的血凝块更为脆弱,易被纤溶系统清除,故在体内可起到消耗纤维蛋白原的作用[14]。
根据注射用白眉蛇毒血凝酶说明书,在大剂量(50~100 KU/次)时则具有较强的去纤维蛋白原作用,能明显降低血液中的纤维蛋白原。而在实际临床中仍有小部分患者即使在说明书推荐剂量使用白眉蛇毒血凝酶,也会出现严重低纤维蛋白的危急情况。白眉蛇毒血凝酶使用总剂量、血小板计数、纤维蛋白原水平是引发低纤维蛋白原的相关危险因素。用药剂量相关低纤维蛋白原ROC曲线结果显示,低纤维蛋白原的ROC曲线下面积为0.636(敏感度为41.38%,特异度为87.3%,切点所示剂量为5 KU),大于0.5,说明具有良好的初步预测价值。注射用白眉蛇毒血凝酶使用总剂量≥5 KU、用药前血小板计数、纤维蛋白原水平较低的患者,需要加强纤维蛋白原监测的频率,警惕患者在用药过程中发生出血的情况。白眉蛇毒血凝酶作用时间长,可持续48~72 h,且能与血浆蛋白结合,需3~4 d才能全部消除,如出现严重低纤维蛋白原的情况,必须马上停药并立即给予补充纤维蛋白原的治疗。
由于本次样本量较小且分组的两组患者病情严重程度不一致,故可能存在着选择性偏倚和测量结果的偏倚,有待需要加大样本、多中心研究进一步证实。
