拟南芥黄心突变体yh基因的图位克隆及分析
2021-11-10郝亚琦宗秀梅付爱根
郝亚琦,宗秀梅,任 潘,付爱根
(教育部西部资源生物与现代生物技术教育部重点实验室,陕西省生物技术与生化工程重点实验室,西北大学 生命科学学院, 西安 710069)
光合作用是地球上生命的主要驱动力,将光能转换成化学能并释放氧气[1]。因此,光合作用对维持自然界的碳氧平衡以及能量转化至关重要[2]。叶绿体是绿色植物进行光合作用的场所,而光反应的第一步就通过叶绿素吸收光能来完成[3],绿色植物中的叶绿素改变会导致叶色发生变化[4],从而影响到光合作用。目前,已有很多关于叶色的突变体研究,包含白化叶、黄色叶以及花斑叶等[5-8]。叶色变化可反映出叶绿体不同发育时期的状况,有研究表明,在非生物胁迫下,过量表达(STAYGREEN-like)SGRL的拟南芥植物表现出早期的叶片发黄,而sgrl-1突变体表现出持久的叶片绿色,说明SGRL基因调节叶绿素的合成与降解[9]。此外,叶片发育影响植物生长,叶边缘性状会影响植物对于干旱、高温等胁迫的适应性以及植物的光合作用效率,并且叶片可以通过光线、温度、微生物等各种环境信息整合内部和外部信号来调控植物的生长发育[10]。因此,关于植物叶绿体发育以及叶片发育相关研究就尤为重要。
本研究所用的实验材料是一株新生叶片叶心为黄色表型(黄心, yellow heart,yh)的拟南芥植株,通过PCR鉴定,发现该黄色叶片植株中依然有tlp18.3(Thylakoid Lumen Protein 18.3)突变体的T-DNA插入,这与tlp18.3突变体的表型不一致[11],表明该黄色表型应该是由于其他基因突变而导致。本研究通过图位克隆以及测序分析,发现该突变体与已报道的ilityhla(ila)突变体为同一个等位基因,可为进一步研究yh基因调控植物叶绿体发育和叶片发育提供遗传材料。
1 材料和方法
1.1 实验材料及种植条件
拟南芥Columbia(Col-0)和Lansbergerecta(Ler)生态型种子以及Col-0为背景的新生叶片黄心表型突变体种子均由本实验室保存。将野生型与突变体种子在4 ℃ 春化3 d以确保发芽的一致性,随后种植于温室,培养条件为24 h连续光照,温度23 ℃,光照强度60 μmol·m-2·s-1,相对湿度70%。
1.2 实验方法
1.2.1 DNA的提取取20~30 mg拟南芥叶片研磨,加入300 μL Edward 缓冲液,12 000 r/min离心5 min,将上清转入新离心管中,加入等量的异丙醇,混匀静置10 min,离心去掉上清。再加入600 μL 70% 乙醇洗涤沉淀,12 000 r/min离心5 min,去掉上清,重复该过程一次。沉淀放置晾干,加入50 μL灭菌ddH2O溶解DNA。
1.2.2 遗传学分析与作图群体构建为了确定该突变表型的显隐性,将该黄心突变体yh与拟南芥野生型Col-0进行杂交得到F1代,自交后得到F2代,通过统计F1和F2代出现的表型分离比,确定突变基因的遗传规律。同时,将回交后的纯合突变体与拟南芥Lansberg生态型进行杂交,挑取F2代具有突变表型(即黄心叶片表型)的植株用于构建作图群体。
1.2.3 图位克隆通过拟南芥DNA粗提法提取F2代30个作图群体植株叶片的混合基因组DNA,即DNA混合池。然后通过混合群体分析法(bulked segregant analysis, BSA)利用拟南芥5条染色体上的27个分子标记为引物进行PCR鉴定,分析突变位点与染色体的分子标记连锁情况进行初定位,待确定突变位点所在的染色体后,扩大F2代作图群体,选取F2代具有突变体黄心表型的植株分别提取基因组DNA,进一步筛选合适的分子标记进行精细定位[12],逐步缩小区间至676 kb的范围内甚至更小。本研究所使用的精细定位引物序列见表1。
1.2.4 测序及筛选候选基因将纯合突变体植株叶片组织进行全基因组测序(深圳华大基因股份有限公司)。通过分析单核苷酸多态性(single nucleotide polymorphisms, SNPs)和插入缺失标记(insertion-deletion, InDel)检测结果,在TAIR(The Arabidopsis Information Resource)网站查询INS1_55_342到INS1_56_34区间内所有可能与叶绿体发育相关基因功能注释,同时结合整合基因组浏览器(Integrative Genomics Viewer, IGV)软件分析测序结果,通过与拟南芥野生型Col-0基因组序列比对,确定突变位点。为了验证该突变基因是否为At1g64790的新等位基因,在该基因碱基缺失位点附近设计特异性引物(表2)进行扩增鉴定。
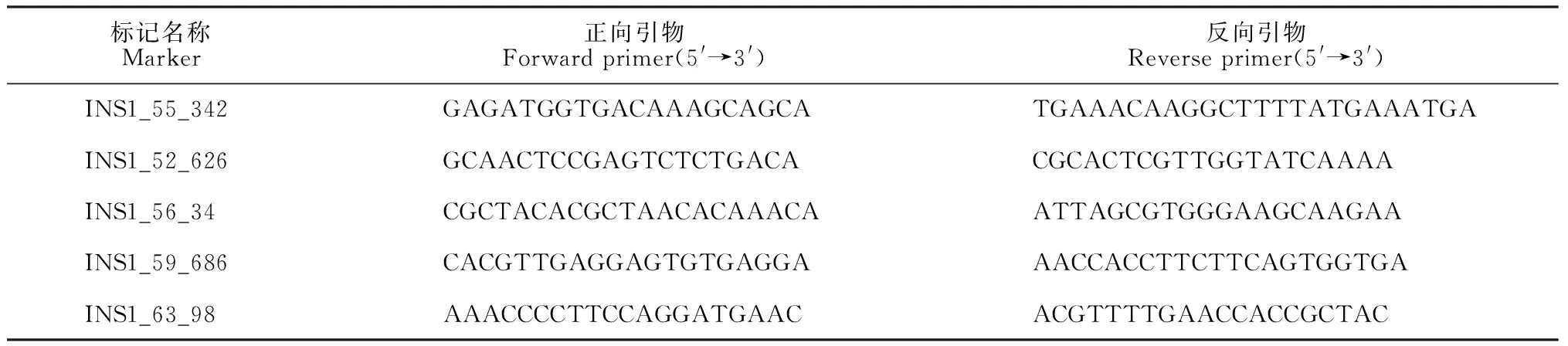
表1 精细定位所使用的分子标记
表2 测序特异性引物
1.2.5 表型鉴定及叶绿素含量的检测植物材料为生长3周左右的Col-0与yh突变体拟南芥叶片,同时进行3组技术重复以减少误差。叶绿素提取方法:称取3周左右的整株鲜重,分别加入1 mL丙酮、乙醇和蒸馏水(4.5∶4.5∶1)混合液(新鲜配置),黑暗处理12 h以提取叶绿素。利用分光光度计在663 nm和645 nm处测量吸光度。使用以下公式计算叶绿素a(Ca)、b(Cb)及总叶绿素(Ca+b)含量[13-14](mg/g),其中,V单位为mL;M单位为g。
Ca= [(9.978OD663-0.99OD645)×V]/(M×1 000)
Cb= [(21.426OD663-4.65OD645)×V]/(M×1 000)
Ca+b=Ca+Cb
1.2.6 RNA的提取方法取50~100 mg拟南芥叶片于液氮中速冻,研磨成粉末状后,加入1 mL Trizol-reagent震荡混匀,于65 ℃ 水浴锅放置5 min,室温放置5 min,加入200 mL氯仿,涡旋30 s,室温放置10 min。4 ℃、5 000 r/min离心10 min,吸上清于新的1.5 mL离心管,加入500 μL异丙醇上下颠倒混匀,室温放置10 min后,4 ℃、12 000 r/min离心10 min,弃上清液,加入500 μL 75%乙醇,重复一次,将沉淀放置10~20 min晾至透明,加入50 μL 去RNA酶水,-80 ℃备用。
2 结果与分析
2.1 突变体的分离及表型分析
在筛选tlp18.3 T-DNA插入突变体时,分离到个别新生叶片的叶心为黄色的植株(图1,A),对其进行DNA水平的检测之后,发现该植株与tlp18.3的突变体都具有T-DNA的插入,这与已报道的tlp18.3的突变体的绿色叶色不一致[11],表明该黄心的表型不是由于tlp18.3 T-DNA插入引起的,可能存在其他的突变位点而导致。
2.2 突变体的基因定位与序列分析
2.2.1 突变体的遗传学分析为了研究该基因的遗传模式,将稳定遗传的纯合黄心突变体与Col-0进行杂交,得到的F1代植株表型与Col-0相同,叶色均为绿色,而F1代自交得到F2代则出现绿色和黄心两种表型,且分离比约为3∶1(绿色∶黄色=29∶10),符合孟德尔遗传定律,说明该突变体基因由隐性单基因控制。
2.2.2 突变位点的粗定位将分离掉tlp18.3 T-DNA插入的纯合黄心突变体yh植株(图1,B)与Lansberg生态型进行杂交,得到表型为绿色的F1代,F1代自交得到F2代,在F2代中挑选30株具有突变体黄心表型的植株混合提取DNA,即为Bulk混合池。根据拟南芥5条染色体上已知的27个分子标记,通过PCR扩增和琼脂糖凝胶电泳,确定该突变位点位于第1条染色体上的第5个分子标记INS1_56_34(24 095 072 bp)附近(图2)。
2.2.3 突变位点的精细定位通过扩大作图群体,共选取F2代254个具有突变体表型植株分别提取基因组DNA,利用INS1_52_626(22 073 177 bp)和INS1_63_98(26 628 510 bp)分子标记通过PCR进行扩增鉴定。电泳结果显示在INS1_52_626(22 073 177 bp)分子标记处的重组率为19/225,在INS1_63_98(26 628 510 bp)分子标记处的重组率为38/205,对19个重组个体用新的分子标记(表1)INS1_55_342(23 418 760 bp)进行鉴定,其重组率为2/19,同时对38个重组个体再次用第1号染色体上的第5个分子标记INS1_56_34(24 095 072 bp)进行PCR鉴定,重组率为2/38。最终将该突变区间缩小至INS1_55_342(23 418 760 bp)到INS1_56_34(24 095 072 bp)分子标记之内,物理距离约为676 kb(图3)。
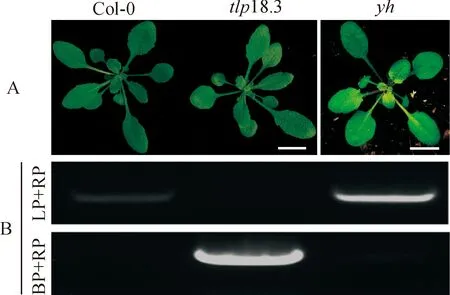
A. 生长4周的拟南芥Col-0,tlp18.3和yh的表型;B. tlp18.3 突变体T-DNA插入PCR鉴定;Bar = 1 cm图1 突变体yh的表型及T-DNA插入鉴定A. Phenotypes of Col-0, tlp18.3 and yh plants grown for 4 weeks at greenhouse; B. Identification of T-DNA insertion site of tlp18.3 mutant. Bar = 1 cmFig.1 Phenotypes of yh mutant and T-DNA insertion site identification
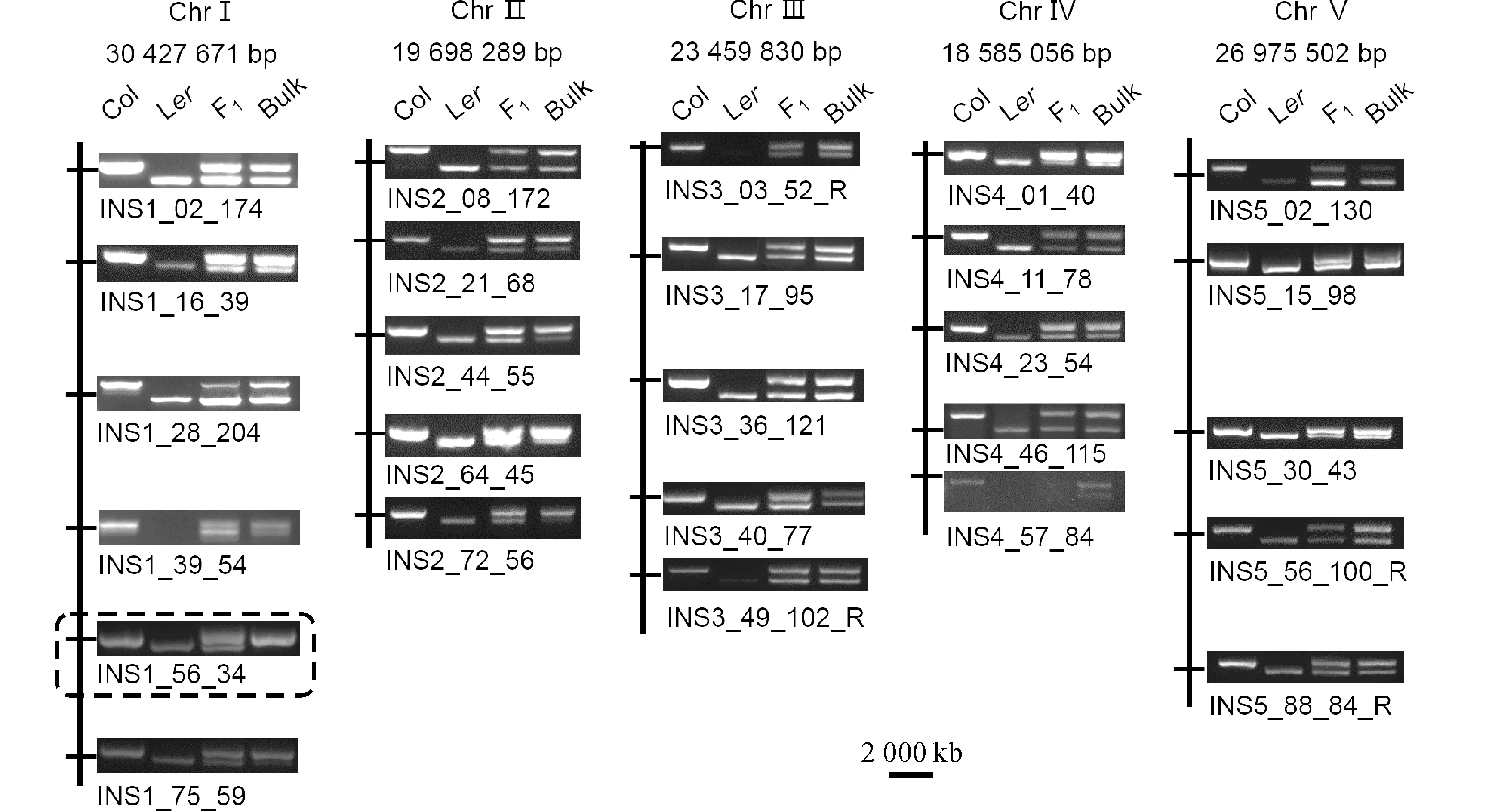
电泳图中的DNA模板从左到右依次为Col-0、Ler、Ler×yh F1和Bulk,虚线方框内即代表突变位点所在染色体的分子标记处图2 混合群体分析法分析突变位点The DNA template in the electrophoretic pattern is Col-0, Ler, Ler×yh F1 and Bulk, the dotted box represents mutation siteFig.2 Analysis of mutation sites by bulked segregant analysis (BSA)
2.2.4 候选基因的筛选准备≥100 mg的纯合突变体叶片组织进行全基因组测序。通过分析突变体的SNP和InDel检测结果,结合TAIR网站查询INS1_55_342到INS1_63_98分子标记区间内的候选基因的功能注释以及相关文献报道,筛选出与该基因表型相关的候选基因。随后,通过整合基因组浏览器(Integrative Genomics Viewer, IGV)软件比对基因序列,发现该突变体在24 070 209 bp-24 070 212 bp处有4个碱基的缺失,通过PCR鉴定初步确定yh为At1g64790基因的突变体。
提取突变体基因组DNA,用基因特异的引物(表2)进行PCR扩增测序[生工生物工程(上海)股份有限公司]。结果如图4,A所示,yh突变体显示有4个碱基的缺失。
2.3 叶绿素含量的检测
在拟南芥中,白色或黄色的叶片通常与叶绿素缺乏有关[15]。由于该突变体营养生长期呈现黄心表型,推测为叶绿素缺乏,对生长3周左右的拟南芥Col-0和突变体yh的叶绿素含量进行了检测可知,突变体yh的叶绿素含量明显低于野生型Col-0(图4,B),说明该突变体的黄色叶片确实与叶绿素的缺乏有关。另外,对生长3周的突变体进行RNA水平的检测,发现突变体yh的RNA含量略低,且条带大小比野生型小,表明突变体中有碱基的缺失。为了进一步确定其缺失的位点,将PCR产物克隆至pMD18-T载体中,测序之后表明突变体中发生了剪接位点的变化,最终导致缺失了66 bp的外显子区域,进而对其氨基酸序列比对后发现突变体yh中缺失了22个氨基酸(图4,C-F),而造成突变体叶绿素发育受到影响。结合前人的研究结果,该yh突变体是At1g64790基因的一个新等位突变,在营养生长期的黄心表型是由于该基因的部分功能缺失造成的,前人研究表明At1g64790在叶边缘处显示了锯齿状表型,也暗示了yh基因在叶生长发育中的重要作用。
3 讨 论
前期从T-DNA插入的突变体中分离得到了一个黄心突变体yh,通过图位克隆和全基因组测序,鉴定得到一个以Col-0为背景的与叶绿素发育相关的黄心突变体yh,该突变体在内含子区域缺失了4个碱基,导致外显子缺失了66个碱基,这与真核生物基因在转录过程中识别内含子的两端碱基GT和AT有关[16],突变体中的第44个内含子的左端GT中的T缺失,导致了原本的GT剪切位点消失而进行了错误剪切而产生突变性状。
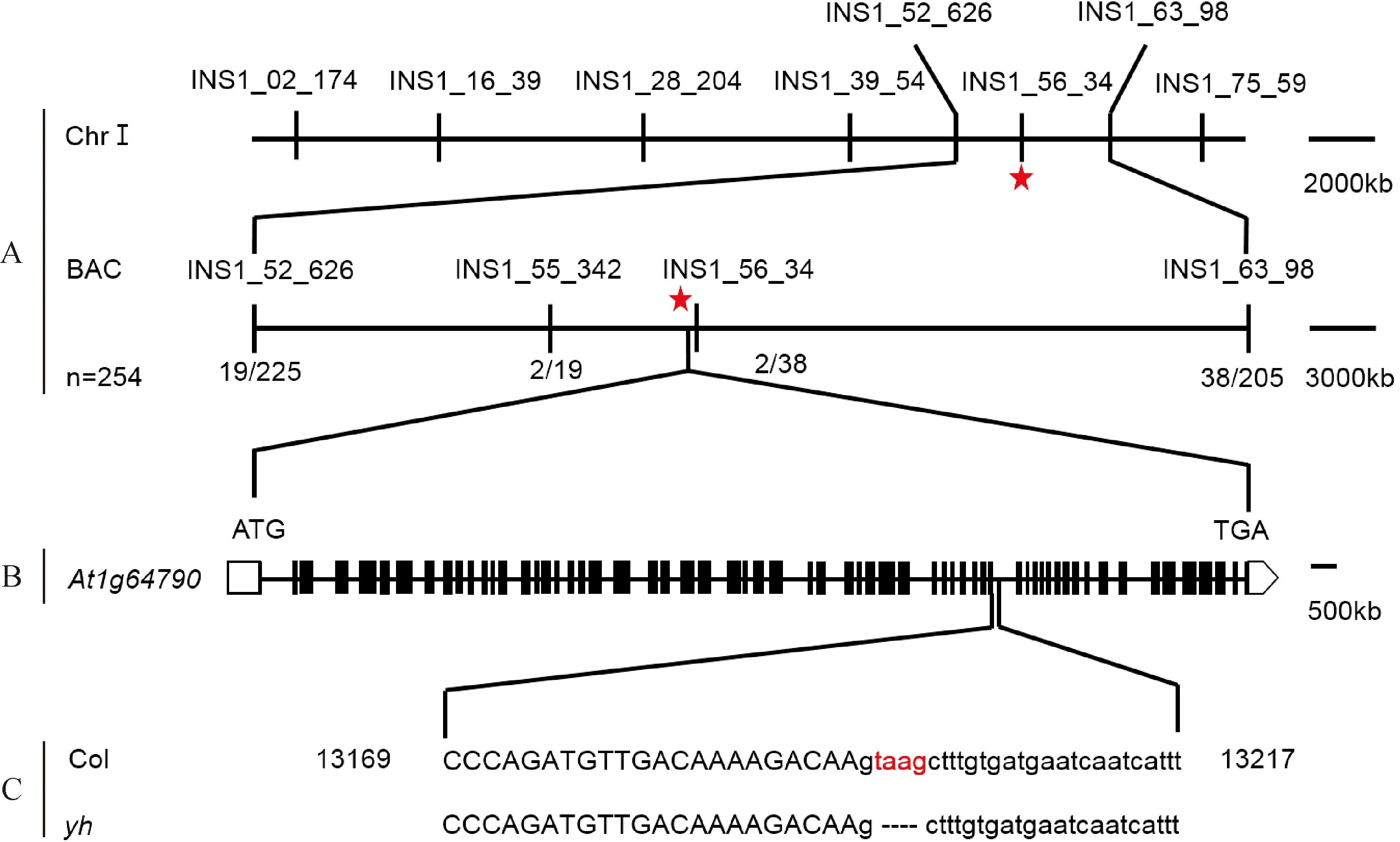
A. 突变位点所在染色体位置及精细定位示意图。混合群体分析结果表明yh突变体位于第1号染色体的INS1_52_626和INS1_63_98分子标记之间。第一个红星代表突变位点所在染色体位置,第二个红星代表突变位点所在分子标记处;B. At1g64790基因结构及缺失碱基所在部位示意图,黑色方框代表外显子,横线代表内含子;C. 红色字母代表yh突变体全基因组测序结果中显示的缺失碱基图3 yh突变体的精细定位示意图A. Schematic diagram of the chromosome location and fine mapping of the mutation site. Bulk segregation analysis showed that yh mutant was localized on chromosome 1, between markers INS1_52_626 and INS1_63_98. The red stars represent the mutation site and molecular marker site respectively; B. Schematic diagram of At1g64790 gene structure and mutation site, the black box represent exons and the solid lines indicate introns; C. The red letters represent deletion bases in yh mutantFig.3 Fine mapping of yh mutant locus
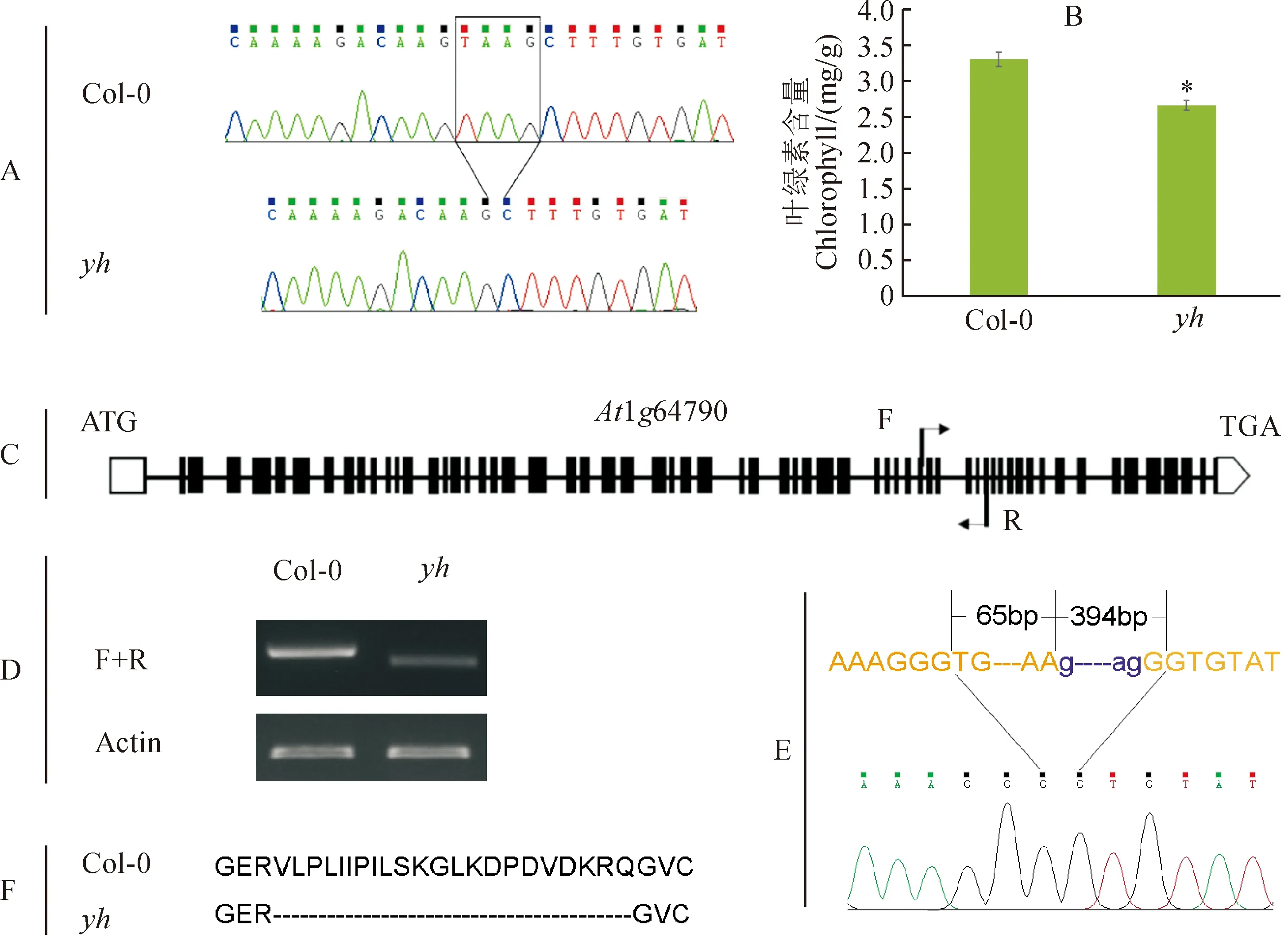
A. 拟南芥野生型Col-0和yh的测序结果,黑色方框内为yh突变体缺失的4个碱基;B. 拟南芥野生型Col-0和yh突变体的叶绿素含量,星号*代表显著性差异,n=5,P<0.05;C. At1g64790 mRNA水平鉴定所用的引物示意图;D. 拟南芥突变体yh RNA水平鉴定;E. 突变体yh mRNA测序结果。黄色大写字母代表外显子,紫色小写字母代表内含子,内含子上4个碱基的缺失导致剪切位点的改变,测序结果显示在突变体中的第44和45位区域外显子缺失了66 bp;F. 拟南芥野生型Col-0和yh的氨基酸序列比对结果图4 突变体yh特性分析A. Sequencing results of Col-0 and yh mutant, the black box shows the 4 bases missing in yh mutant; B. Chlorophyll content of Col-0 and yh mutant leaves, the asterisk * represents a significant difference, (P<0.05); C. Schematic diagram of primers used for At1g64790 RNA level identification; D. mRNA level of Col-0 and yh mutant; E. Results of RNA sequencing of mutant yh. Yellow capital letters represent exons, and purple lowercase letters represent introns. 4-bases deletion in mutant results in the alteration splicing of the intron. Sequencing analysis revealed a 66 bp deletion in the 44 and 45 exon of the yh mutant; F. Amino acid sequence alignment results of Col-0 and yh mutantFig.4 Characteristics analysis of yh mutant
在营养生长期,突变体yh真叶中的叶绿素含量较野生型低(图4,B),通过生物信息学分析,发现yh突变体与已报道的ila突变体为同一个基因At1g64790的弱突变体,都具有相似的黄心表型,但两者的突变机制不同。ILA编码一个分子量为296.56 kD的蛋白,含有HEAT REPEAT序列,并且与植物免疫相关[15-17]。ila突变体的表型除了形状异常的黄色叶片和雄性不育之外,也对致病细菌P.syringaeDC3000的易感性增加,表明ILA在抵抗P.syringae的防御中也发挥作用[15]。同时,Faus等[18]通过对叶绿素含量、光合参数等分析发现,突变体在生长前期叶绿体发育异常,但随着植物进一步发育,叶绿体发育缺陷逐渐恢复正常水平。综上,ila基因的功能不仅涉及调控植物抗逆,同时与叶绿体发育相关,该基因的突变会导致植物出现多效性的表型,其功能还与叶片发育、花粉育性、叶绿素生物合成和细菌防御信号以及根的发育等等[15,18]。值得一提的是,虽然本研究所得到的yh突变体表型与ila弱突变体的表型相近,均为黄色叶心,但两者的叶边缘形状略有不同,ila的弱突变体叶片边缘显示为锯齿状,显示出叶缘缺刻明显等生长缺陷特征[15],而本研究所得到的yh突变体叶片边缘光滑,无锯齿状,说明该突变体yh与已报道的突变体有所不同,属于不同的等位基因株系,这也从另一方面说明了该基因有可能在拟南芥叶片叶边缘的形态发生过程中发挥一定的作用,关于该基因是否参与到叶片形态发生这一过程将是下一步研究的重点。
