电位滴定法测定镍锰酸锂中锰含量
2021-11-10管洪素
管洪素,王 雪,余 航,朱 平,2,李 琴
(1.贵州省检测技术研究应用中心,贵州 贵阳 550002;2.贵州省分析测试研究院,贵州 贵阳 550002;3.贵州圣济堂制药有限公司,贵州 贵阳 550002)
镍锰酸锂主要为尖晶石型,相比钴酸锂等其他正极材料,具有输出电压高、成本低、环境友好、高温循环下的稳定性大大提高、制备工艺简单等特点[1]。目前,微量锰的测定方法较多,常使用电感耦合等离子体光谱仪(ICP)进行测试,但元素为常量分析时,因需要稀释高倍数,会带来一定的误差,且仪器成本较高,不利于生产推广使用[2-3]。以Na4P2O7为介质,用高锰酸钾标准滴定溶液滴定至电位突跃即为终点,考察了各试剂用量,得出最佳试验条件,运用电位滴定法测定镍锰酸锂样品中锰的量。该方法快速方便,准确度高,能满足工业化生产要求。
1 试验部分
1.1 主要仪器与试剂
电位滴定仪,雷磁ZDJ-4A;铂电极,雷磁213-01;参比电极,雷磁217-01。盐酸(ρ=1.19 kg/L);盐酸溶液(1+1);碳酸钠溶液,50 g/L;溴百里酚蓝指示剂溶液,0.4 g/L;焦磷酸钠饱和溶液:称取200 g焦磷酸钠(NaP2O7·10H2O),置于200 mL锥形瓶中,加入约1 000 mL温水,不断搅拌。放置24 h后使用。
锰标准溶液A:称取2.000 0 g金属锰(锰质量分数≥99.95%)于400 mL烧杯中,加入50 mL水和20 mL硝酸,低温加热至溶液清亮。冷却至室温,转移至1 000 mL预先准备好的容量瓶中,用蒸馏水稀释至刻度线,摇至均匀。此溶液每毫升含2.0 mg锰。
锰标准溶液B:称取1.000 0 g金属锰(锰质量分数≥99.95%)于400 mL烧杯中,加入50 mL水和20 mL硝酸,低温加热至溶液清亮。冷却后,转移至预先准备好的1 000 mL容量瓶中,用蒸馏水稀释至刻线,摇至均匀。此溶液每毫升含1.0 mg锰。
KMnO4标准滴定溶液的配制:称量1.65 g高锰酸钾置于200 mL预先准备好的锥形瓶中,加入1 000 mL蒸馏水,进行搅拌溶解,静置7天后,用G4型漏斗式过滤器进行抽滤,滤液密封在棕色玻璃瓶中,混至均匀。
标定:移取20.00 mL锰标准溶液B(1.000 0g/L)于500 mL烧杯中,在搅拌下加入250 mL焦磷酸钠饱和溶液,用盐酸(1+1)或碳酸钠溶液(50g/L)调节溶液pH值为7.0(用pH计或溴百里酚蓝指示剂溶液)。在电位滴定仪上,用高锰酸钾标准滴定溶液滴定至电位滴定仪上发生明显电位突跃为终点,记录高锰酸钾滴定溶液消耗体积V1,随同标定做空白实验。
按照公式(1)计算KMnO4对Mn的滴定度T,g/L。
(1)
式中:T,KMnO4对Mn的滴定度,g/L;ρ,移取的锰标准溶液的质量浓度,g/L;V2,移取的锰标注溶液的体积,mL;V1,滴定时消耗的KMnO4溶液的体积,mL;V0,空白试验时,消耗的KMnO4体积,mL。平行标定3份,3份溶液所消耗的高锰酸钾标准滴定溶液体积的极差值不应超过0.05 mL,取其平均值。计算结果保留4位有效数字。
1.2 试验方法
量取0.500 0 g试样于预先准备好的250 mL烧杯中,用少量蒸馏水润湿,缓缓加入5 mL浓盐酸,盖上玻璃皿,低温加热至样品溶解完全。持续加热至有盐类析出,取下,用水冲洗杯壁及表面皿,稍冷后,继续用电炉加热至盐类完全溶解,取下,稍冷却至室温,转移至200 mL预先准备好的容量瓶中,用蒸馏水稀释至刻度,摇至均匀。移取20.00 mL试液,置于400 mL烧杯中,在不断搅拌下加入150 mL焦磷酸钠饱和溶液,使用盐酸(1+1)或碳酸钠溶液(50 g/L)调节溶液pH值为6.0~7.0(用pH计或溴百里酚蓝指示剂溶液)。用高锰酸钾标准滴定溶液滴定至电位滴定仪上发生明显电位突跃为终点,记录高锰酸钾滴定溶液消耗体积。
1.3 试验数据处理
WMn按公式(2)计算样品中锰的质量分数:
式中:W,试料中Mn元素的质量分数,%;T,KMnO4溶液对Mn的滴定度,g/L;V,溶液定容的体积,mL;V5,滴定消耗的KMnO4溶液体积,mL;V4,空白试验消耗的KMnO4体积,mL;m,称取试料的质量,g;V3,分取试液的体积,mL;计算结果精确至小数点后两位。
2 结果与讨论
2.1 溶样方法的选择
通过采用不同的溶样方法,对比考察3种样品的溶解情况,试验结果如表1所示。

表1 不同溶样方法对试验样品的溶解情况
由表1可见,采用浓盐酸即可完全溶解样品,当浓盐酸用量≥5 mL时,在低温加热状态下,3种试验样品均能完全溶解,因此本方法选择采用5 mL的浓盐酸溶解样品。
2.2 焦磷酸钠饱和溶液用量试验
移取15.00 mL的锰标准溶液(2 g/L)于一组400 mL烧杯中,分别加入不同量的焦磷酸钠饱和溶液,按试验方法进行测定,测定结果见表2。
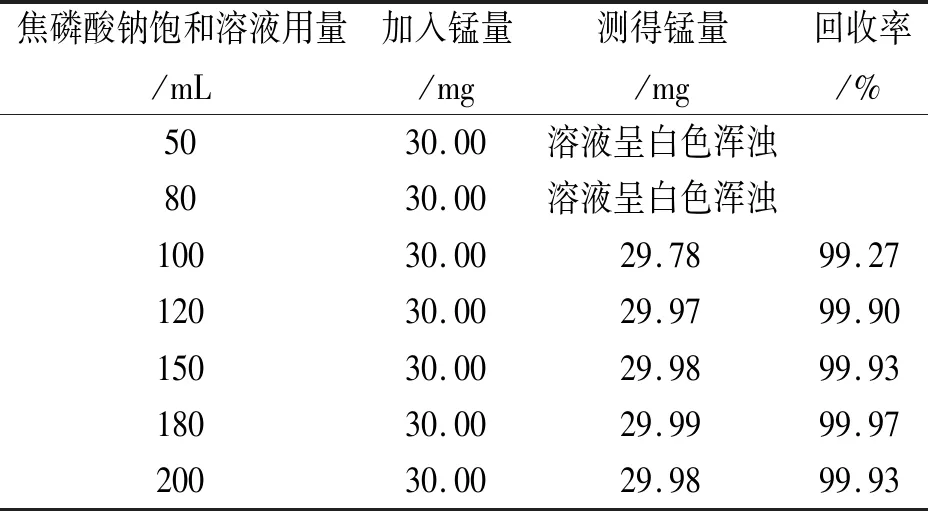
表2 Na4P2O7饱和溶液用量试验
由表2可见,当焦磷酸钠饱和溶液用量>100 mL时,整个滴定过程中,溶液始终保持澄清,测得的锰的回收率>99.50%。从滴定结果的准确性和经济等方面综合考虑,本方法选择焦磷酸钠饱和溶液的用量为150 mL。
2.3 滴定时pH值的选择
移取15.00 mL的锰标准溶液(2 g/L)于一组400 mL烧杯中,用盐酸(1+1)或碳酸钠溶液(50g/L)调节溶液pH值为4.0、5.0、6.0、6.5、7.0、8.0、9.0,按试验方法进行测定得到不同pH值条件下的锰量,测定结果见表3。

表3 不同pH值对测定结果的影响
由表3可见,当溶液pH值在6.0~7.0时,测得的锰的回收率较好,在99.91%~99.96%。溶液的pH值过高或过低对终点判定都有影响,加入过量的焦磷酸钠饱和溶液会试溶液呈碱性,而滴定需要氢离子的参加,因此需要调节溶液pH值在6.0~7.0。
2.4 综合干扰试验
在两种不同浓度锰标准溶液中加入不同量的镍、锂、钾、钠、钙、铁、铜、硅、铬、镉、铅元素,按照试验方法进行测定,测定结果见表4。
从表4可见,样品中各共存元素对锰含量的测定几乎没有影响,可忽略。

表4 共存元素综合干扰试验结果

表5 精密度试验结果 %
2.5 精密度试验
按照选定的最优试验方法对3种镍锰酸锂样品中的锰含量进行11次独立测定,测定结果如表5所示。
由表5可知,3种镍锰酸锂样品测定结果的RSD在0.20%~0.59%,说明该方法精密度良好,能够满足分析要求。
2.6 加标回收试验
向1#和2#试验样品中加入不同量的锰标准溶液,按照选定的试验方法进行测定,结果见表6。

表6 加标回收试验结果
由表6可知,本方法加标回收率在98.52%~99.71%,测量准确度较高。
2.7 方法对比
采用硫酸亚铁铵滴定法对1#和2#样品中的锰含量进行测定。具体试验步骤为:称取0.100 0 g样品于300 mL容量瓶中,加入5 mL浓盐酸,低温加热至样品完全溶解,取下稍冷,依次加入20 mL磷酸、5 mL高氯酸,继续加热至冒微磷酸盐取下,冷却后用硫酸亚铁铵标准滴定溶液进行滴定。测定结果与电位滴定法进行对比。测定结果见表7。
由表7可知,电位滴定法与硫酸亚铁铵滴定法的测定结果基本一致,表明电位滴定法准确性良好。
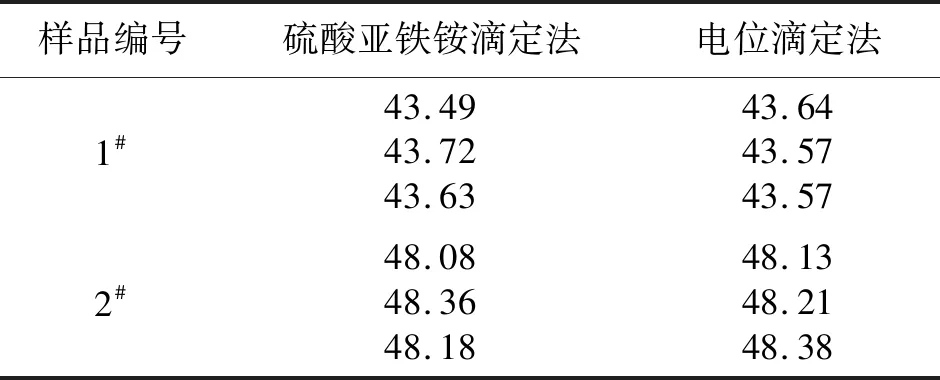
表7 硫酸亚铁铵滴定法与电位滴定法测定结果 %
3 结论
采用盐酸溶解试料后,在pH值为6~7的Na4P2O7体系中,用KMnO4溶液滴定至终点,根据消耗的KMnO4溶液体积计算试料中Mn的含量。结果表明,本方法测定的相对标准偏差在0.20%~0.59%,加标回收率在98.52%~99.71%,且测定结果与硫酸亚铁铵滴定法的测定结果基本一致。本方法操作简单快速、干扰小,测定结果的准确度高、精密度好。
