肾缺血再灌注损伤中坏死性凋亡的研究进展
2021-11-10匡柏成张季宫念樵
匡柏成,张季,宫念樵
(华中科技大学同济医学院附属同济医院器官移植研究所 器官移植教育部重点实验室 国家卫生健康委员会器官移植重点实验室 中国医学科学院器官移植重点实验室,武汉 430030)
临床上,血容量不足、心肌梗死、脑梗死、败血症或器官移植等均可诱发缺血再灌注损伤(ischemia reperfusion injury,IRI)。肾脏对IRI敏感,在供者器官获取及移植手术过程中不可避免地会发生IRI,进而导致术后移植物功能恢复延迟、急性或慢性排斥反应及肾纤维化发生,严重影响肾移植患者预后[1]。研究者曾尝试采用机械灌注、缺血预处理及缺血后处理、细胞治疗及各种药物制剂等干预措施,研究其对肾脏IRI的潜在保护作用,但目前临床尚无有效方法[2-5]。
凋亡和坏死被认为是肾IRI发病机制中细胞死亡的主要形式。细胞凋亡形成凋亡小体,然后由专职或非专职吞噬细胞吞噬、清除,不引起炎症反应;而细胞坏死则会引起胞内炎性内容物释放,导致局部严重的炎症反应[6]。随着对细胞死亡机制研究的深入,坏死性凋亡、铁坏死、细胞焦亡、依赖性细胞死亡等调节性细胞坏死过程逐渐被人们发现。其中,坏死性凋亡于2005年首次提出[7],是一种新的程序性细胞死亡方式,参与调控多种急慢性疾病的发展过程。在体内、外肾IRI模型中,坏死性凋亡通路激活,可加重肾IRI,而通过人为干预,抑制坏死性凋亡则可改善IRI后肾功能[8-10]。现就肾IRI中坏死性凋亡的研究进展予以综述,以为临床肾IRI的防治提供新思路。
1 坏死性凋亡概述
坏死性凋亡是一种受调控的细胞程序性死亡途径,具有细胞坏死和凋亡的混合特征。坏死性凋亡可由多种细胞内外刺激引起,包括病毒感染和氧化应激以及肿瘤坏死因子(tumor necrosis factor,TNF)家族成员、Fas配体、干扰素等[11-13]。有学者通过对细胞表面死亡受体进行研究发现,对于经胱天蛋白酶(caspase)抑制剂预处理而抑制凋亡的细胞,TNF-α仍可导致其死亡,且表现为具有细胞坏死的形态学特征[14]。另有研究使用Fas配体作为刺激因素,确定了受体相互作用蛋白是caspase-8非依赖的非凋亡细胞坏死的关键成分[11]。2005年,Degterev等[7]首次提出“坏死性凋亡”一词来描述这种受调控的细胞坏死模式。
2 坏死性凋亡分子机制
TNF受体是细胞表面重要的死亡受体,在坏死性凋亡的分子机制研究中,TNF-α是研究最广泛的坏死性凋亡诱因,细胞坏死性凋亡的启动及执行依赖于一系列激酶的活化,包括受体相互作用蛋白激酶(receptor-interacting protein kinase,RIPK)1、RIPK3和混合谱系激酶结构域样假激酶(mixed lineage kinase domain like pseudokinase,MLKL)等[15](图1)。
2.1复合物Ⅰ的形成 当细胞受到胞内或胞外刺激时,TNF-α与TNF受体1 结合,TNF受体1与TNF受体相关死亡结构域蛋白相互作用,活化并招募各种下游分子,组装形成由TNF受体1、TNF受体1相关死亡结构域、TNF受体1相关因子2、RIPK1、细胞凋亡抑制蛋白(cellular inhibitor of apoptosis protein,cIAP)1、cIAP2和线性泛素化链组装复合物组成的复合物Ⅰ[16]。复合物Ⅰ作为一个反应平台,在决定细胞命运方面至关重要,其中,cIAP1、cIAP2或线性泛素化链组装复合物可泛素化RIPK1,泛素化的RIPK1可稳定复合物Ⅰ,并通过招募转化生长因子-β活化激酶1或经经典核因子κB通路促进细胞存活[17]。
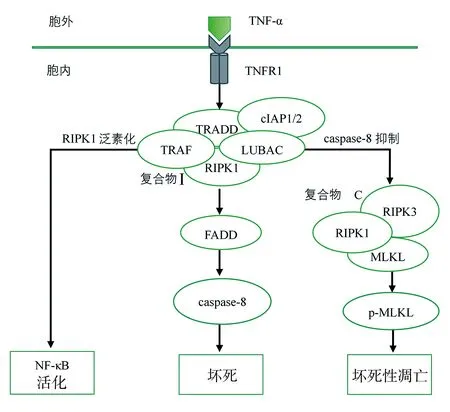
TNF-α:肿瘤坏死因子-α;TNFR1:肿瘤坏死因子受体1;RIPK:受体相互作用蛋白激酶;TRAF:肿瘤坏死因子受体相关因子;TRADD:肿瘤坏死因子受体相关死亡结构域蛋白;cIAP1/2:细胞凋亡抑制蛋白1/2;LUBAC:线性泛素化链组装复合物;caspase-8:胱天蛋白酶8;FADD:Fas相关死亡结构域蛋白;MLKL:混合谱系激酶结构域样假激酶;p-MLKL:磷酸化的混合谱系激酶结构域样假激酶;NF-κB:核因子κB
2.2复合物 Ⅱ C的形成 当复合物 Ⅰ 失稳,或cIAP、转化生长因子-β活化激酶1或核因子κB等必要调节因子消耗时,复合物Ⅰ分别形成复合物ⅡA、ⅡB,导致caspase激活,从而诱导caspase活化依赖的经典细胞凋亡途径。在caspase-8缺乏、失活或被病毒或化学抑制剂抑制,RIPK1和MLKL充分表达,或长构型Fas相关死亡结构域蛋白样白细胞介素-1β转换酶抑制蛋白活性降低的情况下,复合物Ⅰ则形成由RIPK1、RIPK3和MLKL组成的复合物ⅡC(即坏死性凋亡小体)[18]。复合物 Ⅱ C中的RIPK1和RIPK3,通过其受体相互作用蛋白同型相互作用基序相互结合,发生一系列自磷酸化和反式磷酸化反应而活化,激活的RIPK3通过苏氨酸357和丝氨酸358位点磷酸化MLKL的假激酶结构域,形成磷酸化的MLKL(phosphorylated mixed lineage kinase domain like pseu-dokinase,p-MLKL),导致MLKL活化[19]。
2.3坏死性凋亡的执行 MLKL是坏死性凋亡的执行蛋白,具有两个功能域:N端4-螺旋束结构域和C端RIPK3磷酸化位点的假激酶结构域,两者在功能上由两个弯曲的螺旋线桥接。MLKL的磷酸化使MLKL发生构象改变,激活了4-螺旋束结构域的杀伤功能。p-MLKL寡聚并通过与质膜磷脂酰肌醇磷酸盐结合,从而完成由细胞质向细胞膜的转位,导致细胞膜通透性改变,诱导细胞溶解,最终导致胞内炎症损伤相关分子模式的释放,并促进固有免疫和适应性免疫发生[20];同时,p-MLKL还可激活核苷酸结合寡聚化结构域样受体蛋白3炎症小体,导致炎症介质(白细胞介素-1β和白细胞介素-18)分泌,促进炎症反应的发生、发展[21];此外,活化的MLKL也可被招募到线粒体膜,导致线粒体功能障碍,最终导致细胞溶解、坏死[22]。
3 肾IRI与坏死性凋亡
尽管坏死性凋亡在一些疾病中的相对重要性仍存在争议,但其已被报道与多种疾病密切相关,包括心脏IRI、结肠炎、肠IRI等[23-25]。坏死性凋亡可通过诱导细胞释放损伤相关分子模式,促进免疫反应,在机体病毒感染产生特异性T细胞和B细胞早期发挥重要的抗病毒作用[26]。此外,坏死性凋亡被认为在多种肾损伤模型中发挥作用,包括肾IRI、顺铂诱导的急性肾损伤、造影剂肾病等[27]。
3.1肾IRI中坏死性凋亡的体内研究 肾IRI的发病机制复杂,包括能量代谢障碍、肾小管坏死和凋亡、炎症产生和氧化应激等。研究表明,抗炎、抗氧化及抑制凋亡等治疗均对肾IRI具有保护作用[28-29]。Linkermann等[30]于2012年首次报道了坏死性凋亡存在于肾IRI的病理损伤过程,在缺血30 min、再灌注48 h的小鼠IRI模型中,RIPK1和RIPK3表达水平显著升高,而在缺血前15 min或再灌注后15 min给予RIPK1特异性抑制剂Nec-1(Necrostatin-1),可显著降低肾损伤、保护肾脏功能;同时,在致死的缺血40 min的肾IRI模型中,Nec-1可显著降低死亡率,提高小鼠存活率。与野生型小鼠相比,RIPK3或MLKL基因敲除小鼠肾缺血30或35 min、再灌注48 h后肾功能改善[31-33]。在肾IRI时,肾脏血流障碍是肾脏功能下降的重要特征,研究者发现,MLKL基因敲除小鼠肾小管周毛细血管表现出更高的血流速度和更强的血流量[31],但其具体作用机制尚不明确,因此坏死性凋亡相关基因对肾脏血管的影响在肾IRI中的作用机制还需进一步研究。Shen等[34]研究表明,在IRI前给予大鼠 Nec-1预处理可显著降低肾脏RIPK1、RIPK3蛋白水平,抑制炎症因子(白细胞介素-1、TNF-α及缺氧诱导因子1α)的表达,保护肾功能。达拉非尼是一种著名的抗癌药物,目前已被批准用于治疗黑色素瘤和某些非小细胞肺癌[35]。研究表明,达拉非尼也有阻断RIPK3的作用,在缺血30 min、再灌注24 h的小鼠IRI模型中,达拉非尼预处理可明显降低RIPK3、磷酸化的RIPK3和p-MLKL蛋白水平,减轻肾脏损伤[36-37]。
3.2肾IRI中坏死性凋亡的体外研究 细胞的糖氧剥夺模型,即细胞缺氧/复氧是模拟体内IRI常用的体外损伤模型。Liu等[37]研究表明,人肾近端小管上皮细胞(HK-2细胞)缺氧/复氧损伤(缺氧24 h/复氧12 h)后,坏死性凋亡标志物RIPK3、RIPK1、MLKL表达上调。然而,有研究发现,肾小管上皮细胞缺氧/复氧损伤(缺氧2 h/复氧2、4、8 h)后p-MLKL水平降低,凋亡及自噬相关蛋白水平升高,表明细胞凋亡是缺氧/复氧损伤的主要表现形式,而非坏死性凋亡[38]。肾小管上皮细胞损伤的严重程度是决定细胞是否会发生凋亡或坏死的主要因素[39],因此两者研究的差异可能与缺氧/复氧时间不同导致的细胞损伤程度不同有关。瞬时受体电位阳离子通道蛋白6(transient receptor potential cation channel 6,TRPC6)一种非选择性阳离子通道,主要表达于肾小管上皮细胞,负责钙内流和随后氧化应激期间的细胞损伤[40]。在HK-2细胞缺氧/复氧损伤模型中,敲除TRPC6基因或给予TRPC6抑制剂可促进RIPK1表达,加重HK-2细胞损伤[41]。Shen等[34]发现,缺氧/复氧损伤会诱导氧依赖的转录因子-缺氧诱导因子1α释放,在HK-2细胞缺氧/复氧损伤模型中,缺氧诱导因子1α可间接抑制TRPC6,促进坏死性凋亡,加重细胞损伤。
3.3坏死性凋亡参与肾IRI后肾纤维化 巨噬细胞和T淋巴细胞等炎症细胞的聚集是导致肾IRI后持续性炎症和纤维化反应的主要原因[42],坏死性凋亡不仅参与肾IRI后急性肾小管损伤,还与肾IRI后肾小管间质炎症及肾纤维化的发生发展密切相关。Lau等[43]在肾移植小鼠模型中,分别通过抑制caspase-8增强坏死性凋亡、敲除RIPK3基因抑制坏死性凋亡发生,结果发现,RIPK3介导的供肾坏死性凋亡可促进炎症损伤,而抑制坏死性凋亡可显著减少中性粒细胞浸润、肾纤维化及血管损伤,提高肾移植术后100 d无排斥存活率,对供肾存活及功能有重要影响。Chen等[44]研究表明,敲除RIPK3或MLKL基因,小鼠肾IRI后坏死性凋亡减轻,肾内巨噬细胞的迁移和浸润显著减少,炎症因子和纤维化标志物(α平滑肌肌动蛋白、Ⅰ型胶原蛋白)表达水平降低,肾纤维化改善。
4 肾IRI中坏死性凋亡的干预措施
在肾IRI过程中坏死性凋亡发挥重要作用,抑制坏死性凋亡可减轻IRI后肾损伤、改善肾脏功能及肾纤维化。因此,通过药物、基因敲除或生物制剂干预,特异性阻断坏死性凋亡通路中的关键分子,可用于防治肾IRI,保护肾脏功能。
4.1药物干预 在体外使用TNF-α或去除ATP模拟的肾IRI模型中,RIPK1抑制剂Nec-1可显著抑制坏死性凋亡,减轻肾小管细胞损伤[45]。在小鼠肾IRI体内模型中,Nec-1可减轻肾脏病理损伤、保护肾脏功能,显著降低IRI后小鼠死亡率[34]。研究表明,新型RIPK1抑制剂Nec-1s(Necrostatin-1 stable)较Nec-1更稳定、不良反应更少,且可通过抑制RIPK1的磷酸化和泛素化,对TNF-α诱导的全身炎症反应综合征发挥保护作用,可抵御叶酸诱导的急性肾损伤[27],但有关Nec-1s在肾IRI中的作用报道较少。甲苯磺酸索拉非尼作为RIPK1的另一种抑制剂,也对肾IRI具有保护作用[46]。此外,RIPK3抑制剂GSK843、GSK872和人特异性GSK840均能抑制TNF-α诱导的坏死性凋亡,但它们未在肾IRI中进行测试[47]。目前,抑制MLKL是阻断坏死性凋亡最明确的药理学手段,坏死磺酰胺在体外可显著抑制坏死性凋亡[48],但其特异性作用于人类MLKL,在啮齿类动物中研究较少。
4.2基因敲除 基因敲除是常用的体内外实验技术,通过人为干预使特定的基因丧失功能,进而推测该基因的生物学作用。对基因敲除小鼠的研究支持了坏死性凋亡在肾IRI中的作用。其中,RIPK1基因全身敲除对小鼠致死,出生后存活时间不超过1~2 d[49],故相关研究主要集中于RIPK3及MLKL基因。Linkermann等[50]在缺血43 min的致死性肾IRI模型中发现,与野生型小鼠相比,RIPK3基因敲除小鼠存活率显著升高。在标准的缺血30 min的肾IRI小鼠模型中,von Mässenhausen等[31]通过敲除RIPK3或MLKL基因抑制坏死性凋亡,结果显示术后小鼠肾功能改善;Newton等[32]发现,RIPK3基因敲除小鼠肾IRI后死亡率降低。虽然以上研究表明,通过敲除坏死性凋亡途径的某些关键分子可改善肾IRI后肾功能,提高小鼠存活率,但特定敲除靶基因后对机体其他组织器官功能的影响目前尚不清楚,需进一步研究。
4.3其他 细胞间或细胞内通过高度精确的细胞通讯机制,对多变的外界环境做出综合反应,其中化学信号介导的细胞通讯占重要地位。有学者通过对坏死性凋亡作用机制进行深入研究发现,人诱导多能干细胞来源的间充质干细胞的细胞外囊泡通过上调和激活鞘氨醇激酶1/1-磷酸鞘氨醇通路抑制肾IRI后的坏死性凋亡,对肾IRI具有保护作用[3]。另有研究表明,重组人巨噬细胞迁移抑制因子通过升高细胞内还原性谷胱甘肽水平和减少脂质过氧化,表现出强大的抗氧化作用,其可减轻肾IRI小鼠的细胞凋亡、坏死性凋亡,在肾IRI模型中显示良好的保护效果[2]。未来,通过提取与坏死性凋亡相关的细胞分泌物,如具有细胞调控作用的外泌体,可能有助于改进调控坏死性凋亡的方案。
5 小 结
随着新型免疫抑制剂的产生及手术技术的进步,肾移植术后近期存活率显著提高,但提高移植物远期存活率仍是临床亟待解决的难题。肾IRI影响移植物功能及患者远期预后,通过抑制坏死性凋亡,可减轻肾IRI,改善小鼠肾移植物功能,降低排斥反应发生率,延长供肾生存时间。而坏死性凋亡在肾IRI中的作用仍需进一步研究:①其下游作用靶点未完全明确;②坏死性凋亡与凋亡在肾IRI中常同时发生,肾IRI后细胞死亡的主要途径是坏死性凋亡还是凋亡,目前尚无定论;③坏死性凋亡与其他细胞死亡途径(如细胞焦亡、铁死亡、依赖性细胞死亡)的联系及在肾IRI中具体参与的程度目前尚不清楚。虽然坏死性凋亡在防御细菌和病毒感染中具有重要作用[26],但在肾移植的情况下,抑制接受免疫抑制剂治疗的受体的坏死性凋亡可能会增加感染的发生率。然而,干预坏死性凋亡可能只需在围手术期进行,这可能是一个短期的风险,故其确切影响需进一步基础实验验证。
