β-葡聚糖对S180荷瘤小鼠实体瘤抑制作用及其机制研究①
2021-11-10杨英来杨文卿程路峰
杨英来,杨文卿,武 洋,程路峰
(新疆医科大学1厚博学院,新疆 克拉玛依 833200;2药学院,乌鲁木齐 830011)
β-葡聚糖可作为多类生物细胞壁的原材料,属于多糖的一种,其大多存在于真菌、细菌和植物体中,分布广泛。β-葡聚糖可起到免疫调节、抗炎、抗肿瘤、抗病毒、抗氧化、抗补体活性、抗凝血、促进细胞因子合成等多种作用[1]。β-葡聚糖糖苷键连接的主要方式有β-1,3-糖苷键、β-1,6-糖苷键、β-1,4-糖苷键等[2-4],目前大多数研究认为以β-1,3-糖苷键作为主链连接方式的β-葡聚糖的抗肿瘤免疫活性较强[5]。被称作“生物反应调节剂[6]”的β-葡聚糖,具有提高机体免疫力的功效,在抗肿瘤方面具有较为显著的活性。酵母β-葡聚糖具抗肿瘤、抗感染功效,相关研究表明,这类功效是通过对机体的免疫系统产生作用从而使机体的抗病能力得到提升从而实现,并非直接作用于肿瘤细胞产生预期疗效。恶性肿瘤作为死亡率较高的一类疾病,在过去的几十年内,研究人员尝试改善癌症的治疗方式以确定更加有效的治疗手段,虽然在各方面取得了相关的进展,但迄今为止药物治疗依旧是治疗恶性肿瘤最有效手段。目前,以细胞毒性类药物为代表的传统化疗药物普遍缺乏特异性[7]。肿瘤的产生及后续进程与机体的免疫能力密切相关。近年来,对于多种多糖的抗肿瘤活性研究广泛。然而,对于β-葡聚糖的抗肿瘤疗效机制研究较少,作为一种高效的生物应答物,β-葡聚糖具有生物活性强大、毒副作用低的优点,因此对于β-葡聚糖抗肿瘤活性研究具有重要意义。本研究采用S180腹水瘤小鼠模型,探究酵母β-葡聚糖对S180腹水瘤小鼠的抗肿瘤作用,现报道如下。
1 仪器与试药
1.1 仪器倒置显微镜(美国Thermo公司),离心机(美国Sigma公司),蛋白电泳仪及转印仪(美国Bio-Rad公司),凝胶图像分析软件(美国FluorChem E公司)。
1.2 试药酵母β-葡聚糖(上海源叶生物有限公司,批号S24487),顺铂粉末(美国索莱宝公司,批号IC0440),胎牛血清(美国Gibco公司,批号10099-141),RPMI1640培养基(美国 Hyclone公司,批号AE29163439),双抗链霉素混合液(美国Gibco公司,批号15140-122),二甲基亚砜(美国Sigma公司,批号D2650),小鼠 AST(YB-AST-Mu)、ALT(YB-ALTMu)、CREA(YB-CREA-Mu)、UA(YB-UA-Mu)、BUN(YB-BUN-Mu)酶联免疫吸附(ELISA)试剂盒购于钰博生物有限公司,兔抗小鼠Caspase-3抗体(美国Abcam公司,批号ab13847),山羊抗兔二抗(美国Bioss公司,批号bs-40295G-HRP)。
1.3 实验动物SPF级C57小鼠100只,雌雄对半,雌鼠体质量(22±2)g,雄鼠体质量(30±2)g,购于新疆医科大学大学实验动物中心,合格证号为:SCXK(新)2018-0002。
1.4 细胞株S180细胞购于中乔新舟细胞库(批号NO.ZQ0204)。
2 方法
2.1 模型建立取对数生长期细胞S180,调整细胞密度7×105个/mL,于每只小鼠皮下接种0.2 mL细胞悬液,并对小鼠荷瘤情况进行观察及记录,若接种部位出现实体瘤并伴随腹部肿大表明造模成功。
2.2 分组与给药方法空白组(未接种S180细胞,灌胃给药剂量蒸馏水),另取80只造模成功的荷瘤小鼠,适应环境饲养1周后随机分为模型组(灌胃给药剂量蒸馏水)、顺铂组(腹腔注射顺铂0.2 mg/kg体质量)、酵母β-葡聚糖低、中、高剂量组(50、100、200 mg/kg体质量),每组16只,雌雄对半。隔天给药,1次/d。连续给药21 d,每周根据动物体质量情况调整灌胃液体体积。
2.3 观察指标
2.3.1 测定各组体指标、抑瘤率及脾脏指数 给药21 d后,眼球取血,颈椎脱臼法处死小鼠,检测各组小鼠体质量、瘤重、抑瘤率、和脾脏指数指标。对抑瘤率及脾脏指数进行计算,抑瘤率=[(模型组肿瘤重-实验组肿瘤重)/模型组肿瘤重]×100%,脾脏指数=脾脏质量/体质量。
2.3.2 小鼠血清中谷草酸转氨酶(AST)、谷丙转氨酶(ALT)、血清肌酐(CREA)、尿酸(UA)和血尿素氮(BUN)含量测定 将各组小鼠眼球采取静脉血放置6 h,充分析出血清,1 500 r/min离心10 min,收集血清,按ELISA试剂盒说明书方法操作测定小鼠血清中AST、ALT、CREA、UA、BUN的含量。
2.3.3 用蛋白印记法(Western blotting)检测肿瘤组织Caspase-3蛋白的表达水平 取-80℃保存的瘤组织于液氮中进行研磨粉碎,按照每1 mg添加10 μL的比例加入裂解液,进行冰上裂解30 min,裂解后于4℃,12 000 r/min离心10 min,取上清液,并用BCA法进行蛋白定量,确定蛋白浓度。取蛋白质(20 μg/lane),用10%SDS聚丙烯酰胺凝胶分离,然后转移到PVDF膜上。转膜结束后使用5%脱脂奶粉封闭2 h,用1×TBST清洗3次,每次10 min,一抗4℃孵育过夜;加入辣根过氧化物酶标记的二抗避光孵育2 h;曝光、显影、定影。用凝胶图像分析软件分析各条带光密度值,以β-actin为内参照,目的蛋白相对表达量以目的蛋白与β-actin光密度比值表示。
2.4 统计学处理采用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠抑瘤率比较与模型组比较,顺铂组与各剂量β-葡聚糖组抑瘤率均升高,顺铂组抑瘤率高于各剂量β-葡聚糖给药组,差异具有统计学意义(P<0.01),见表1。
表1 酵母β-葡聚糖对S180荷瘤小鼠瘤体生长及抑瘤率的影响 (±s,n=74)
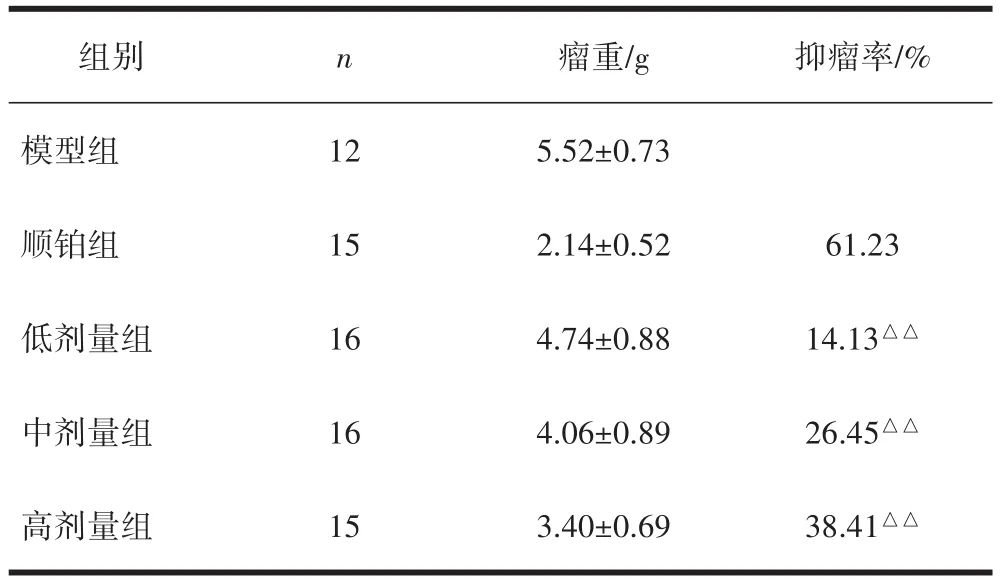
表1 酵母β-葡聚糖对S180荷瘤小鼠瘤体生长及抑瘤率的影响 (±s,n=74)
注:与顺铂组比较,△△P<0.01。
组别n 瘤重/g 抑瘤率/%模型组125.52±0.73顺铂组152.14±0.5261.23低剂量组164.74±0.8814.13△△中剂量组164.06±0.8926.45△△高剂量组153.40±0.6938.41△△
3.2 各组小鼠脾脏指数比较与空白组比较,模型组脾脏指数降低、顺铂组及各剂量β-葡聚糖给药组脾脏指数均升高,差异有统计学意义(P<0.01);与模型组比较,各给药组脾脏指数均升高,差异有统计学意义(P<0.01),与顺铂组比较,各剂量β-葡聚糖给药组脾脏指数变化不显著,见表2。
表2 酵母β-葡聚糖对S180荷瘤小鼠脾脏指数的影响(±s,n=90)

表2 酵母β-葡聚糖对S180荷瘤小鼠脾脏指数的影响(±s,n=90)
注:与空白组比较,**P<0.01 ;与模型组比较,##P<0.01。
组别空白组模型组顺铂组低剂量组中剂量组高剂量组n 16 12 15 16 16 15脾脏指数3.81±0.61 9.89±3.26**6.29±2.04##5.51±1.52##7.14±1.86##7.50±2.06##
3.3 酵母β-葡聚糖对小鼠血清中AST、ALT、BUN、UA和CRE含量影响与空白组比较,模型组及各给药组肝、肾功能指标明显升高,差异有统计学意义(P<0.01)。与模型组比较,顺铂组肝肾功能损伤相关指标升高,各剂量酵母β-葡聚糖组肝、肾功能指标有不同程度的明显下降,表现出良好的保护肝、肾功能的作用,差异有统计学意义(P<0.01)。与顺铂组比较,各剂量β-葡聚糖给药组肝、肾功能指标明显下降,差异有统计学意义(P<0.05),见表3。
表3 酵母的β-葡聚糖对S180荷瘤小鼠血清AST、ALT、BUN、UA和CRE的影响(±s)
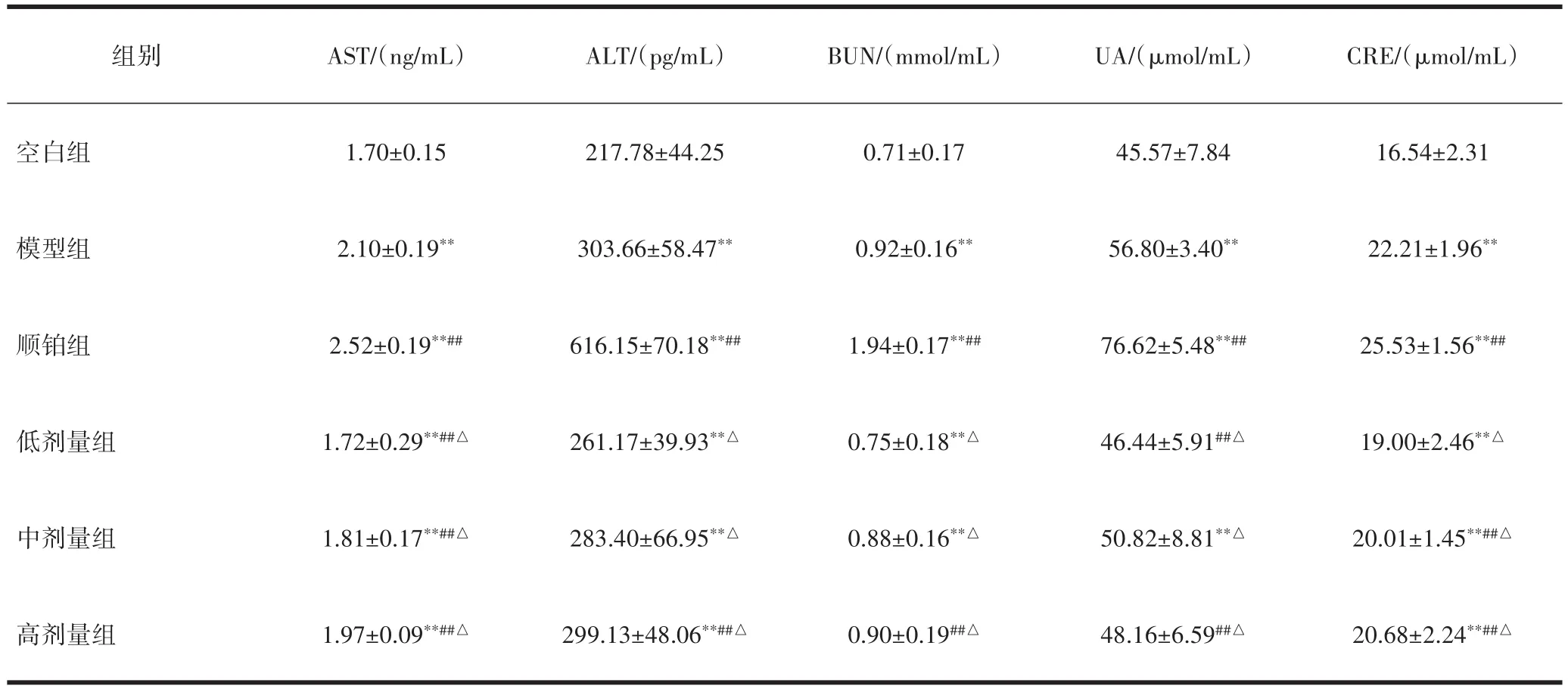
表3 酵母的β-葡聚糖对S180荷瘤小鼠血清AST、ALT、BUN、UA和CRE的影响(±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与顺铂组比较,△P<0.05。
组别AST/(ng/mL)ALT/(pg/mL)BUN/(mmol/mL)UA/(μmol/mL)CRE/(μmol/mL)空白组模型组顺铂组低剂量组中剂量组高剂量组1.70±0.15 2.10±0.19**2.52±0.19**##1.72±0.29**##△1.81±0.17**##△1.97±0.09**##△217.78±44.25 303.66±58.47**616.15±70.18**##261.17±39.93**△283.40±66.95**△299.13±48.06**##△0.71±0.17 0.92±0.16**1.94±0.17**##0.75±0.18**△0.88±0.16**△0.90±0.19##△45.57±7.84 56.80±3.40**76.62±5.48**##46.44±5.91##△50.82±8.81**△48.16±6.59##△16.54±2.31 22.21±1.96**25.53±1.56**##19.00±2.46**△20.01±1.45**##△20.68±2.24**##△
3.4 酵母β-葡聚糖对Caspase-3蛋白表达的影响与模型组比较,顺铂组、酵母β-葡聚糖各剂量给药组Caspase-3蛋白表达水平均升高,差异有统计学意义(P<0.01),见图1、2。

图1 Caspase-3蛋白在S180荷瘤小鼠肿瘤组织中的表达
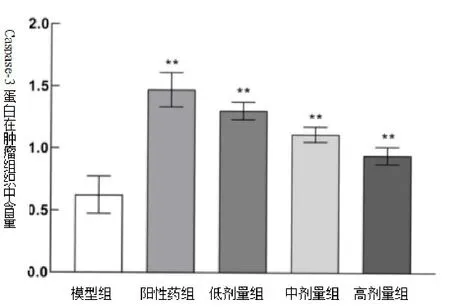
图2 Caspase-3蛋白在S180荷瘤小鼠肿瘤组织中的表达量
4 讨论
细胞毒性化疗药物作用机制为干扰肿瘤细胞的生长、修复、死亡过程,达到治疗效果。这些药物因缺少特异性而易产生的副作用,无法让药物仅对于肿瘤细胞起到杀伤作用。在肿瘤治疗的过程中,提高患者机体免疫功能已成为治疗肿瘤过程的重要手段。β-葡聚糖不仅具有广泛的来源,稳定的化学性质等特点,还有较低的毒副作用,是高效的生物应答物。在恶性肿瘤治疗方面应用前景广阔。研究发现肿瘤细胞凋亡过程发生紊乱与肿瘤的产生密切相关,多种基因共同调控肿瘤细胞的凋亡过程,如促凋亡基因、抑制凋亡基因及凋亡效应基因等[8]。抗肿瘤实验显示β-葡聚糖对正常细胞无杀伤作用,对肿瘤细胞有直接的细胞毒性作用[9]。本研究结果显示各剂量酵母β-葡聚糖组均能抑制S180肿瘤生长,但效果弱于顺铂组。恶性肿瘤在机体中发展的同时,免疫器官会发生明显变化,例如脾脏会发生肿大的现象,肿大程度与肿瘤发展进程有关。Caspase-3是细胞凋亡途径中重要的蛋白分子,多种细胞凋亡途径都通过Caspase-3信号传导诱导细胞凋亡[10-11]。正常情况下Caspase3以酶原形式存在于机体,当机体的凋亡信号传递到细胞内,凋亡小体形成可激活Caspase3家族[12]。Caspase-3是Caspase家族当中最为关键的成员,是凋亡的执行者,同时也是凋亡细胞Caspase级联反应必经的共同通路,所以Caspase-3也被称为细胞调节凋亡进程的“开关”。Caspase是一类天冬氨酸特异性的半胱氨酸蛋白酶,在人类细胞中Caspase-3的超量表达和激活均会引起细胞凋亡[13-15]。本研究表明酵母β-葡聚糖可以使肿瘤组织中Caspase-3蛋白表达增多,说明酵母β-葡聚糖可对凋亡相关基因进行调控,促进肿瘤细胞的凋亡。综上所述,酵母β-葡聚糖具有抗肿瘤活性,其作用机制与促进肿瘤细胞的凋亡有关。
