叶面喷施褪黑素对干旱及复水下玉米光合特性和抗氧化系统的影响
2021-11-09赵成凤李红杰郝淼艺王国兴张仁和
赵成凤,杨 梅,李红杰,郝淼艺,王国兴,2,张仁和*
(1 西北农林科技大学 农学院,陕西杨陵 712100; 2 宝鸡迪兴农业科技有限公司,陕西眉县 723000)
玉米是陕西省主要粮食作物之一,干旱严重限制玉米的生长发育和产量[1]。随着气候变化的加剧,高温和降雨不均匀导致玉米生长在干旱和复水的生境中[2]。因此干旱胁迫下维持玉米生长以及提高旱后复水植株的恢复潜能对于玉米适应干旱环境十分重要[3]。干旱通常会导致气孔关闭,阻碍CO2通过空气→细胞间隙→叶肉细胞的途径扩散,进一步引起光合作用下降。光能吸收与利用失衡促进活性氧(ROS)大量产生,植株启动复杂的保护酶系统清除活性氧来保护光合机构,但严重干旱仍破坏植株体内氧化还原动态平衡导致细胞膜氧化损伤。研究显示干旱解除后植物可以通过自身各种生理生化反应主动恢复生长,通过一定补偿效应,抵消因干旱胁迫对玉米造成的伤害[4];但植物重度干旱胁迫后复水其农艺性状与生理功能恢复程度仍低于正常灌水的水平[5]。可见,植物的抗旱性不仅体现在对干旱胁迫的耐受程度上,还应包括胁迫状态解除后的恢复生长能力[6],而且植株复水后的恢复能力取决于干旱程度、植株基因型和栽培管理因素(如氮素调控、喷施调控剂等)[7-8]。
褪黑素是一种重要的植物生长调节物质,也是一种直接的自由基清除剂和间接的抗氧化剂[9]。研究表明外源喷施褪黑素能够有效地提高植物对多种不利环境因素的抵抗力,如寒冷、干旱、盐和紫外线辐射等[10-13]。褪黑素能通过提高干旱胁迫下番茄的净光合速率、蒸腾速率、气孔导度、PSⅡ量子效率和电子传递保护其免受干旱诱导的光抑制或光氧化[14]。同时,褪黑素提高干旱胁迫下核桃叶片抗氧化酶的活性,增强了 ROS 清除能力,减轻了氧化损伤[15]。目前,外源褪黑素在提高植物抗逆性上的研究已有不少报道,但主要集中褪黑素缓解干旱胁迫的伤害程度上[16],而外源褪黑素对干旱复水后调控玉米叶片光合电子传递特性及抗氧化系统作用机理研究还相对较少。鉴于此,本研究采用盆栽控水试验,以陕北旱区主推玉米品种‘陕科9号’为材料,探究叶面喷施褪黑素对干旱及复水下玉米生长、光合作用、抗氧化酶活性和相关基因表达的影响,旨在阐明干旱及复水条件下叶面喷施褪黑素改善玉米抗旱性的生理机制,为玉米抗旱节水栽培提供理论依据。
1 材料和方法
1.1 试验设计
试验采用人工盆栽控水的方法,于2020年5-9月在西北农林科技大学农作物示范园活动式防雨棚内进行。供试玉米(ZeamaysL.)品种为‘陕科9号’。挑选饱满的玉米种子播种于规格基本相同的塑料桶(内径26 cm,深38 cm)内,栽培基质为风干粘壤土,每桶装土15 kg,土壤田间最大持水量为28.1%。播种前,每桶分别加入1.6 g 纯N、0.6 g P2O5和0.8 g K2O。三叶期定苗至每盆3株,定苗后玉米长至第9片叶完全展开时开始控水。试验设置4个处理:(1)正常供水+叶面喷施蒸馏水(CK);(2)正常供水+叶面喷施100 μmol·L-1褪黑素(MT);(3)重度干旱+叶面喷施蒸馏水(DS);(4)重度干旱+叶面喷施100 μmol·L-1褪黑素(DS+MT)。课题组前期的试验表明100 μmol·L-1褪黑素是减轻光合机构损伤的较有效浓度,因此选择100 μmol·L-1的褪黑素进行试验[16]。控水开始后的每天下午8:00对玉米植株喷施褪黑素或清水,喷施体积以水珠布满叶片开始从叶片滴下时停止。正常供水土壤含水量是土壤田间持水量的80%,重度干旱土壤含水量是土壤田间持水量的40%,采用称重法对盆栽进行控水处理,盆栽每天称重后,按照土壤持水量的80%和40%计算每盆的灌水量,进行灌水[17]。重度干旱维持6 d后进行取样和数据测定,然后复水(充分灌水至土壤相对含水量的80%)12 d后测定叶片各项指标。
1.2 叶面积、叶片相对含水量和地上部干物质的测定
1.2.1 叶面积每处理随机选取6株,用直尺测量其叶长、叶宽,计算单叶叶面积,单株叶面积为所有平展叶的叶面积总和。按以下公式计算单叶叶面积:
单叶面积=叶长×最大叶宽×0.75
1.2.2 叶片相对含水量(RWC) 每个处理取3株玉米的穗位叶叶片,称量叶片鲜质量(FW)后迅速将其插入清水中浸泡8 h,再将叶片从水中取出,擦拭掉叶片表面多余水分并称取饱和鲜质量(TW),最后经105 ℃下杀青30 min,80 ℃烘至恒重,称干质量(DW),按以下公式计算叶片相对含水量:
RWC = (FW-DW)/(TW-DW)×100%
1.2.3 地上部干物质重每处理随机取样5株,采集所有植株的叶和茎于烘箱105 ℃杀青30 min,然后80 ℃烘箱烘干至恒重后称重。
1.3 叶片叶绿素荧光及P700 氧化还原状态的测定
选取顶部第三片完全展开的叶片暗适应30 min,然后利用Dual-PAM-100荧光仪(Walz, Germany)对活体玉米叶片的叶绿素荧光和P700氧化还原状态进行测定。测量时饱和脉冲光光强为10 000 μmol·m-2·s-1,光化光的光强为600 μmol·m-2·s-1。暗适应后首先打开测量光测定最小荧光产量(Fo),接着打开一个饱和脉冲,测量暗适应30 min后的最大荧光(Fm)和最大P700信号(Pm),随后打开光化光(AL),同时间隔一段时间打开一个饱和脉冲测定荧光信号,得到实际荧光产量(Fs)、光适应下最大荧光值(Fm′)和光下最大P700信号(Pm′)。PSⅡ 荧光参数主要包括:PSⅡ 量子产量Y(Ⅱ)、非调节式能量耗散的量子产量Y(NO)、调节式能量耗散的量子产量Y(NPQ);PSⅠ 荧光参数包括:PSⅠ 量子产量Y(Ⅰ)、由供体侧限制引起的PSⅠ处非光化学能量耗散的量子产量Y(ND)、由受体侧限制引起的PSⅠ处非光化学能量耗散的量子产量Y(NA)[18]。
1.4 叶片MDA含量与H2O2含量的测定
取各处理0.5 g叶片于预冷的研钵内,加入5 mL 50 mmol·L-1磷酸缓冲液(pH7.8),研磨成匀浆后转入离心管中,在4 ℃、4 000×g下离心20 min,吸取上清液保存到4 ℃冰箱,用于测定H2O2和MDA含量。
MDA含量采用TCA-TBA比色法测定[19]。取离心的上清液1 mL(对照加1 mL蒸馏水)和2 mL硫代巴比妥酸(0.6%,W/V)的混合物煮沸15 min,冷却后在4 000 ×g离心15 min,然后分别在532 nm、600 nm和450 nm波长下测定吸光度。各处理重复3次。
H2O2的含量参考Chen等的方法测定[20]。取离心的上清液2 mL (对照加2 mL蒸馏水),加入2 mL 0.6%硫代巴比妥酸溶液,混匀物于沸水浴上反应15 min,迅速冷却吸取离心的上清液2 mL (对照加2 mL蒸馏水),加入2 mL 0.6%硫代巴比妥酸溶液,混匀物于沸水浴上反应15 min,迅速冷却后再离心。各处理重复3次。
1.5 叶片抗氧化酶活性测定
称取各处理0.5 g叶片于预冷的研钵内,加入5 mL磷酸缓冲液(50 mmol·L-1,pH7.8)在冰浴上研磨成浆,在4 ℃、12 000 r/min下离心20 min,吸取上清液保存到4 ℃冰箱,用于测定叶片SOD、CAT、APX和GR活性。
SOD活性的测定采用氮蓝四唑(NBT)光还原法[21]。通过监测NBT的光化学还原的抑制来测定SOD活性,酶反应体系为磷酸缓冲液(50 mmol·L-1,pH7.8)、甲硫氨酸(130 mmol·L-1)、核黄素液(20 μmol·L-1)、NBT(750 mmol·L-1)、乙二胺四乙酸二钠(100 μmol·L-1)、0.5 mL蒸馏水和0.1 mL粗酶液(对照加0.1 mL蒸馏水),其中一管对照放置黑暗中作空白管,将其余各管在 4 000 Lux下光照30 min,以空白调零,测定反应液在560 nm下的吸光度。各处理重复3次。
CAT活性的测定采用紫外吸收法[21]。通过检测H2O2在240 nm处的吸光度降低来测定CAT活性,酶反应体系为磷酸盐缓冲液(100 mmol·L-1,pH7.0),H2O2(20 mmol·L-1)和0.1 mL粗酶液,在25 ℃下通过H2O2启动反应,立即在紫外分光光度计上测定240 nm处的吸光度A240(蒸馏水调零),每隔30 s读数一次,共测3 min。各处理重复3次。
APX活性的测定采用过氧化氢法[22]。酶反应体系包括磷酸缓冲液(50 mmol·L-1,pH 7.0,内含0.1 mmol·L-1乙二胺四乙酸二钠), 5 mmol·L-1AsA,20 mmol·L-1H2O2和粗酶液。加入H2O2以启动反应,立即在290 nm下测定吸光值,每隔30 s读数一次,共测3 min。各处理重复3次。
GR活性的测定采用比色法[23]。酶反应体系包括Tris-HCl(100 mmol·L-1,pH 8.0),GSSG(1 mmol·L-1),NADPH(0.2 mmol·L-1)和粗酶液,由NADPH启动反应,在340 nm下测定吸光值。各处理重复3次。
1.6 抗氧化酶相关基因的相对表达量的测定
基因的相对表达量采用实时荧光定量PCR(qRT-PCR)测定。取冷冻叶样品300 mg在液氮下研磨成粉末,并使用RNA提取试剂盒(TIANGEN,China)提取总RNA。然后,根据制造商的说明书(FastQuant RT Kit,TIANGEN,China)对RNA进行反转录合成cDNA。以合成 cDNA为模板,对相关基因进行PCR扩增,RT-PCR按照制造商的说明书(SuperReal PreMix Plus (SYBR Green,Tiangen,China)进行。基因特异性引物设计采用Primer Premier 5.0,以GADPH为内参基因。引物序列详见表1。
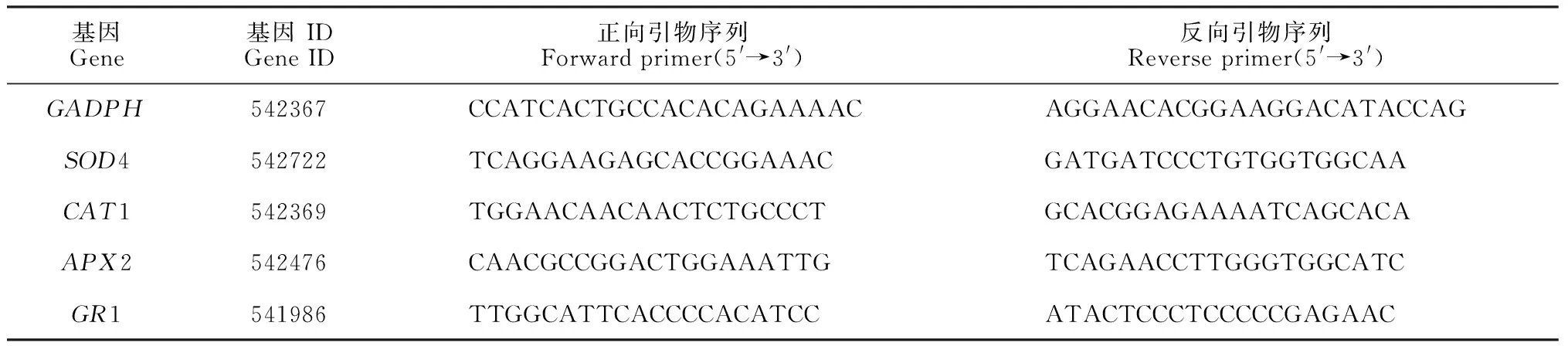
表1 qRT-PCR引物列表
1.7 数据处理
采用SPSS 12.0软件进行数据处理和分析,用Duncan的多重比较方法,显著水平为0.05;采用Excel 2010进行绘图。本研究给出的所有数据均为3个重复的平均值±标准误(Mean±SE)。
2 结果与分析
2.1 干旱及复水下外源褪黑素对玉米生长发育的影响
图1显示,与CK相比,玉米叶片相对含水量(RWC)、地上部干物质量以及叶面积在CK和MT处理下均没有受到显著影响,在单独干旱胁迫处理(DS)下分别显著下降了24.6%、37.2%和29.7%,在DS+MT处理下虽分别显著下降了13.6%、15.7%和12.0%,但均显著高于相应的单独干旱胁迫处理。在复水后,干旱胁迫下叶面喷施褪黑素的玉米各指标都恢复到对照水平,而未喷施褪黑素的干旱胁迫植株则未能完全恢复,仍显著低于同期CK。以上结果表明叶面喷施褪黑素有利于提高玉米抗旱性及复水后的生长恢复。

CK.正常供水+叶面喷施蒸馏水;MT.正常供水+叶面喷施100 μmol·L-1褪黑素; DS.重度干旱+叶面喷施蒸馏水;DS+MT.重度干旱+叶面喷施100 μmol·L-1褪黑素。不同字母表示0.05水平差异显著。下同图1 干旱及复水下外源褪黑素对玉米叶片含水量、叶面积及地上部生物量的影响CK. Distilled water pretreatment plus well watered; MT.100 μmol·L-1 melatonin plus well watered; DS. Distilled water pretreatment plus drought; DS+MT.100 μmol·L-1 melatonin plus drought. Different letters indicate significant difference at the 0.05 level. The same as belowFig.1 Effect of exogenous MT on leaf water content, leaf area and aboveground biomass of maize under drought and rewatering
2.2 干旱及复水下外源褪黑素对玉米叶片PSⅡ和PSⅠ光能分配的影响
干旱胁迫使得玉米叶片PSⅠ有效光化学量子产量Y(Ⅰ)比CK显著降低42.16%(图2,A),却使其叶片Y(NA)和Y(ND)比CK显著升高(图2,C、E);外源喷施褪黑素处理对正常灌水条件下的玉米叶片Y(Ⅰ)、Y(NA)和Y(ND)均无显著影响,却使干旱胁迫下的玉米叶片Y(Ⅰ)显著升高,Y(NA)和Y(ND)显著降低,但Y(Ⅰ)仍显著低于CK,Y(NA)仍显著高于CK,而Y(ND)则恢复至CK水平。在复水之后,叶面喷施外源褪黑素的玉米叶片Y(Ⅰ)、Y(NA)和Y(ND)均恢复到对照水平,而单独干旱胁迫处理的玉米仅Y(ND)恢复至CK水平,但Y(Ⅰ)和Y(NA)仍与对照存在显著差异(图2,A、C和E)。
同时,图2,B、D、F显示,玉米叶片PSⅡ有效光化学量子产量Y(Ⅱ)、调节性能量耗散的量子产量Y(NPQ)和非调节式能量耗散Y(NO)在CK和MT处理下均没有受到显著影响。在干旱胁迫下(DS),其Y(Ⅱ)和Y(NPQ)分别比CK显著降低26.6%和17.9%,Y(NO) 则比CK显著增加58.7%。在干旱胁迫后喷施褪黑素使玉米叶片Y(NPQ)恢复至CK水平,Y(Ⅱ)虽显著提高但仍显著低于CK,Y(NO) 虽显著比DS处理降低但仍显著高于CK;与干旱处理相比,外源褪黑素处理叶片Y(Ⅱ)和Y(NPQ)分别显著增加18.1%和23.6%,而Y(NO)显著下降22.9%。在复水以后,叶面喷施外源褪黑素使Y(Ⅱ)和Y(NO)恢复至正常水平。以上结果说明干旱胁迫使玉米叶片的光合机构受到破坏,抑制其光能利用效率,但相比单独干旱外源喷施褪黑素处理玉米受到的影响更小,且复水后外源褪黑素处理幼苗能及时调节自身的生理机制来消除干旱胁迫造成的影响。

Y(Ⅰ).PSⅠ 量子产量;Y(ND).由于供体侧限制引起的 PSⅠ 处非光化学能量耗散的量子产量; Y(NA).由于受体侧限制引起的 PSⅠ 处非光化学能量耗散的量子产量;Y(Ⅱ).PSⅡ 量子产量;Y(NPQ).调节性能量耗散的量子产量;Y(NO).非调节性能耗散的量子产量图2 干旱及复水下外源褪黑素对玉米叶片PSⅡ和PSⅠ光能分配的影响Y(Ⅰ). Effective quantum yield of PSⅠ; Y(ND). The quantum yield of non-photochemical energy dissipation due to the donor side limitation; Y(NA). The quantum yield of non-photochemical energy dissipation due to the acceptor side limitation; Y(Ⅱ). Effective quantum yield of PSⅡ; Y(NPQ). Quantum yield of regulatory energy dissipation; Y(NO). Quantum yield of non-regulatory energy dissipationFig.2 Effect of exogenous MT on light energy distribution in PSⅡ and PSⅠ of maize leaves under drought and rewatering
2.3 干旱及复水下外源褪黑素对玉米叶片抗氧化酶活性及膜透性的影响
如图3所示,在正常供水条件下,叶面喷施褪黑素对玉米叶片4种抗氧化酶活性没有显著影响;玉米叶片SOD、CAT、APX和GR的活性在单独干旱胁迫下分别比相应对照显著提高35.2%、35.5%、118.9%和106.6%,而在叶面喷施褪黑素后进一步显著增加,相比单纯干旱胁迫处理分别显著增加了24.2%、48.7%、34.7%和26.8%。在复水以后,外源褪黑素处理玉米叶片SOD、CAT、APX和GR活性均恢复至对照水平,而未喷施褪黑素的玉米植株叶片各抗氧化酶活性仍显著于相应对照。这表明叶面喷施褪黑素可能使干旱胁迫条件下玉米通过显著增强抗氧化酶活性来清除更多活性氧,从而减轻干旱胁迫导致的过氧化损伤,且复水后褪黑素处理的玉米恢复速度比干旱胁迫的玉米快。

图3 干旱及复水下外源褪黑素对玉米叶片抗氧化酶活性的影响Fig.3 Effect of exogenous MT on antioxidant enzyme activities of maize leaves under drought and rewatering
同时,干旱胁迫会导致玉米叶片膜脂过氧化和氧化损伤。与CK相比,干旱胁迫使玉米叶片MDA和H2O2含量大幅度增加,增加幅度分别达132.6%和140.4%;干旱胁迫条件下喷施褪黑素可以显著减少玉米叶片MDA和H2O2的积累,但仍未恢复至对照水平,分别比对照显著增加69.5%和82.0%(图4,A、B)。在复水以后,褪黑素处理的玉米叶片MDA和H2O2含量恢复至对照水平,而单纯干旱处理的玉米叶片MDA和H2O2含量仍显著高于对照。此外,正常供水条件下喷施褪黑素对玉米叶片MDA和H2O2含量影响较小(图4,A、B)。这表明一定浓度的外源褪黑素可有效地缓解干旱胁迫下玉米叶片受到的膜脂过氧化损伤。

图4 干旱及复水下外源褪黑素对玉米叶片MDA和H2O2含量的影响Fig.4 Effects of exogenous MT on MDA and H2O2 contents of maize leaves under drought and rewatering
2.4 干旱及复水下外源褪黑素对玉米叶片抗氧化酶活性相关基因表达的影响
为了进一步明确外源褪黑素对干旱及复水下玉米叶片抗氧化酶的影响,通过定量实时PCR测定了4个抗氧化酶基因的表达变化(图5)。在正常灌水条件下,喷施褪黑素对玉米叶片中各抗氧化酶相关基因的表达均没有显著影响;干旱胁迫导致玉米叶片中SOD4、CAT1、APX2和GR1基因的相对表达量分别上调为CK的2.5、1.7、1.7和2.0倍;叶面喷施褪黑素能够进一步诱导受旱玉米叶片中SOD4、CAT1、APX2和GR1的表达量分别为CK的3.1、2.3、1.9和3.1倍。在复水后,玉米叶片4个抗氧化酶相关基因的表达量在褪黑素处理下均恢复至对照水平,而单纯干旱胁迫处理仍显著高于CK。表明褪黑激素不仅在抗氧化酶活性水平上起作用,且在基因水平上也有明显促进作用。
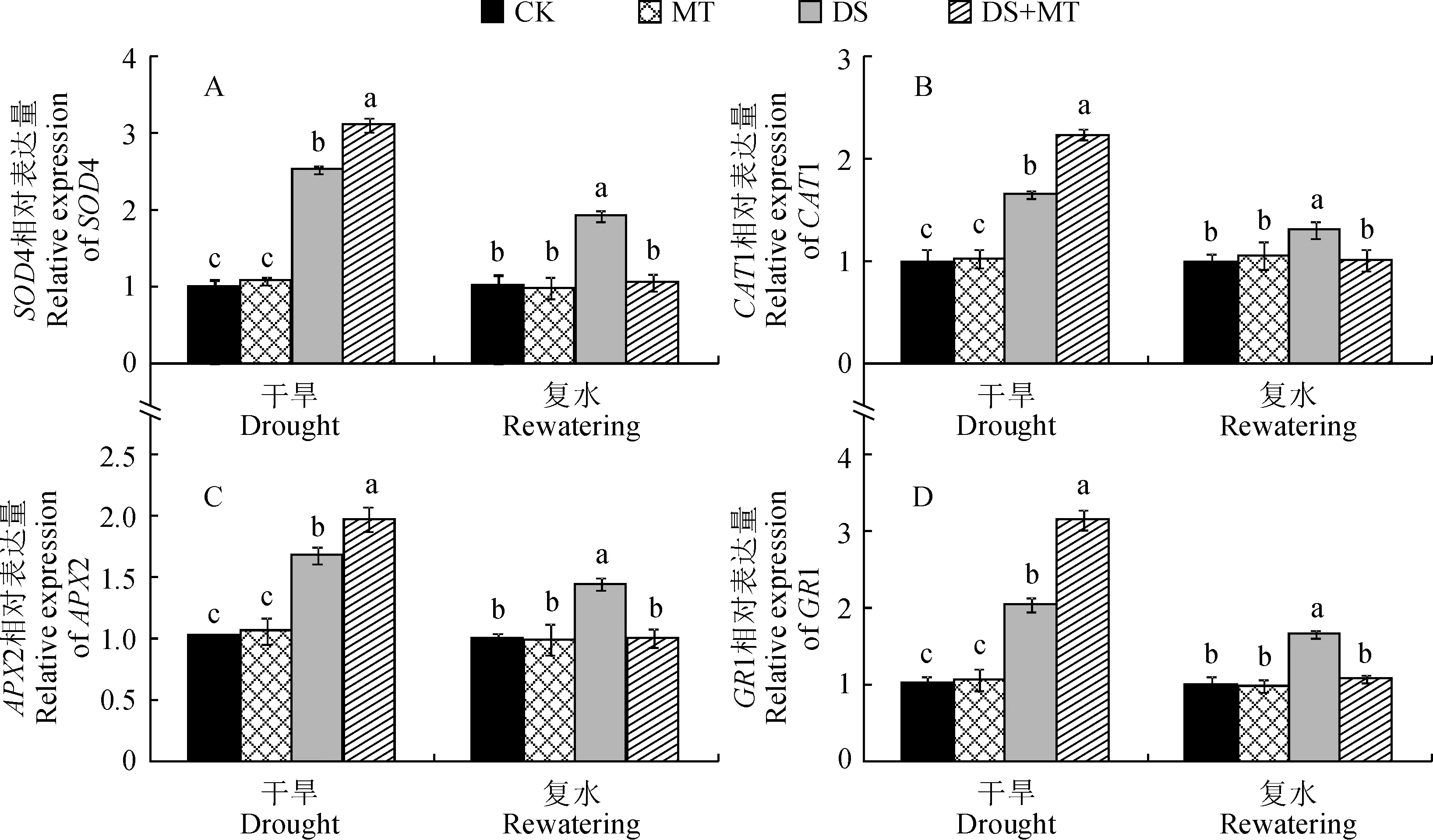
图5 干旱及复水下外源褪黑素对玉米叶片抗氧化酶基因相对表达量的影响Fig.5 Effects of exogenous MT on the antioxidant enzyme genes relative expression level of maize leaves under drought and rewatering
3 讨 论
植株叶片含水量和干物质积累量是玉米忍耐干旱能力的主要指标[24]。本研究结果表明,干旱胁迫严重抑制玉米的生长,干旱胁迫下玉米干物质积累量、株高以及叶面积均显著下降,而叶面喷施褪黑素减轻了干旱诱导的生长抑制的严重程度,增加了玉米地上部干物质量;同时,外源褪黑素处理可以改善植物体内水分含量,显著缓解叶片相对含水量(RWC)的下降。这可能是因为干旱胁迫下叶面喷施褪黑素的玉米可以维持较低的渗透势以及保持了较高的膨压,从而有助于干旱胁迫下玉米叶片水分含量保持稳定[5]。复水后褪黑素处理的玉米干物质量、叶面积和RWC均恢复到对照水平,表明施褪黑素促进了复水后玉米叶片的生长和干物质积累[25]。干旱胁迫下较高的玉米RWC及叶面积可能有助于保持气孔开放和相对较高的光合面积[25],而这可能使玉米维持良好的光合作用。
叶绿素荧光技术能揭示逆境胁迫下植物光合作用系统电子传递过程的变化,其中光系统能量转换效率能反映逆境下PSⅡ和PSⅠ活性综合信息[26]。研究表明,严重干旱胁迫会导致植物叶面积严重减少,光合色素降解,破坏PSⅡ和PSⅠ反应中心,阻碍两个光系统间的电子传递,从而影响植物生长[16]。本试验结果表明干旱胁迫对玉米叶片的光合机构造成了严重的伤害,PSⅡ受到严重的光抑制,而PSⅠ的供受体侧也受到干旱的伤害;而叶面喷施褪黑素增加了干旱胁迫下玉米叶片的Y(Ⅱ)和Y(Ⅰ),提高了两个光系统的量子利用效率,增强了对光系统的保护和修复。类似的现象在苹果和猕猴桃中也有报道[27-28]。本研究还发现干旱后复水施用褪黑素的玉米叶片光合速率完全恢复,表明施用外源褪黑素可以加速叶片光合活性的恢复。可见,叶面喷施外源褪黑素通过维持相对较高的2个光合光系统活性及其能量分配,从而提高玉米对干旱胁迫的耐受性。
干旱导致光合作用电子传递受阻,引起ROS的过度积累,造成植物体内氧化还原动态失衡[29-30]。这种氧化还原失衡反过来扰乱植物光系统的功能来阻碍植物的正常光合作用[31]。在本研究中,玉米叶片MDA和H2O2含量在干旱胁迫下均显著提高,即使复水解除了干旱胁迫,它们的含量仍显著高于对照,表明干旱胁迫诱导产生的ROS使膜严重受损。为了减轻这些ROS的危害,植物已经进化出一个复杂的抗氧化酶和非抗氧化酶防御系统[31]。本研究结果表明,玉米植株能通过增强自身抗氧化酶活性(SOD、CAT、APX和GR)来减轻干旱胁迫诱导的氧化胁迫伤害,外源褪黑素处理使受旱玉米叶片抗氧化酶活性得到显著增强,而叶片中MDA和H2O2含量显著下降;复水后外源褪黑素处理玉米叶片的抗氧化酶系统活性以及ROS水平都恢复到正常范围,这表明喷施外源褪黑素可以加速提高玉米抗氧化系统的性能,从而维持活性氧的产生和积累之间的平衡,消除干旱诱导的氧化应激。此外,不同处理下玉米叶片抗氧化酶相关基因(SOD4、CAT1、APX2、GR1)表达量的变化趋势与其对应的抗氧化酶活性(SOD、CAT、APX、GR)的变化相一致,表明外源褪黑素可能是通过调节编码这些酶的关键基因的表达来调节玉米植株叶片抗氧化酶活性,但其分子调控机制需要进一步的系统深入研究。
综上所述,叶面喷施褪黑素能显著提高玉米叶片PSⅡ和PSⅠ的光合活性,从而有效缓解干旱胁迫造成的光损伤,同时也增加了叶片内抗氧化酶活性及其相关基因的表达,减少ROS的产生,最终缓解氧化胁迫的伤害;而复水后叶面喷施外源褪黑素改善玉米叶片光合作用效率和抗氧化系统的恢复能力,促进玉米植株生长,有效适应干旱多变环境。
