微乳液耦合微波辐照制备β-半水硫酸钙*
2021-11-09卢佳艳杨柳春
卢佳艳, 杨柳春
(湘潭大学 环境与资源学院,湖南 湘潭 411105)
0 引言
硫酸钙俗称石膏,是一种具有良好理化性能的传统无机材料,在建筑建材、模具、医药、环保等行业有广泛应用[1].根据其结晶水含量区分,主要有三种相态,分别为二水硫酸钙(DH)、半水硫酸钙(HH,α型与β型)以及无水硫酸钙(AH).硫酸钙的晶体形貌、相态、粒径及其分布等很大程度上决定着其性能与应用途径.DH在自然界中矿储较多,又是工业副产石膏的主要成分.近年来研究较多的为HH与AH相,尤其是α-HH,而β-HH研究较少.β-HH一般是在干燥空气或真空中高温煅烧制备而成[2],从水溶液体系中制取的研究较少.其生成机理主要有两种:一种是DH脱去1.5个水分子直接生成β-HH;另一种是DH先脱水形成可溶性AH,再吸附0.5个水分子形成β-HH.
微乳液是由两种及以上互不相溶液体通过添加表面活性剂而形成的热力学稳定体系.根据体系中油水比例,可将微乳液分为油包水型(W/O)、水包油型(O/W)以及油水双连续型三种[3],其中W/O型微乳液又被称为反相微乳液,O/W型被称为正相微乳液.本文采用微波加热方式,以氯化钙和硫酸为原料、SDS为晶型控制剂,为在水溶液体系中快速制备β-HH提供一个新思路.
1 实验材料与方法
1.1 实验仪器与药品
微波合成/消解仪(PRO P/T 16MFSOLV,澳大利亚),分析天平(AUY220,日本),差示扫描量热仪TG-DSC(STA-449 F5 NETZSCH,德国),扫描电子显微镜SEM(JSM-6360LV,日本),X射线衍射仪XRD(D/Max-2500pc,Rigaku Inc),傅里叶变换红外FT-IR(NICOLET380,美国),烘箱(101-1AB,天津),恒温磁力搅拌器(07HWS-2,杭州);无水氯化钙,硫酸,正辛烷,正戊醇,十二烷基硫酸钠(SDS),实验所用试剂均为分析纯,实验室所用水均为超纯水.
1.2 实验方法
在烧杯中加入表面活性剂SDS,滴加10 mL硫酸,在60 ℃、500 r/min转速下使其溶解后滴加3 mL正辛烷,溶液变浑浊,然后逐滴加入正戊醇使其澄清透明,从而制成硫酸微乳液.向微乳液中移入10 mL氯化钙溶液,然后将溶液转入反应管,旋转放气螺母保持初始压力在1×105Pa左右,放入微波合成仪或水热合成釜中加热反应.此实验所使用硫酸与氯化钙物质的量的比为1∶1.
反应结束后,待温度降至70 ℃时立即将产物取出,将溶液进行抽滤,并用沸水和无水乙醇洗涤数次,将样品放入60 ℃烘箱中干燥,待干燥完成后装袋以供表征.β-半水硫酸钙的工艺流程如图1所示.对样品采用TG-DSC,XRD,FT-IR,SEM分析成分、相态及形貌等.
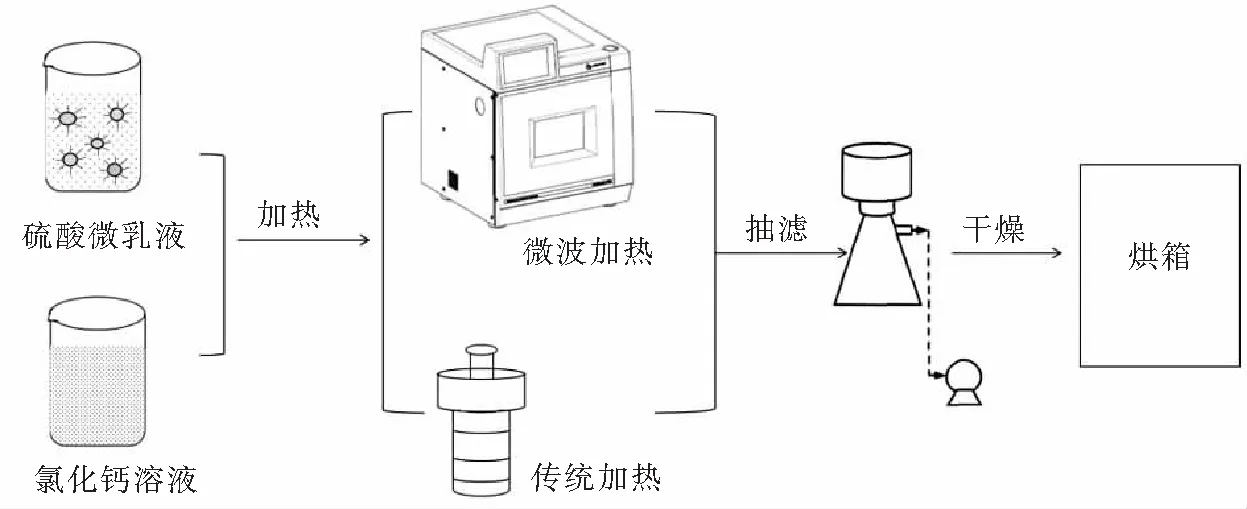
图1 工艺流程图Fig.1 Process flow diagram
2 结果与讨论
2.1 硫酸钙的合成条件
硫酸钙的三个相态DH、HH和AH之间可相互转化,DH可脱水形成HH和AH,而HH有水化成DH和脱水形成AH的趋势,主要取决于溶液温度与过饱和度.因此,本文重点研究不同反应温度、反应时间、SDS用量、原料浓度、搅拌速率对合成HH的影响.具体反应如表1所示.
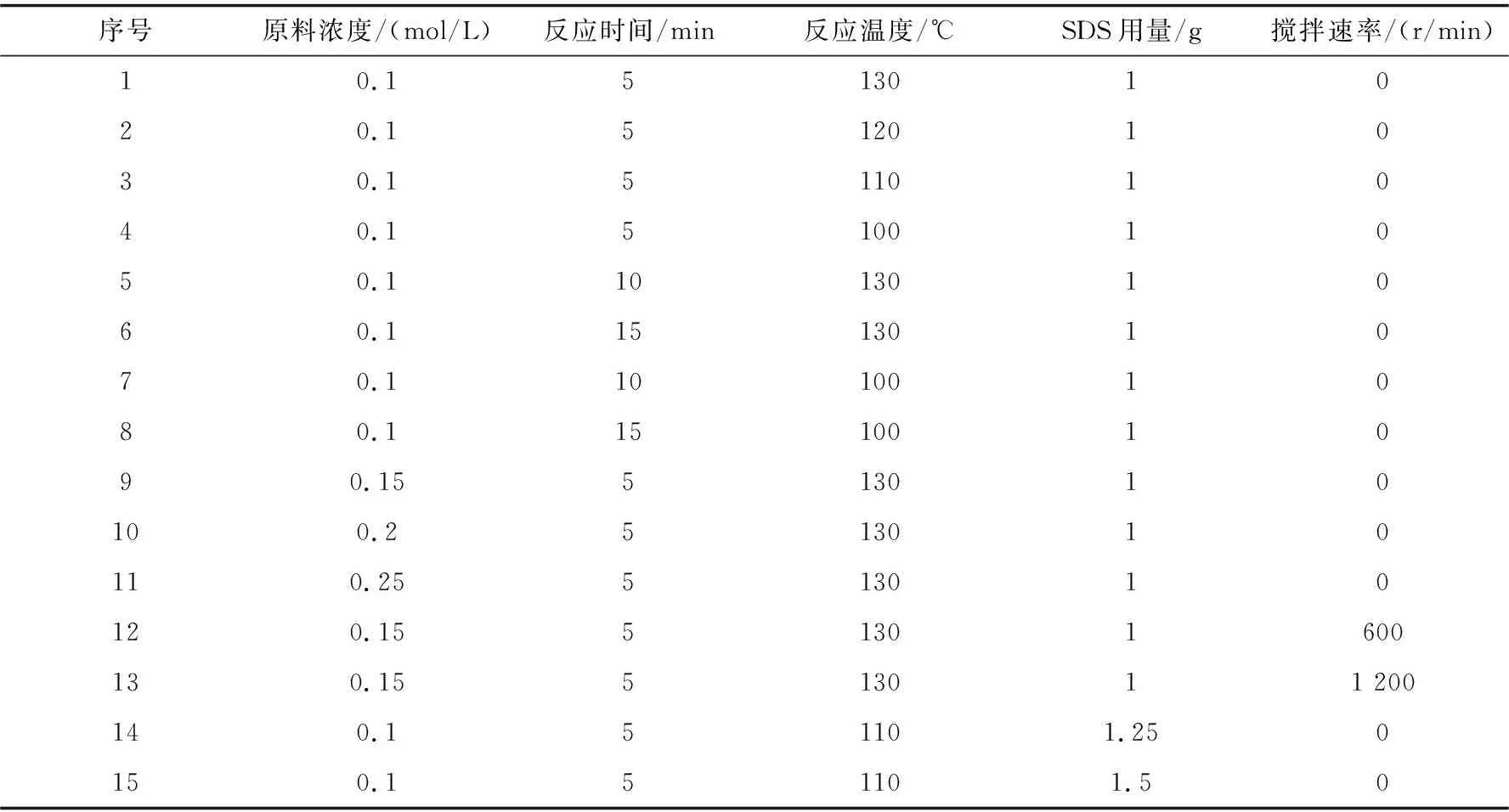
表1 微波辐照下合成硫酸钙的反应条件
2.1.1 反应温度硫酸钙发生相变的主要因素之一是温度,因此,在原料浓度为0.1 mol/L、反应时间5 min的条件下,探究不同反应温度对样品相态及形貌变化的影响.
随着温度升高,样品失重率逐渐减小,表明升高温度可促进HH的生成.DH理论结晶水含量为20.9%,HH为6.2%.在图2(a)中,反应温度为100 ℃时的样品存在DH与HH;反应温度为110 ℃与120 ℃时样品并没有完全生成HH,仍然存在少部分DH;130 ℃条件下,样品基本转化为HH,表明微波辐照条件下,温度达到130 ℃时可在5 min这样较短的时间内生成HH.从图2(b)的DSC图可看出,在150 ℃左右有一个吸热峰,表明DH脱水形成HH,而此吸热峰位置有所变化,可能与晶体尺寸有关[4];在350 ℃有一个小的放热峰,而在170 ℃左右无放热峰,推测该反应形成β-HH.
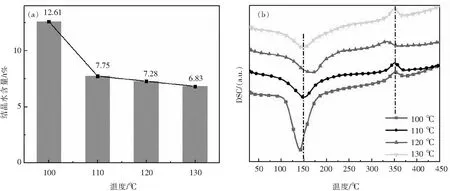
图2 反应温度对样品结晶水含量的影响(a)与DSC图(b)Fig.2 Effect of reaction temperature on crystal water content of samples (a) and DSC diagram(b)
对不同温度条件下产物样品XRD图(如图3所示)进行分析,在100 ℃时样品主要存在DH特征峰,同时也存在HH特征峰;而其他三种温度下样品则无明显CaSO4·2H2O特征峰,主要为CaSO4·0.5H2O,其特征峰主要位于14.720°、25.671°、29.691°、31.901°和49.362°,分别与(200)、(020)、(400)、(204)和(424)晶面相对应(PDF 41-0224).同时在120 ℃与130 ℃条件下,处于29.691°的HH衍射峰强于另外两种温度,表明随着反应温度升高,DH逐渐脱水转化为HH,且结晶度较好,这与热分析曲线相一致.
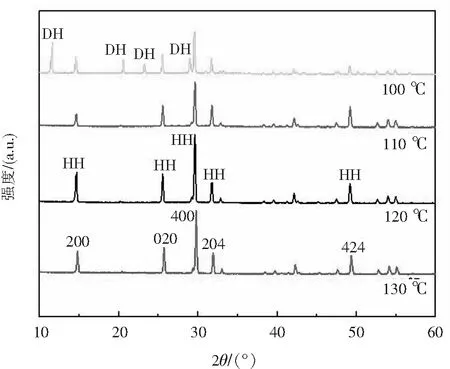
图3 不同温度条件下产物样品XRD图Fig.3 XRD images of samples at different temperatures
2.1.2 反应时间为探究反应时间对合成硫酸钙相态及形貌的影响,在原料浓度为0.1 mol/L、反应温度为100 ℃和130 ℃的条件下,控制反应时间分别为5 min、10 min、15 min .同时,以高压釜为反应器,在130 ℃及140 ℃下用水热法制备HH样品作为对照组.
如图4所示,随着反应时间延长,样品结晶水含量减小.在微波加热130 ℃下反应5 min时,产物几乎全部转化为HH;反应10 min时,已全部达到HH理论结晶水含量;反应15 min时,失重率达5.83%,部分HH结构通道中脱去0.5水分子每摩尔,形成Ⅲ型CaSO4(又称可溶性CaSO4),即“零水半水化合物”[5].在100 ℃条件下反应15 min时可接近HH理论结晶水含量.
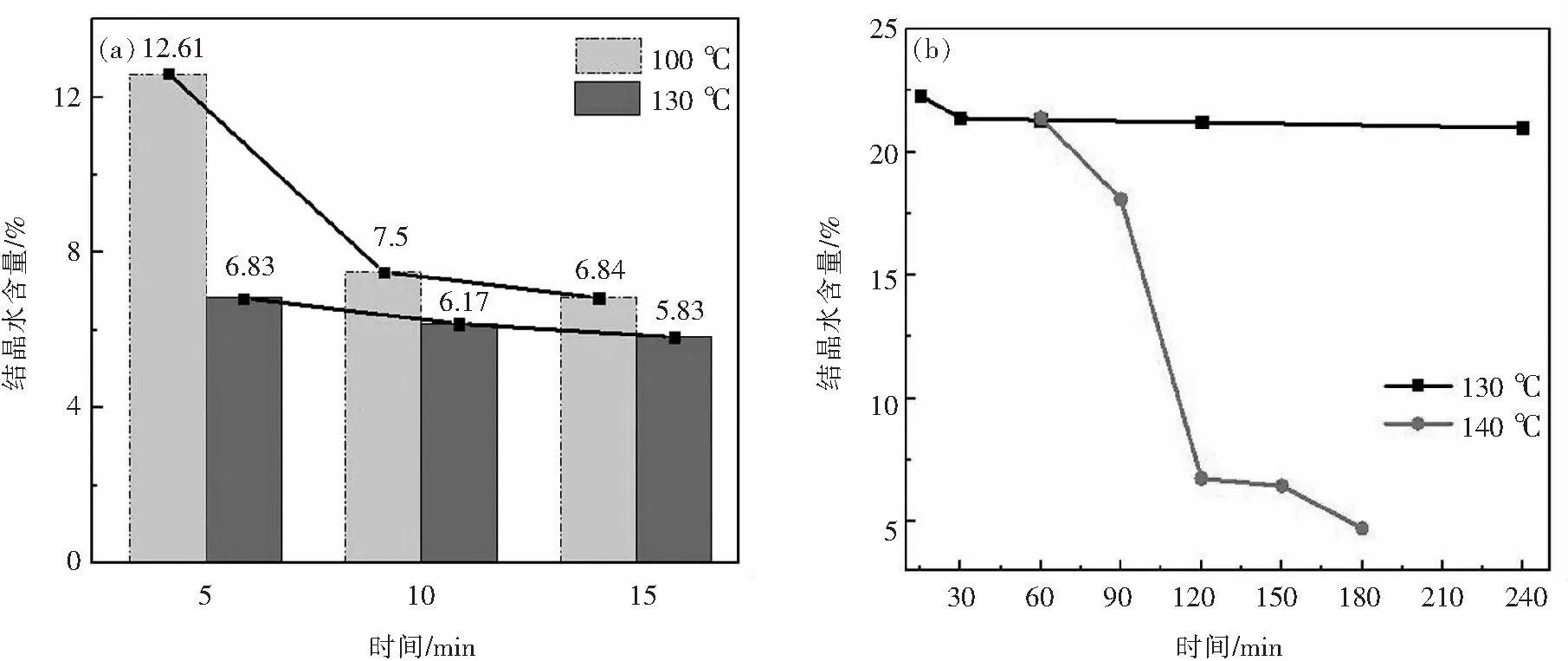
图4 微波(a)与高压釜(b)加热条件下样品结晶水含量图Fig.4 The crystal water content of the sample under microwave (a) and traditional (b) heating conditions
一般DH相变温度为98~105 ℃,而水热法为实验室制备HH的常用方法,其脱水形成HH所需温度一般为110 ℃;采用均相沉淀法,以氯化钙和硫酸钠为原料,反应温度至少需在130 ℃时才可完全转变为HH[6].我们以高压釜为反应器,在130 ℃条件下反应,反应时间达到4 h的产物仍为DH;在140 ℃的条件下也需2 h才转化为HH,其产物仍为β型,当时间延长至3 h时,脱水率可达到4.71%,表明增加时间可形成Ⅲ型CaSO4.总的来说,传统加热方式转化为HH所需时间比微波加热情况下大大延长.微乳液法所需相变温度低于传统水热法的原因可能为,HH发生相变的主要因素之一是水活度,而在胶束表面附近的水分子重定向运动衰减速率比在水溶液中慢两个数量级,因而微乳液中的水活度低于普通水溶液,使DH脱水形成HH所需温度降低[7-8].同时,采用微波加热,将电磁能转化为热能,使热量在整个体积中产生,从而降低功率消耗,提高扩散速率,大大缩短加热时间[9].
从图5的FT-IR图可看出,在3 607 cm-1、3 550 cm-1和1 627 cm-1处特征峰为O-H振动吸收,在1 151 cm-1和1 088 cm-1处吸收峰为γ3(SO4)拉伸振动,处于655 cm-1和600 cm-1的吸收峰是γ4(SO4)拉伸振动,说明产物中存在硫酸钙.在5 min时,在2 922 cm-1处出现微小的CH2伸缩振动,推断为在此条件下少量SDS附着在样品中.随着反应时间增加,处于3 607 cm-1的O-H振动吸收峰逐渐减弱,表明有利于硫酸钙晶体脱水,更容易形成HH.
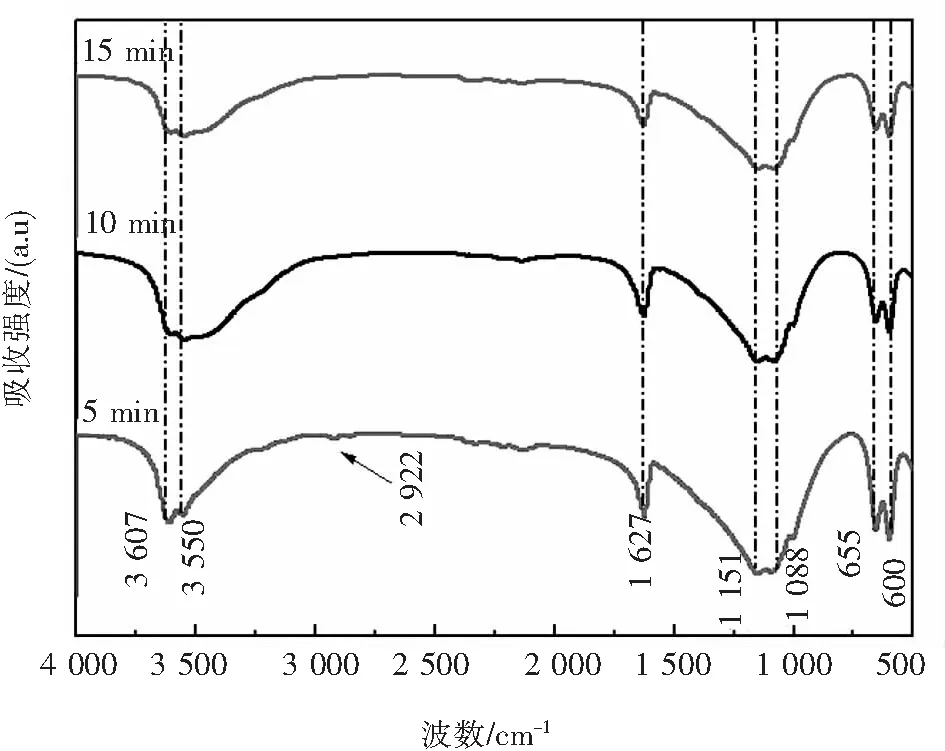
图5 在130 ℃的条件下不同反应时间的FT-IR谱图Fig.5 FT-IR spectra of samples with different reaction times at 130 ℃
2.1.3 SDS用量在微乳液中,胶束发生相互碰撞,交换反应物,然后再次分裂,在这种机制中,表面活性剂充当保护层,可以控制成核与生长,同时防止集聚.微乳液中的表面活性剂起着至关重要的作用,它们具有亲水基与疏水基,亲水基进入水相,疏水基则渗透到油相.Griffin提出亲水亲油平衡值(HLB)表征表面活性剂的亲水亲油性,HLB值较低的表面活性剂多用于油包水型微乳液,HLB值较高则用在水包油型微乳液[10].SDS作为一种常见的阴离子型表面活性剂,其HLB值可达40,较适合用于水包油型.在反应温度110 ℃、反应时间5 min、反应物浓度0.1 mol/L的条件下,探究了不同SDS用量对样品形貌的影响.
如图6(a)所示,随着SDS用量增加,硫酸钙失重率减小,产物结晶水含量接近HH理论值.SDS用量为1.25 g,与1.5 g时失重率相近;而当SDS用量增加到2 g时,微乳液较黏稠,并不能完全澄清透明,因此未采用此条件.同时,对应样品DSC曲线上350 ℃左右的放热峰逐渐增强,表明β-HH含量增多.该结果说明,在一定范围内,增加SDS用量可促进HH生成.
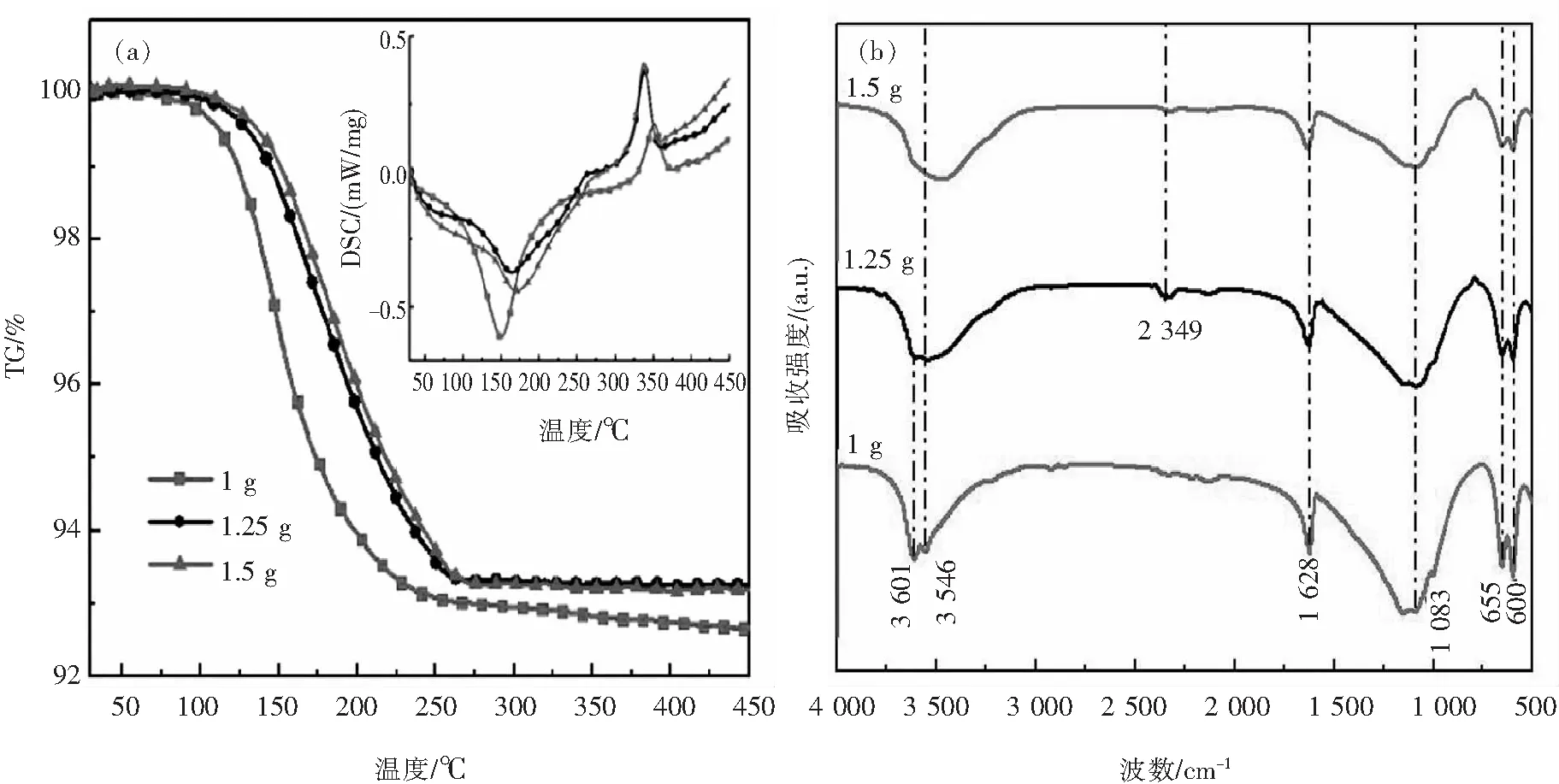
图6 不同SDS用量条件下样品热分析曲线(a)与FT-IR图(b)Fig.6 Thermal analysis curves (a) and FT-IR images (b) of samples under different SDS dosage conditions
从图6(b)的红外图中可看出,随着SDS用量增加,位于3 546 cm-1处的O-H振动峰逐渐减弱,表明SDS与硫酸钙中的水分子在晶体端面上发生相互作用.同时,SDS浓度增大,处于2 349 cm-1的SO42-振动峰则较为明显.
从图7的SEM图可看出,硫酸钙晶体尺寸较大,以长棒状为主,同时存在少量颗粒状结构,推测为DH.产物样品有黏结现象出现,可能因为微乳液较黏稠导致不能很好地清洗分离,且加热过程中未搅拌,有造成团聚的可能.随着SDS用量增加,产物尺寸逐渐增大,长径比减小,同时晶体表面较为粗糙,在端面出现不均匀的凹凸现象.但颗粒状物质有所减少,黏结现象减小,可能是因为DH逐渐消失,生成了HH.

图7 不同SDS用量条件下SEM图 (a)1 g,(b)1.25 g,(c)1.5 gFig.7 SEM images of samples under different SDS dosage conditions (a)1 g, (b)1.25 g, (c)1.5 g
2.1.4 原料浓度进一步探讨反应温度130 ℃、反应时间5 min时,不同原料浓度对合成硫酸钙形貌的影响.
在130 ℃反应温度下,改变原料浓度对样品结晶水含量几乎没有影响,都处于6%~7%之间,接近HH理论结晶水含量.从图8的DSC曲线可以看出,在350 ℃左右的放热峰随着原料浓度增大而减弱,推测当原料浓度增加时,微乳液比较黏稠,使所得产物发生团聚现象,不能均匀分散,从而导致β-HH放热峰不明显.
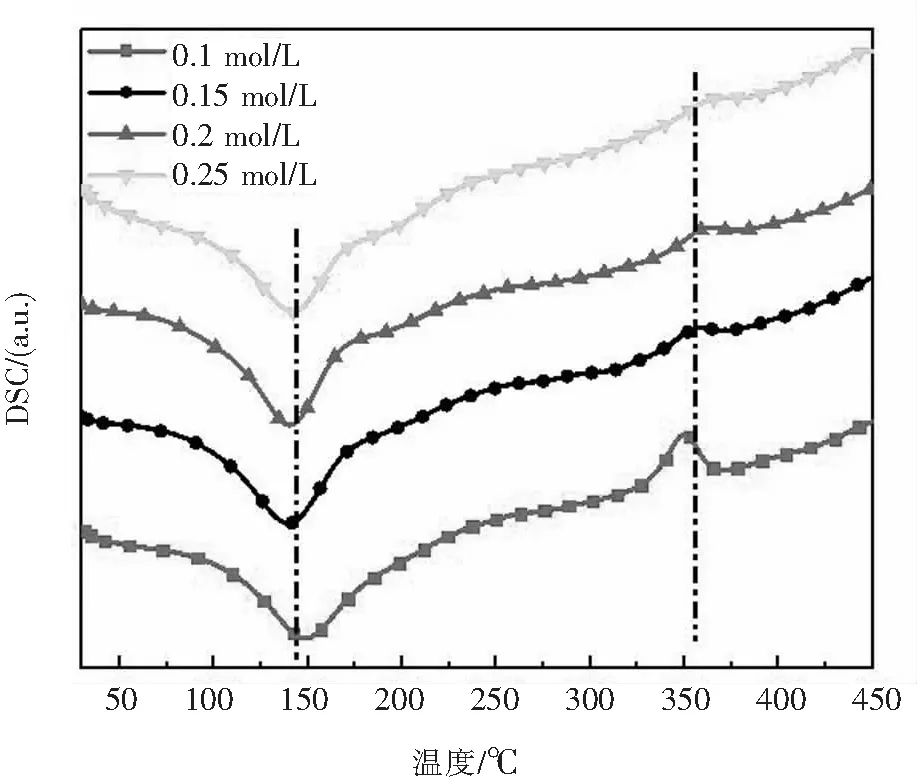
图8 不同原料浓度条件下样品热分析曲线图Fig.8 Thermal analysis curves of samples with different raw material concentrations
如图9所示,在0.1 mol/L条件下,样品形貌略为规整,长度多为30~50 μm.随着原料浓度增加,硫酸钙团聚现象与颗粒物质增多,同时长棒状硫酸钙晶体逐渐变短,端面凹凸不平现象增多,推测为原料浓度增大,微乳液黏度增加导致,这与DSC曲线分析一致.

图9 不同原料浓度条件下SEM图 (a)0.1 mol/L,(b)0.15 mol/L,(c)0.2 mol/L,(d)0.25 mol/LFig.9 SEM images of samples with different raw material concentrations (a)0.1 mol/L,(b)0.15 mol/L, (c)0.2 mol/L, (d)0.25 mol/L
2.1.5 搅拌速率对于一般反应制备硫酸钙,常常需要增加搅拌速率,影响硫酸钙在生长过程中的扩散行为,防止样品团聚.本实验所用微波仪器自带搅拌模式,分为低(约为600 r/min)、高(约为1 200 r/min)两挡.因此,在反应温度为130 ℃,反应时间为5 min、原料浓度为0.15 mol/L的条件下,通过单因素试验考察搅拌速率(无、低、高模式)对合成硫酸钙粒径形貌等影响,其结果如图10所示.

图10 不同搅拌速率条件下样品SEM图 (a)0 r/min,(b)600 r/min,(c)1 200 r/minFig.10 SEM images of samples at different stirring rates (a)0 r/min, (b)600 r/min, (c)1 200 r/min
从图10中可以看出,在600 r/min转速时比无搅拌时颗粒状物质增多,且晶粒尺寸变小.可能在有搅拌时,部分晶体未能充分生长成长棒状结构,但团聚现象减少;而在1 200 r/min时,晶体表面较为粗糙,黏结现象又增多,可能为转速过高,导致晶体结构被破坏.因此,虽然加入搅拌利于分散样品,以免团聚,但当转速过高时,则会破坏晶体结构.
2.2 β-HH形成机理分析
一般HH形成机理为,硫酸钙溶液介质达到过饱和后,晶体成核并生长.也有研究发现,Ca2+与SO42-团簇成核后生成纳米晶粒,然后自组装发展为介晶,最后融合形成单晶[11].
如图11所示,SDS是由亲水基头—SO4Na和疏水尾链—C12H25组成,亲水基头处于水相中,而疏水尾链进入油相,因此SDS的存在可以降低水和油两相共存体系间的界面张力,从而使水、油两相达到部分互溶状态.当氯化钙水溶液加入硫酸微乳液中,由于SDS主要基团带有负电荷,Ca2+会被吸附到油水界面上,而SO42-则处于水相中,两者的结合过程伴随着离子的去溶剂化过程.施加微波场时,其电磁波能量打乱了原有的静电作用致使Ca2+与SO42-结合生成DH的过程加快,同时存在一些游离的Ca2+与SO42-.由于微波对表面张力基本没有影响[12],因此在这时溶液依旧处于混溶状态.随着分子吸收微波能增多,生成的DH逐渐溶解,Ca2+与SO42-达到过饱和状态,同时微波场可增大结晶反应体系的扩散系数,增加传质速率,从而缩短团簇成核的时间.在微波辐照下,晶体成核阶段速率大于生长阶段速率,因此生成HH速率主要取决于成核速率[13].在这一过程中,由于微波场中的偶极子在分子间发生旋转、摩擦、碰撞[14],可能会影响Ca2+与SO42-团簇与晶核的重组装过程,从而抑制微晶进一步融合生成致密的HH块晶(α-HH),从而使缺陷晶体数量增加,导致生成产物为β-HH.同时,带有负电荷的SDS易吸附在Ca2+密度较大的HH微晶端面,从而限制晶体c轴方向生长,因而随着SDS用量增加,晶体长径比逐渐减小[15].此时因部分SDS附着在HH表面上,从而水油界面平衡状态被破坏,出现分层现象.
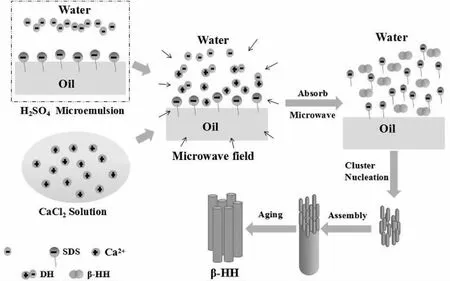
图11 β-HH形成机理示意图Fig.11 Schematic diagram of β-HH formation mechanism
3 结论
本文采用微波加热方式,在微溶液体系中制备出β-HH,并探究反应温度、反应时间、表面活性剂SDS用量、原料浓度、搅拌速率对样品相态、形貌的影响,结论如下:
(1) 当反应温度、反应时间、SDS用量增加时,可促使DH转变为β-HH,且在时间为15 min,温度为130 ℃时,样品完全转化为β-HH,相比于传统加热方式时间大大缩短,转化反应温度可降至100 ℃.
(2) 一般水热体系中所制备HH为α-HH相,本实验中所得产物为β-HH,这为制备β-HH提供一个新思路.
