稻田土壤CH4排放及其关联微生物功能基因丰度对磺胺二甲嘧啶和铜污染的响应
2021-11-09程粟裕朱长俊李昕钰董宁周金蓉蒋静艳
程粟裕,朱长俊,李昕钰,董宁,周金蓉,蒋静艳
(南京农业大学资源与环境科学学院,南京210095)
甲烷(CH4)是重要的温室气体之一,其增温潜能是二氧化碳(CO2)的28 倍,对温室效应的贡献率仅次于CO2,为20%,且在大气中滞留时间较长[1]。稻田是CH4的重要排放源之一,稻田年CH4排放量可占其总排放量的9%~19%[2]。近几十年来我国畜牧养殖模式高度集约化,畜禽养殖规模增大导致畜禽粪便增多,大量畜禽粪便就近施用于农田,促进了CH4排放[3]。
微量元素Cu、Zn、As 等作为动物饲料添加剂,可以促进畜禽生长,但其不能被动物完全吸收,不被吸收的部分随着畜禽粪便排出体外,再经施肥进入农田造成污染[4]。有报道统计分析了我国841 个农田土壤样本,发现Cu 是仅次于Zn 的第二大输入农田的重金属(84 069 t·a−1)[5],含量范围在 0.12~1 247.82 mg·kg−1[6],且南方土壤76%的Cu 来自于畜禽粪便的施用[5]。LIU 等[7]对2 300 多份猪粪样品进行统计分析,发现猪粪中 Cu 浓度介于 72.66~1 288.00 mg·kg−1,平均为531.37 mg·kg−1,且因畜禽粪便中猪粪产量最高,因此猪粪还田是农田土壤中Cu来源的主要贡献者。
规模化养殖业大量使用兽用抗生素,同重金属一样,30%~90%的抗生素并不能被畜禽代谢,而是随着畜禽粪便排出体外,经农用后进入土壤环境[8]。猪粪中磺胺二甲嘧啶(SMZ)浓度甚至可高达28.7 mg·kg−1[9]。畜禽粪便还田导致抗生素持续输入农田土壤,目前我国农田土壤中兽药抗生素的浓度介于每千克微克级到毫克级之间[10]。土壤中抗生素的存在会影响土壤微生物结构与功能,导致抗性基因大量传播,具有较大的生态毒性[11]。
土壤CH4是在极端厌氧的条件下,由土壤中产甲烷菌利用其他微生物发酵形成的低碳有机酸、H2和CO2等物质为底物转化产生[12]。土壤CH4排放是产甲烷菌和甲烷氧化菌共同作用的结果。重金属能够阻碍微生物本身的蛋白质合成以及相关酶类的生成与分泌,或者通过土壤中重金属的氧化还原过程直接抑制微生物的新陈代谢,改变微生物数量和活性[13]。抗生素对靶标微生物主要起杀死或抑制效应[14]。因此畜禽粪便施用导致的土壤中重金属和抗生素含量增多,势必会对土壤微生物活性产生影响,进而会影响到土壤CH4的排放。已有报道证实在猪粪厌氧消化过程中,添加25、50 mg·L−1四环素和磺胺甲氧二嗪可降低 CH4的产生[15];而 Cu 离子浓度为 100~300 µg·g−1时可提高CH4产量,浓度为400~600 µg·g−1时,则明显抑制CH4产量[16]。培养基培养中,随着重金属Pb2+、Cd2+和Hg2+浓度的增大,其对甲烷氧化菌生长的抑制作用增强[17];红霉素浓度越高对产甲烷菌的抑制作用越明显,产CH4速率越低[18]。近年来,国内外抗生素和重金属复合污染对农田土壤CH4排放的研究鲜见报道,已有研究多集中于对堆肥发酵过程或土壤微生物群落结构与活性的影响。如KONG 等[19]的研究表明,土霉素和重金属Cu 的复合污染对土壤微生物群落的功能多样性具有负面影响,且表现出明显的加和作用。YANG等[20]的最新研究表明,一定浓度的Cu和SMZ复合污染相比于单一污染会抑制脲酶、磷酸酶和蔗糖酶的活性,但在一定的暴露时间内却会促进二磷酸核酮糖羧化酶的活性,促进或抑制酶活作用取决于二者的剂量以及暴露时间。这说明重金属和抗生素复合污染对土壤有关酶活以及微生物群落结构与功能的影响存在一定的联合作用,与单一污染影响不同,因而对土壤CH4的排放影响也可能存在不同效果。
随着畜禽养殖业的规模化扩大,畜禽粪便大量还田,农田土壤中抗生素和重金属残留量增高,因此有必要研究两者复合污染对CH4排放及相关微生物的影响。本文以重金属Cu和磺胺类抗生素中的典型代表SMZ 作为研究对象,通过室内模拟培养试验,以未经重金属和抗生素污染的农家猪粪为肥源,分别添加不同浓度的Cu 和SMZ,探究在不同浓度Cu 和SMZ 单一及复合污染条件下CH4排放,以及与CH4产生有关的功能基因(16S rRNA−CH4和mcrA)和与CH4氧化有关的功能基因(pmoA)丰度的变化[21],首次分析了Cu和SMZ 复合污染对CH4排放及相关功能基因丰度的交互效应,以期为了解畜禽粪便还田导致的Cu 和SMZ 复合污染对CH4排放的影响及机制提供科学依据。
1 材料与方法
1.1 供试材料
供试土壤采自安徽皖南常规农田0~20 cm耕作层(118°19′E,29°59′N)。土壤pH 为5.15,有机质含量为 88.41 g·kg−1,全氮含量为 1.20 g·kg−1,Cu 含量为28.66 mg·kg−1。供试猪粪来源于未饲喂过含有重金属和抗生素添加剂饲料的农户家猪排泄物,属于有机猪粪,全氮含量为8.81 g·kg−1,全磷含量为1.84 g·kg−1,有机质含量为 720.33 g·kg−1,Cu 含量为 27.72 mg·kg−1。供试土壤和猪粪均未检测出磺胺类抗生素。
供试抗生素为上海麦克林公司生产的磺胺二甲嘧啶钠试剂(纯度≥98%),供试重金属试剂为上海阿拉丁公司生产的五水合硫酸铜试剂(纯度≥99.0%)。
1.2 试验设计
室内模拟淹水培养试验共设16 个处理,以有机猪粪为肥源,Cu 添加的浓度分别为0、100、500、1 500 mg·kg−1,SMZ 添加的浓度分别为 0、0.1、1、5 mg·kg−1,两两组合,代码分别为Cu0+SMZ0、Cu0+SMZ0.1、Cu0+SMZ1、Cu0+SMZ5、Cu100+SMZ0、Cu100+SMZ0.1、Cu100+SMZ1、Cu100+SMZ5、Cu500+SMZ0、Cu500+SMZ0.1、Cu500+SMZ1、Cu500+SMZ5、Cu1500+SMZ0、Cu1500+SMZ0.1、Cu1500+SMZ1、Cu1500+SMZ5,其中Cu0+SMZ0 即为对照(CK)。每个处理9 个重复,其中3个重复用于定期测定CH4排放,6个重复用于培养中间阶段土样微生物测定。每个处理称取150 g 干土(过10 目筛)置于590 mL 塑料瓶内,加超纯水预培养1 周,按设定浓度同步添加猪粪(按N=100 mg·kg−1干土计算,猪粪添加量为每处理干质量1.702 6 g)、Cu和SMZ 后,在恒温恒湿(25 ℃、95%水分)培养箱中进行室内模拟淹水培养。考虑到土壤和猪粪中存在Cu背景值,代表无污染(Cu0)、低(Cu100)、中(Cu500)、高(Cu1500)浓度处理实际的Cu 浓度分别为29([4.299 mg 土壤+0.047 mg 猪粪)/0.15 kg 干土)]、129、529 mg·kg−1和 1 529 mg·kg−1。因土壤和猪粪中无背景SMZ 存在,各SMZ 处理实际浓度即为设定浓度。培养试验中每个培养瓶水深约2 cm,期间土壤水分通过补加超纯水(重量法)保持,每3 d 补充1 次。气体测定频率为前25 d每日测定,之后2~3 d测定1次。在前期(5 d)、中期(39 d)和培养终期(71 d)分别采集各处理的土壤,放入−80 ℃冰箱中储存,用于测定CH4排放相关基因的基因丰度。
1.3 样品采集与测定方法
1.3.1 土壤CH4排放的测定
采用间歇密闭培养−气相色谱法测定土壤CH4排放速率。采样时培养瓶处于完全密闭环境,唯一出口用三通阀连接用于采气。在每日密闭培养开始前,使用针筒通过三通阀从培养瓶中抽取10~15 mL 气体(背景气样),密闭培养12 h 后,用同样的操作从培养瓶中抽取10~15 mL 气体(试验气样),每次采样完成,培养瓶敞口继续培养。测定仪器为配置了FID 检测器的气相色谱仪(GC7890B,安捷伦,美国)。载气为99.999%高纯氮,检测温度为250 ℃,柱箱温度为50 ℃。测得背景气样与试验气样的CH4浓度后,经过计算得出密闭培养12 h期间,培养瓶内土壤的CH4排放速率。具体计算公式为:
式中:F为气体排放速率,ng·g−1·h−1;ρ为气体密度,g·L−1;V为培养瓶内气体的有效空间,L;Δt为培养瓶密闭培养时间,h;Δc为Δt时间内培养瓶内气体浓度差,µg·g−1;W为培养瓶内土壤干质量,g;A为分子量;T为培养温度,℃。
通过3 个重复观测的数据按时间加权平均后获得CH4的排放总量,计算公式为:
式中:M为气体累计排放量,ng·g−1;N为采样次数;t为采样时间(距离第一次采样的天数),d;F为气体排放速率,ng·g−1·h−1。
1.3.2 土壤样品的测定
采用 PowerSoil®DNA Isolation kit 强力土壤 DNA提取试剂盒法提取土壤样品全基因组。使用Nano⁃Drop2000 超微量紫外分光光度计测定提取出的土壤总DNA 浓度,并将所有样品的DNA 浓度调节为10 ng· µL−1,然 后 使 用 Applied−Biosystems Real−Time PCR 仪采用实时荧光定量PCR 技术测定各功能基因丰度。PCR 扩增采用20 µL 反应体系,包括:10 µL 扩增酶混合物 SYBR Premix ExTaqTM(2×);6.8 µL ddH2O;2 µL DNA 模板;0.4 µL ROX Reference Dye(50×);0.4 µL Forward Primer(10 µmol·L−1),0.4 µL Reverse Primer(10 µmol·L−1),即正反向引物各 0.4µL。引物及相应扩增程序见表1。
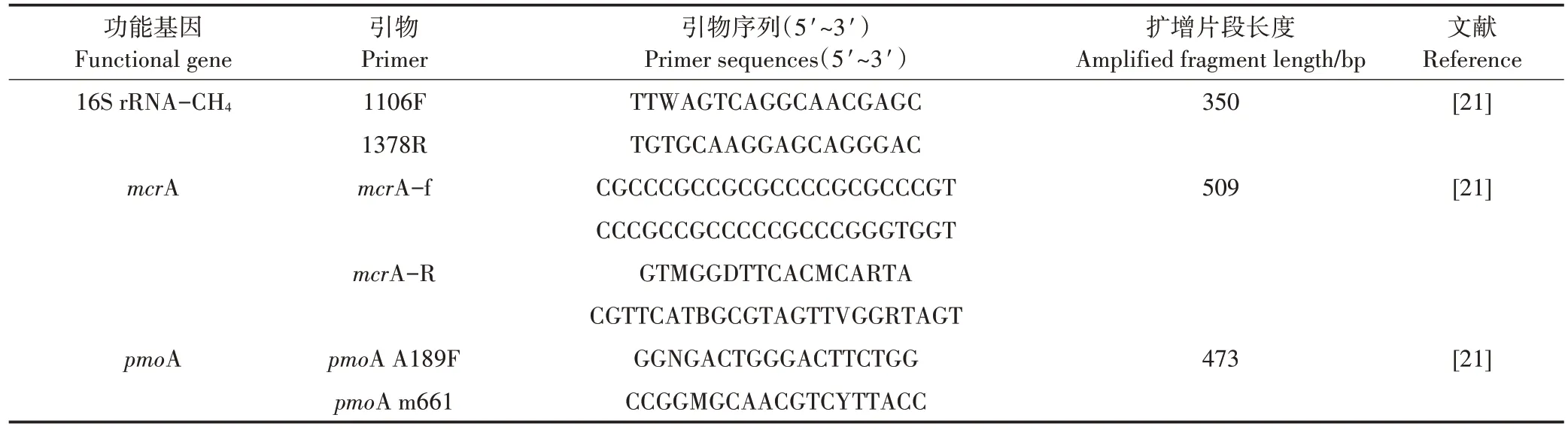
表1 目的基因的引物序列Table 1 Primer set for the target genes
1.4 数据统计与联合效应判断
采用Excel 2019 和SPSS Statistics 21.0 软件进行数据统计分析,采用Origin Pro 2021 软件作图。当二因子方差分析Cu 和SMZ 交互影响显著时,将Cu 和SMZ 的个体效应[即CH4减排率或基因丰度降低率=(1-T单/TCK)×100,T单代表 Cu 或 SMZ 单一处理]加和(M1=RCu+RSMZ,RCu和RSMZ分别代表Cu和SMZ单一处理CH4减排率或基因丰度降低率)或计算独立作用效应结果[M2=RCu+RSMZ×(1-RCu/100)]来判断复合污染处理的联合效应[Mx=(1−T复/TCK)×100,T复代表 Cu 和 SMZ复合处理)]。经t检验,若Mx与M1或M2有显著差异(P<0.05),则Mx>M1为协同作用,反之为拮抗作用;当Mx与M1或M2无显著差异(P>0.05)时,Mx≈M1为加和作用,Mx≈M2为独立作用[22]。
2 结果与分析
2.1 Cu 和SMZ 单一及复合污染对土壤CH4排放动态变化及累积排放的影响
模拟淹水状况下,各处理土壤CH4排放速率动态变化如图1 所示。从动态图可以看出,各处理CH4排放速率在培养前期动态变化趋势基本一致,培养后期出现分化,单一添加SMZ的处理CH4排放速率有升高趋势(图1a),而添加Cu 的处理则逐步降低,Cu100+SMZ0.1 处理除外(图1b~图1d)。经培养时间与处理二因子方差分析发现,培养前期(0~12 d)处理间CH4排放速率无显著差异(P>0.05),仅每次测定之间有显著差异(P<0.05)。培养后期(13~71 d),每次测定之间以及处理之间CH4排放速率皆有显著差异(P<0.05)。
进一步计算各处理CH4累积排放量及CH4减排率,并判断其联合效应,结果如图2 所示。培养前12 d 的各处理CH4累积排放量之间总体上无显著差异,总累积排放量的差异性主要取决于第13~71 d 的差异性。无Cu 添加条件下,单一SMZ 处理存在明显的低促高抑浓度效应:相对于CK,Cu0+SMZ0.1 的CH4总累积排放量增加了19.7%,而SMZ1 和SMZ5 的CH4总累积排放量分别显著减少了16.8%和40.6%(P<0.05)。无 SMZ 添加条件下,单一 Cu 处理与 CK 相比,CH4总累积排放量均显著减少了77%左右(P<0.05),且没有表现出明显的浓度效应。不同浓度SMZ 和Cu复合污染均显著降低CH4累积排放(P<0.05),但交互效应比较复杂。
SMZ和Cu的二因子方差分析结果表明(表2),二者不同浓度组合下对CH4排放有极显著的联合效应(P<0.001)。除了SMZ 和Cu 双低浓度复合污染时(Cu100+SMZ0.1)为简单的加和作用以及低浓度SMZ与中浓度的Cu(Cu500+SMZ0.1)组合时为协同作用外,其他浓度SMZ 和Cu 组合交互效果不同。随着SMZ 浓度的增加,这种交互作用变为独立作用。当SMZ浓度达到5 mg·kg−1时,无论Cu浓度的高低,皆是拮抗效应(图2)。
2.2 Cu 和SMZ 单一及复合污染对土壤CH4排放的相关功能基因丰度的影响
不同处理在培养至第5、39 d 和第71 d 的16S rRNA−CH4、mcrA 和pmoA 基因丰度变化分别如图 3~图5 所示。单因子方差分析表明,3 个培养期16 个处理间 16S rRNA−CH4、mcrA 和pmoA 基因丰度差异均极显著(P<0.01)。Cu 和SMZ 单一及复合污染对与产甲烷菌有关的16S rRNA−CH4和mcrA 基因丰度的影响规律比较类似:在培养前期(第5 d),Cu0+SMZ5、Cu100+SMZ1、Cu500+SMZ1 和 Cu1500+SMZ1 处理显著提高了此二者的丰度(P<0.05),其他处理与CK 相比均无显著差异(P>0.05)。在培养中期(第39 d),不同浓度 SMZ 单一污染对 16S rRNA−CH4和mcrA 基因丰度均无显著影响(P>0.05)。不同浓度Cu 单一污染均显著降低16S rRNA−CH4基因丰度(P<0.05),而对mcrA基因丰度无显著影响(P>0.05)。Cu和SMZ复合污 染 中 ,0.1 mg·kg−1SMZ 与 各 浓 度 Cu 组 合 以 及Cu100+SMZ1、Cu500+SMZ1 的组合均显著降低16S rRNA −CH4基因丰度(P<0.05),减少幅度为 50%~82%;除Cu500+SMZ1 显著降低mcrA 基因丰度11.7%外(P<0.05),其他复合处理对基因丰度都无显著影响。在培养后期(第71 d),中高浓度SMZ(1、5 mg·kg−1)单一污染均显著降低 16S rRNA−CH4和mcrA 基因丰度(P<0.05)。此外,中高浓度Cu 单一污染显著降低 16S rRNA−CH4基因丰度(P<0.05),无论单一Cu 浓度高低,其对mcrA 基因丰度均无显著影响(P>0.05)。复合处理中,无论Cu 浓度高低,中高浓度SMZ(1、5 mg·kg−1)以及高 Cu 低 SMZ 处理(Cu1500+SMZ0.1)均显著降低16S rRNA−CH4和mcrA 基因丰度(P<0.05)。
Cu 和SMZ 单一及复合污染对与甲烷氧化菌有关的pmoA基因丰度在不同培养阶段的影响规律比较一致,基本表现为SMZ 单一污染,在培养前中期低浓度无影响、高浓度降低,培养后期3 个SMZ 浓度均有显著影响(P<0.05);3 种Cu 浓度单一处理,无论在哪个培养阶段均显著降低pmoA基因丰度;复合处理中,除前期含低浓度 SMZ(0.1 mg·kg−1)处理组合外,其余所有处理均显著降低pmoA基因丰度(P<0.05)。
总之,SMZ单一污染对三大基因丰度有明显的浓度效应(低增或无影响、高降)和输入时间效应(前增、中无影响、后降),而Cu 单一污染对16S rRNA−CH4基因也有类似SMZ 单一污染的浓度及输入时间效应,表现为低无影响高降、前无影响后降的规律,但对mcrA 和pmoA 基因丰度无明显浓度规律。Cu 和SMZ复合污染对16S rRNA−CH4和mcrA 基因丰度影响程度更多取决于SMZ浓度的高低。相比16S rRNA−CH4和mcrA 基因丰度,pmoA 基因丰度对 Cu 和 SMZ 单一及复合污染的响应更敏感,且主要表现为降低效应。
进一步进行Cu 和SMZ 二因子方差分析,结果见表2。SMZ 和Cu 交互效应有一个明显的规律,即都是在培养的前后期对三大基因丰度有显著影响(P<0.05),培养中期均没有显著影响(P>0.05)。对于16S rRNA−CH4基因丰度(图3),培养前期不同浓度SMZ 和Cu 组合的交互效应以独立和相加作用为主,仅在SMZ浓度较高情况下(5 mg·kg−1)出现拮抗效应,但Cu1500+SMZ5 处理除外,为独立作用;培养末期中低浓度以独立作用为主,SMZ 和Cu 均为最高浓度的组合(Cu1500+SMZ5)为拮抗效应。对于mcrA 基因丰度(图4),无论培养前期还是后期,低浓度以协同和相加作用为主,中高浓度以拮抗效应为主。对于pmoA 基因丰度(图5),培养前期,除了最高浓度组合为独立作用外,其他SMZ 和Cu 组合的交互效应均是拮抗效应;在培养后期,除Cu100+SMZ5 为拮抗效应外,其他各复合污染处理均为独立作用。总之,两者复合污染的联合作用比较复杂,主要取决于两污染物的起始浓度及SMZ输入土壤的时间。
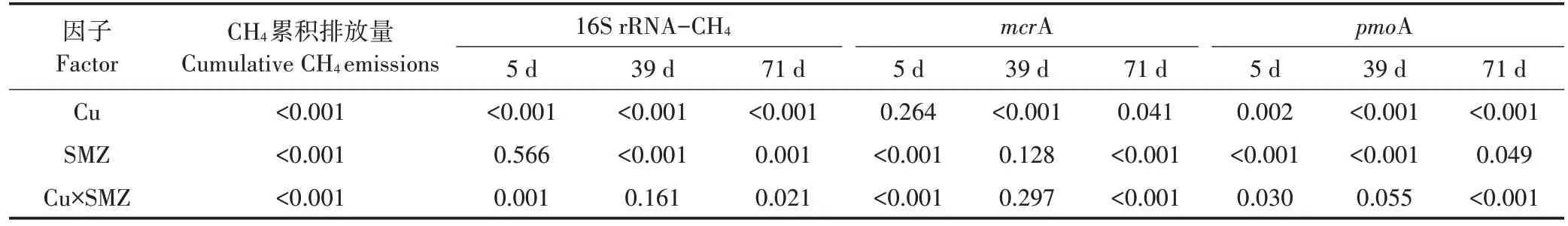
表2 CH4累积排放总量及相关功能基因丰度的SMZ和Cu处理二因子方差分析结果(P值)Table 2 Results of two−way ANOVA on cumulative CH4emissions,and the abundance of 16S rRNA−CH4,mcrA and pmoA genes in experiment with SMZ and Cu singly or in combination(P values)
经相关分析,未能发现CH4排放速率与各相关微生物功能基因丰度之间在第5 d 有显著相关关系(P>0.05),但在培养的第 39 d 和第 71 d,CH4排放速率与16S rRNA−CH4和pmoA 基因丰度的对数值皆呈显著正相关(P<0.05),仅在第39 d,CH4排放速率与mcrA基因丰度呈显著正相关(P<0.05)。
3 讨论
3.1 CH4排放对SMZ单一污染的响应及其机制
本研究供试土壤为酸性土,在SMZ 单一污染条件下,不同浓度SMZ对土壤CH4排放的影响有明显的浓度效应,存有低促高抑现象(图2),尤其反映在培养的中后期(图1),这与徐佳迎[23]在碱性土上的研究结果一致。SHI等[15]的研究也表明高浓度磺胺类抗生素(250、500 mg·kg−1)在猪粪厌氧消化中显著降低CH4累积排放。即便是含5 mg·kg−1SMZ的猪粪,在厌氧堆肥过程中也表现出对CH4排放的明显抑制效应[24]。田间原位研究结果也证实SMZ 影响CH4排放在不同的环境条件下表现不一,10、30 mg·kg−1SMZ对水稻生长季CH4排放有明显的前抑后促特征,尤其与猪粪协同作用下水稻生长中后期促进作用比较明显[25]。这种前抑后促或低促高抑现象的产生,与SMZ在土壤中的降解转化有关。田间原位试验及室内机理研究表明低浓度的SMZ 更易被土壤微生物降解转化成小分子物质,从而可作为新的碳源利用;高浓度的SMZ 通过影响土壤微生物群落结构直接或间接降低产甲烷菌活性,表现为在培养后期明显降低了16S rRNA−CH4、mcrA 和pmoA 基因丰度(图3~图5),进而减少了CH4的排放[23]。中、高浓度SMZ 进入土壤后母体去除较快,中间降解产物却种类较多,即便输入稻田土壤47 d和61 d后,依旧存有一环或二环类中间产物,其中以2−氨基−4,6 二甲基嘧啶和4−(2−亚氨基−4,6−二甲基嘧啶−1(2H)−基)苯胺为主[26]。而SMZ 的降解产物本身如2−氨基−4,6−二甲基嘧啶也能促进CH4排放,这是SMZ影响CH4排放前抑后促的原因[23]。
3.2 CH4排放对Cu单一污染的响应及其机制
在本研究Cu 单一污染浓度条件下,各Cu 处理均显著降低了CH4的排放(图2),主要反映在培养的中后期,减排尤其明显,甚至出现负值(图1),这可能是因为本研究中Cu 的浓度较高,导致土壤中微生物活性降低的缘故,反映在本研究结果中就是培养中后期中高浓度明显降低了16S rRNA−CH4和pmoA 基因丰度(P<0.05)(图3 和图5),浓度越高,降低程度越大;但对mcrA基因丰度的影响不明显(图4),也不存在浓度效应。MISHRA 等[27]在室内培养研究中也发现,即便是低浓度的Cu2+(20µg·g−1)添加(以CuCl2形式)也会对3 种不同水稻土CH4的产生有抑制作用,然而也有报道证实低浓度的Cu2(+<10 mg·L−1)可以促进畜禽废水厌氧消化过程中产CH4速率[28]。最近的报道发现,添加26µmol·L−1Cu2(+以CuSO4形式)在较短的培养周期(96 h)内促进了湿地土壤(背景值Cu2+为37.8 mg·kg−1)CH4的排放,对mcrA 基因丰度的影响不显著(P>0.05)[29],与本研究条件下,无论Cu 浓度高低均未显著影响mcrA基因丰度的结果一致。XU等[30]将Cu2+以CuSO4形式添加至农田土壤(Cu2+背景值为20.15 mg·kg−1),在 40% 最大田间持水量条件下培养 28 d 的研究发现,低浓度Cu2(+20 mg·kg−1)仅在培养前期(0~14 d)降低了土壤微生物的活性,而在培养后期显著增加了土壤微生物的活性(P<0.05),高浓度(200 mg·kg−1)的Cu2+在整个培养周期均显著降低了土壤微生物的活性(P<0.05)。MOHANTY 等[31]同样在室内培养中发现,添加较低浓度的 Cu(25 mg·kg−1)仅在土壤60%田间持水量条件下显著促进了水稻土的甲烷氧化菌活性,而在淹水条件下却是轻微的抑制作用。重金属抑制CH4氧化的浓度效应与土壤中的氧气含量有关[32],进一步说明Cu 的生物有效性或毒理效应取决于土壤环境状况,如水分、pH 等,对土壤微生物活性以及CH4产生也存在低促或无影响以及高抑现象。低浓度Cu 对土壤CH4产生的影响不显著可能是土壤有机质对Cu 有吸附及固定作用,以及Cu 本身可作为土壤酶活性位点之一的缘故[33]。目前关于重金属影响土壤微生物及土壤碳转化的结果通常基于室内模拟研究以及重金属添加后的短期效应,尤其是已有研究通常是人为模拟添加CuSO4或CuCl2化学试剂进行污染条件的设定,高硫或高氯离子的存在对碳氮转化的影响尚没有定论,这也是目前室内毒理效应结果不能够外推到田间实际污染情况下的主要原因之一[34]。如何确定田间重金属逐步积累污染条件下碳的转化变化以及不同重金属对CH4排放的影响,进而判定畜禽粪便中重金属的输入在土壤中的风险值是今后进一步研究的方向。
3.3 Cu 和SMZ 复合污染对CH4排放的影响及其交互效应
Cu 和SMZ 分属于无机物和有机物,二者进入土壤后会有何反应,尚不清楚。MOREL 等[35]曾报道过当土壤pH=6 时Cu2+的存在会使土壤中磺胺甲恶唑(SMX)的吸附作用强烈增加(增加了6 倍),这一发现有力地支持了酸性土壤中可能会形成三元SMX−Cu−土壤复合物的假设。SMZ 与SMX 同属于磺胺类药物,结构相似,只是基团不同,其是否也能够在酸性环境中与Cu 形成新的螯合物,尚需进一步研究。但本研究证实,不同浓度SMZ 和Cu 复合污染对CH4排放以及相关产甲烷菌的功能基因丰度在培养前后期都有显著的交互效应(表2),尤其培养后期浓度较高时,拮抗效应越强(图2~图5),这可能与形成新的螯合物有关。也可能是因为SMZ 在土壤环境中更易被降解,而Cu 在土壤中具有更高的持久性。有报道证实施用猪粪6个月后,土壤中Cu各形态含量较1个月时无明显变化[36]。本研究仅分析了SMZ 和Cu 复合污染对整个培养周期CH4累积排放的交互效应,因不同培养期SMZ 在土壤中的降解情况不同,可能SMZ 和Cu 复合污染的交互效应也不相同。刘爱菊等[37]的研究也表明不同浓度磺胺甲基嘧啶(0、5、25、50、100 mg·kg−1)与Cu(0、100、500 mg·kg−1)复合污染处理下,低剂量 Cu(100 mg·kg−1)的协同污染对土壤微生物呼吸,土壤微生物量碳、氮以及土壤脲酶等指标的活性均明显增加,而 Cu 为 500 mg·kg−1时与磺胺甲基嘧啶对土壤各微生物指标则基本表现为协同抑制作用。YANG 等[20]发现,同一浓度 Cu(1.6 mmol·kg−1Cu2+)和不同浓度的 SMZ(0、0.05、0.2、0.8 mmol·kg−1)复合污染对土壤酶活性的交互影响并不是一种单一的相加效果,不同组合比以及不同培养周期对不同酶活性的影响都不相同。对于蔗糖酶活性,低浓度SMZ 和Cu复合污染时为拮抗作用,随着SMZ 浓度的增加,这种拮抗作用变为协同作用。在SMZ 和Cu 摩尔比为1∶32 时(0.05 mmol·kg−1SMZ+1.6 mmol·kg−1Cu),Cu 和SMZ 复合污染在培养7、14、21、28 d 中对脲酶均有协同作用,随着SMZ 浓度的增加,拮抗作用逐渐显现出来。对于磷酸酶则是在第7 d和第14 d观察到协同作用,在第21 d 和第28 d 时有拮抗作用。对于RubisCO酶的活性,不同浓度SMZ 和Cu 复合污染在不同培养周期均为协同作用。这说明磺胺类抗生素和Cu复合污染对土壤微生物结构与功能以及土壤酶活性的影响比单一污染结果复杂,对CH4排放的影响机制尚需进一步研究。规模化养殖业产生的大量非有机畜禽粪便还田使得土壤中抗生素和重金属浓度均较高[7,11],土壤抗生素和重金属的引入不容忽视,本研究结果虽然明确了在此浓度范围的SMZ和Cu复合污染降低了CH4排放,但在实际情况下畜禽粪便还田后的环境效应或风险评价尚需通过田间长期定位试验来进一步判定。
4 结论
(1)单一SMZ 污染对土壤CH4排放及三大关联基因 16S rRNA−CH4、mcrA 和pmoA 基因丰度具有明显的低增或无影响、高降的浓度效应及前增或无影响、后降的输入时间效应。
(2)单一Cu 污染除了对16S rRNA−CH4基因丰度有类似SMZ的浓度和输入时间效应外,对CH4排放及其他两基因丰度均未表现出明显的浓度与时间效应。
(3)SMZ 和 Cu 复合污染对土壤 CH4排放及相关基因丰度作用的联合效应取决于两污染物的起始浓度与输入时间。
(4)三大关联基因中,pmoA 基因丰度对Cu 和SMZ单一及复合污染响应更敏感,且主要表现为降低效应。
