胎盘植入孕妇产后出血的磁共振特征
2021-11-09吴秀丽周荣真郑珂林敏洁王冬女
吴秀丽,周荣真,郑珂,林敏洁,王冬女
温州医科大学附属台州医院 放射科,浙江 台州 317000
胎盘植入疾病(placenta accreta spectrum, PAS)是指胎盘对子宫肌层的异常黏附和侵袭。根据胎盘植入深度分为粘连型胎盘植入(placenta accreta, PA)、植入型胎盘植入(placenta increta, PI)和穿透型胎盘植入(placenta percreta, PP)[1]。PAS可造成难治性产后出血、子宫切除、孕产妇死亡等不良结局[2]。PAS的临床结局与胎盘植入深度和宫旁侵及范围直接相关,入侵越深,手术风险越大,出现产后出血及泌尿系统损伤等并发症的可能性越高[3]。临床上PI和PP均有产后出血及子宫切除的风险,极为凶险,而PA对应的风险虽然较低[2],但仍有部分PA患者发生产后出血。目前关于PAS分型的MRI特征研究较多,并显示出较好的诊断效能[4-5], 但鲜有关于PAS患者MRI特征与产后出血相关性的临床研究。本研究回顾性分析PAS患者发生产后出血的产前胎盘MRI特征,以便于对高危人群进行风险评估以及为产前、围产期及时准确的诊断与早期干预提供依据。
1 对象和方法
1.1 对象 回顾性收集2016年9月至2021年3月在温州医科大学附属台州医院行胎盘MRI检查并分娩的PAS患者105例(所有患者均为单胎妊娠,均行剖宫产术,产前均无凝血功能障碍),排除MRI图像质量不佳(伪影较大)5例,共100例患者纳入研究。本研究经医院伦理委员会批准。
产后出血诊断标准为剖宫产术分娩者失血量≥1 000 mL[6],本研究将37例出血量≥1 000 mL的PAS患者作为观察组,63例出血量<1 000 mL的PAS患者作为对照组。本研究两组患者年龄、流产次数、产前阴道流血、凝血功能(PT、INR、APTT)差异均无统计学意义(P>0.05),观察组剖宫产次数高于对照组(P<0.05)。观察组中PA患者8例(占21.6%),PI患者15例(占40.5%),PP患者14例(占37.8%);对照组中PA患者43例(占68.3%),PI患者20例(占31.7%),无PP患者。
1.2 诊断标准[1]根据术中所见,胎盘绒毛直接与子宫肌层表面接触并未侵入肌层为PA;胎盘绒毛侵入子宫肌层为PI;胎盘绒毛穿透子宫壁达子宫浆膜层,甚至侵入子宫毗邻器官时为PP。凶险性前置胎盘定义为有剖宫产史,此次妊娠为前置胎盘,胎盘附着于原手术瘢痕部位,伴或不伴胎盘植入[7]。
1.3 剖宫产出血量评估方法 负压瓶采集法;出现休克则根据休克指数及急诊血常规推算,失血性休克诊断依据妇产科学(第8版)[8];若因产前预估可能出现产后大出血而准备了自体血回输,则根据吸取量直接估计。
1.4 MRI检查方法 采用GE Signa 1.5T磁共振扫描仪,以体线圈及腹部相控阵线圈分别作为发射线圈和接收线圈,患者取仰卧位,适度充盈膀胱。扫描范围耻骨联合到宫底部,扫描体位为轴位、冠状位、矢状位。扫描方法及参数如下:二维真实稳态进动快速成像(fast imaging employing steadystate acquisition, FIESTA)序列:TR 3.8~ 5.0 ms,TE 1.5~1.8 ms,矩阵256×256,FOV 34 cm,反转角10°,层厚4 mm,层间距1 mm。矢状位加扫脂肪抑制序列。单次激发快速自旋回波(single-shot foust spin echo, SSFSE)序列:TR 1 800 ms,TE 80 ms,矩阵256×256,FOV 34 cm, 反转角20°,层厚4 mm,层间距1 mm。T1WI:TR 100 ms,TE 4.6 ms,矩阵256×256,FOV 34 cm,反转角20°,层厚4 mm,层间距1 mm。矢状位弥散加权成像(diffusion weighted imaging, DWI)序列:TR 3 500,TE最小值,矩阵256×256,FOV 34 cm,反转角10°,层厚5 mm,层间距1 mm,b=700(S/mm)。
1.5 图像分析 由2名具有10年以上妇产科MRI诊断经验的放射科医师,在不知晓手术结果及分型的情况下,通过PACS系统共同阅片,达成一致意见。评价胎盘植入MRI的征象参照腹部放射学会(SAR)和欧洲泌尿生殖放射学会(ESUR)在MRI诊断胎盘植入的联合共识[9],包括T2W胎盘内低信号带、胎盘/子宫膨出、T2W胎盘后低信号线消失、子宫肌层变薄、膀胱壁中断、局部外生团块、胎盘床异生血管、前置胎盘、凶险性前置胎盘。记录各征象检出率。见图1。

图1 部分PAS患者的MRI图像
1.6 统计学处理方法 采用SPSS20.0进行统汁学分析。计数资料的组间比较采用χ2检验或Fisher精确检验;符合正态分布的计量资料比较采用t检验,不符合正态分布的计量资料比较采用秩和检验;Logistic回归分析独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者MRI特征比较 观察组MRI征象中T2W胎盘内低信号带、胎盘/子宫膨出、T2W胎盘后低信号线消失、膀胱壁中断、局部外生团块、胎盘床异生血管、完全性前置胎盘、凶险性前置胎盘检出率高于对照组,差异均有统计学意义(P<0.05),见表1。
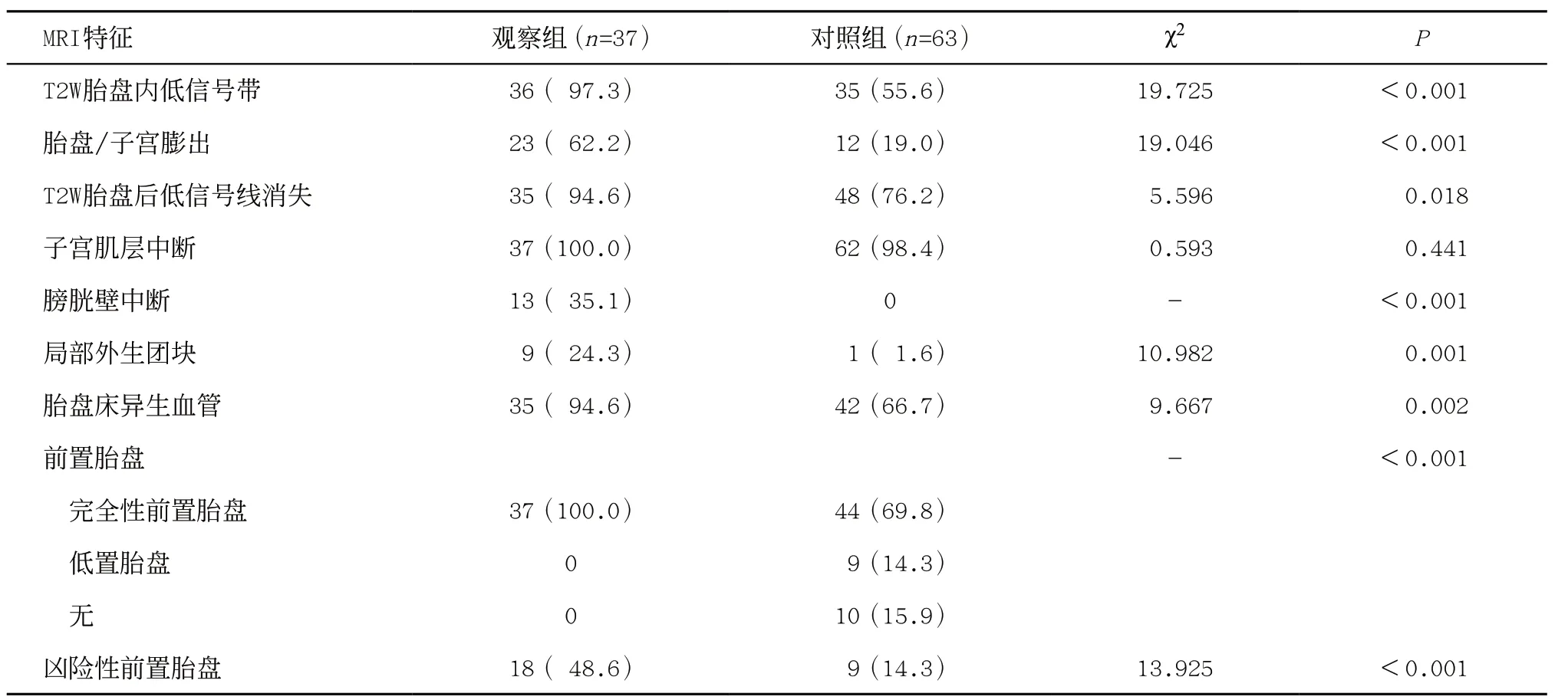
表1 观察组与对照组MRI特征检出率比较[例(%)]
2.2 二元Logistic回归分析 将单因素分析中有统计学差异的8个MRI征象作为自变量进行赋值(均按有、无对应1、0),PAS患者是否发生大量出血作为因变量,经二元Logistic回归分析,T2W胎盘内低信号带、凶险性前置胎盘是PAS患者发生产后出血的独立危险因素(P<0.05),见表2。

表2 MRI特征Logistic回归分析结果
3 讨论
近年来,随着剖宫产率的增加及二孩政策的开放,再次妊娠导致前置胎盘及胎盘植入的发生风险增加,此两者可导致术中大出血等不良临床结局。目前,超声检查是产前筛查的主要手段,MRI作为超声检查的有效补充,可以更客观地显示植入深度及周围的血运情况[2],为临床个体化诊疗方案的制定提供参考依据。
相关文献报道,胎盘植入以及完全性前置胎盘、凶险性前置胎盘是产后出血的独立危险因 素[10-11]。因此本研究参照SAR和ESUR在MRI诊断胎盘植入的联合共识推荐的7个MRI征象[9]联合胎盘位置特点对PAS患者MRI图像进行回顾性分析,结果表明除子宫肌层变薄之外的8个MRI特征均有统计学差异,这与PIZZI等[12]研究结果相类似。本研究进而对有统计学差异的8个MRI特征进行二元Logistic回归分析,发现凶险性前置胎盘和T2W胎盘内低信号带是PAS患者产后出血的独立危险因素,并没有发现其他MRI征象对产后出血的影响,原因有待进一步探讨。
凶险性前置胎盘的胎盘附着于子宫瘢痕部位,其最主要的并发症是产后出血[10,13]。本研究Logistic回归分析显示凶险性前置胎盘是引起PAS患者出现产后出血的独立危险因素。原因在于凶险性前置胎盘附着于子宫下段瘢痕部位,与子宫动脉紧邻,宫旁血管密集,局部肌层菲薄,收缩力较差,致使胎盘剥离后血窦不易闭合,尤其是并发胎盘植入时,胎盘不剥离或剥离不全,出血更汹涌[10]。
本研究Logistic回归分析显示T2W胎盘内低信号带是PAS患者产后出血的独立危险因素,这与国内外研究[4,12,14]结果相似。正常胎盘组织在T2WI序列上信号较均匀,CHEN等[14]研究认为T2W胎盘内低信号带与PAS患者术中失血和子宫切除有关,是PAS孕妇预后不良的重要预测指标。T2W胎盘内低信号带的病理基础是胎盘内反复出血或胎盘梗死所导致的纤维蛋白沉积[14],推测其发生的原因是胎盘植入部位的子宫肌层代替了正常胎盘膜组织,导致绒毛间隙液体的异常流动及出血,大量的绒毛间出血进而压迫和梗塞邻近的绒毛组织[15]。
PP是PAS中植入程度最深、临床最凶险的类型,本研究中14例PP均出现了产后出血。PP胎盘绒毛常侵及子宫全层,甚至子宫外器官或组织。较常侵袭的部位是膀胱,在子宫膀胱分界面出现大量增生的新生血管,增生血管管腔大、壁薄,血流量丰富,呈现动脉静脉化特点[16]。膀胱壁中断及局部外生团块是PP较具特异性的征象,代表胎盘植入膀胱或子宫外组织。本研究中膀胱壁中断仅出现在观察组(13例/13例);8例局部外生团块出现在观察组(8例/9例),1例局部外生团块出现在对照组的PAS分型为PI,回顾性分析认为子宫/胎盘隆起引起局部子宫壁菲薄从而导致征象误判。本研究中PA较少出现产后出血,而PI在观察组和对照组中占比分别为40.5%、31.7%,组间差异无统计学意义,因此应充分重视产前影像学检查,尽可能精准诊断PAS分型,识别出可能出现产后大出血的MRI征象。
本组病例分析具有一定的局限性,由于研究样本量较小,未能建立产后出血预测模型。尽管如此,本研究发现凶险性前置胎盘、T2W胎盘内低信号带是PAS患者产后出血的独立危险因素,膀胱壁中断及局部外生团块高度提示PP及产后出血可能,因此,在临床工作中发现这类MRI征象,应引起重视,建立多学科团队协作及充分的术前准备,从而减少产后出血及其他不良结局的发生。
