成纤维细胞生长因子21参与调控非诺贝特对肝脏脂质代谢的改善作用
2021-11-09李丹谢伟于宁郁琼丽施亚茹张颖超林灼锋
李丹,谢伟,于宁,郁琼丽,施亚茹,张颖超,林灼锋
温州医科大学 药学院,浙江 温州 325035
非诺贝特(fenofibrate, FF)是治疗高脂血症的常用药物,主要通过抑制低密度脂蛋白(low density lipoprotein, LDL)、极低密度脂蛋白(very low density lipoprotein, VLDL)和甘油三脂(triglyceride, TG)表达,提高高密度脂蛋白(high-density lipoprotein, HDL)水平发挥降脂作 用[1-2]。早期研究发现,FF能够激活过氧物酶体增殖物激动受体α(peroxisome proliferatoractivated receptor-α, PPARα),并促进其下游脂蛋白脂肪酶相关基因的表达[3-5]。
成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)是一种主要由肝脏表达分泌的代谢激素,具有调节葡萄糖和脂质稳态以及胰岛素敏感性的多效性[6]。FGF21已被证明可以通过调控肝脏脂质代谢来调节小鼠机体脂质稳态[7-9]。FGF21在禁食期间被报道为PPARα多效性作用的介导者[10], VERNIA等[11]阐明了机体肝脏FGF21和PPARα的表达相关性,并证明了PPARα通过激活JNK信号通路刺激FGF21的表达。然而,FF是否通过FGF21调控肝脏脂质代谢,仍有待于进一步探究。
本研究选取FGF21基因缺失小鼠及同窝野生型小鼠进行高脂饮食(high-fat diet, HFD)喂养诱导其形成肥胖小鼠模型,观察FF改善肥胖小鼠机体脂质代谢的作用,探讨FGF21基因是否介导FF改善肥胖小鼠肝脏脂质代谢。
1 材料和方法
1.1 材料
1.1.1 动物:8周龄SPF级雄性C57BL/6J FGF21基因缺失(FGF21 KO)小鼠及C57BL/6J WT小鼠由香港大学李嘉诚医学院实验中心提供,饲养于温州医科大学SPF级实验动物中心,室温维持在21~23 ℃,湿度40%~60%,12 h/12 h自然光交替照明,自由饮水饮食。
1.1.2 试剂与仪器:高脂饲料购于美国Open Source Diets公司;HE染色相关试剂购于北京索莱宝有限公司;FF及油红染色相关试剂购于德国Sigma-Aldrich公司;TRIzol购于大连Takara公司,反转录试剂盒购于美国Invitrogen公司,One-Step RT-PCR试剂盒购于美国Thermo Scientific公司;FGF21及脂联素(Adiponectin)ELISA试剂盒购于美国ImmunoDiagnostics Limited公司;TG和总胆固醇(total cholesterol, TC)检测试剂盒购于美国Invitrogen公司。定量PCR仪购于美国Bio-Rad公司;荧光正置显微镜购于德国Leica公司。
1.2 方法
1.2.1 小鼠的分组及处理:取FGF21基因缺失 (FGF21 KO)小鼠及同窝C57BL/6J野生型(WT)小鼠各10只,随机分为4组,分别为:野生型对照组(WT+HFD+CTL组)、野生型FF治疗组(WT+HFD+FF组)、FGF21基因敲除对照组(FGF21 KO+HFD+CTL组)、FGF21 基因敲除FF治疗组(FGF21 KO+HFD+FF组)。给予4组小鼠HFD喂养4周,同时治疗组以FF(150 mg/kg) 灌胃处理,对照组以相同体积的注射用水灌胃处理。4周后,处死小鼠,收集小鼠血清样本、肝脏、皮下脂肪等组织用于后续实验。
1.2.2 HE染色观察肝脏组织形态学变化:肝脏组织样本取出后,使用4%多聚甲醛进行固定,经过脱水、透明、浸蜡、包埋等操作后,切取5 μm厚的肝脏组织切片,制备成石蜡切片。切片干燥后,经脱蜡、乙醇梯度水化,通过HE染色,最后使用中性树脂封片,镜下观察肝脏组织的形态学变化。
1.2.3 油红O染色观察肝脏组织脂质堆积情况:肝脏组织样本取出后,使用4%多聚甲醛进行固定,OCT包埋,切取5 μm厚的肝脏组织冰冻切片。将切片放入预冷的80%丙酮中固定10 min;晾干后用纯化水洗涤3次;切片滴加油红O工作液染色6 min;纯化水漂洗,依次置入60%异丙醇溶液I、II中各洗脱3 min;再次使用纯化水漂洗;水性封片剂封片、镜检。
1.2.4 ELISA法检测FGF21的水平:取小鼠血清稀释2倍,根据厂家提供的说明书,采用定量夹心ELISA法,于450 nm处检测样品吸光度值,根据标准曲线计算样本浓度。
1.2.5 ELISA法检测Adiponectin的水平:取小鼠血清稀释400倍,按照厂家提供的说明书,于450 nm 处检测样品吸光度值,根据标准曲线计算样本浓度。
1.2.6 qRT-PCR检测目的基因表达:使用TRIzol试剂提取肝脏及皮下脂肪组织中的RNA,超微量分光光度计检测组织RNA含量。根据RNA反转录试剂说明书将其反转录为cDNA。设计小鼠PPARα、FGF21、胆固醇调节元件结合蛋白Srebp-2、乙酰辅酶A羧化酶α(acetyl coenzyme A carboxylase alpha, Acaca)、乙酰辅酶A羧化酶β(acetyl coenzyme A carboxylase beta, Acacb)、腺苷三磷酸结合盒转运体G亚家族成员5(ATP-binding cassette transporter subfamily G member 5, ABCG5)、ABCG8、胆固醇7α-羟化酶(cholesterol 7 alphahydroxylase, Cyp7a1)、PPARγ、Adiponectin的mRNA特异性引物,以GAPDH为内参(由美国Thermo Fisher Scientific公司设计合成,见表1),进行PCR扩增,扩增体系为:5 μL 2×SYBR Green荧光定量试剂、1 μL引物(上、下游各0.5 μL)、3 μL反应缓冲液,以及1 μL待测样品cDNA。PCR反应体系为:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 15 s, 72 ℃ 20 s,反复40个循环。
1.3 统计学处理方法 采用GraphPad Prism 8.0软件进行统计学分析。所有实验数据均采用±s表示,多组比较采用单因素方差分析,组间两两比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 FF对HFD喂养的WT小鼠和FGF21 KO小鼠机体组分的影响 结果表明,无论是WT小鼠还是FGF21 KO小鼠,在HFD饲养基础上使用FF治疗均能显著抑制HFD引发的小鼠体质量增加,同时显著增加小鼠的肝脏、肾脏比重,但小鼠的皮下脂肪、肾周脂肪、附睾脂肪比重显著降低(P<0.05)。此外,FF给药可明显降低WT小鼠的棕色脂肪比重(P<0.01),而对FGF21 KO小鼠的棕色脂肪比重无影响(P>0.05)。见表2。
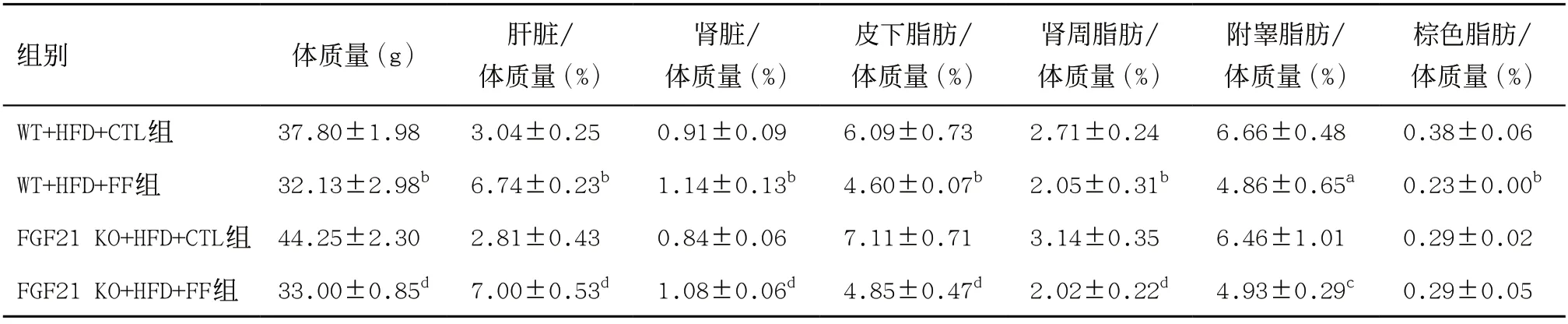
表2 FF对高脂饮食的WT小鼠和FGF21 KO小鼠机体组分的影响(每组n=5)
2.2 FF对HFD喂养小鼠体内PPARα和FGF21水平的影响 qRT-PCR结果显示,在HFD喂养条件下,与对照组相比,FF处理显著上调WT小鼠肝脏组织的PPARα及FGF21 mRNA水平,差异有统计学意义(P<0.05);在FGF21 KO小鼠中,FF诱发的该效应在一定程度上减弱,见图1。此外,FF处理刺激WT小鼠血清FGF21水平显著上调(P<0.05),见图2。

图1 各组小鼠肝脏组织PPARα和FGF21的mRNA表达水平
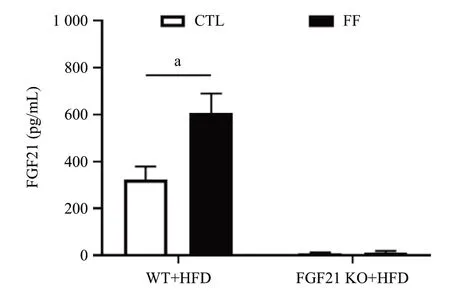
图2 各组小鼠血清中FGF21含量
2.3 敲除FGF21减弱FF对HFD喂养小鼠血脂的改善作用 在HFD喂养条件下,FF给药明显降低WT小鼠和FGF21 KO小鼠的血清TG水平(P<0.05),然而FGF21 KO小鼠的TG下降幅度明显小于WT小鼠,差异有统计学意义(P<0.05)。此外,FF给药明显下调HFD喂养的WT小鼠血清TC含量(P<0.05),而FF引发的降低血清TC的作用在FGF21基因缺失后被完全抑制,见图3。
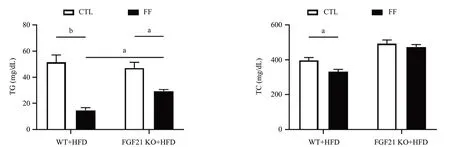
图3 各组小鼠血清TG和TC的含量
2.4 敲除FGF21减弱FF改善HFD喂养小鼠肝脏脂质沉积的作用 组织形态学HE染色结果显示,HFD饲养4周后,对照组WT小鼠的肝脏组织均出现圆形中空的空泡。与对照组WT小鼠相比,在FF给药4周后,肝脏组织的空泡数量明显减少,肝细胞排列整齐;然而在FGF21 KO小鼠中,FF给药处理后仍然可见较多的大空泡,见图4。与组织形态学HE染色结果染色一致,油红O染色结果显示,HFD饲养4周后,对照组小鼠的肝脏组织出现不同密度的红色脂滴;与对照组WT小鼠相比,在FF处理4周后,小鼠肝脏中的脂滴数量明显减少;但FGF21 KO小鼠经FF处理后,小鼠肝脏组织的脂滴数量则无明显变化。见图5。
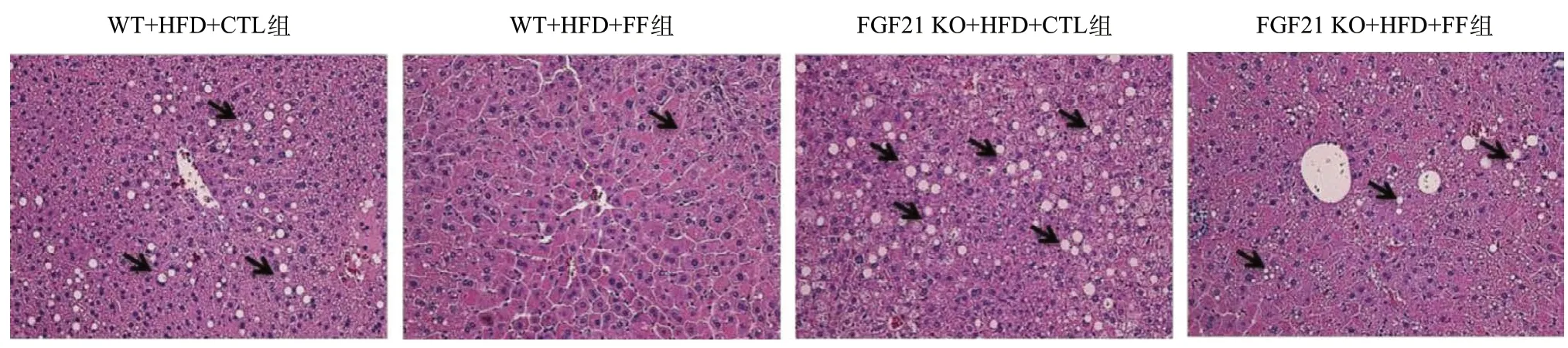
图4 HE染色评价肝组织形态学改变(箭头所示为肝组织空泡,×200)
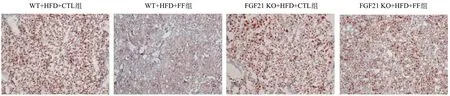
图5 油红染色评价肝组织脂质堆积情况(×200)
2.5 敲除FGF21减弱FF加速肝脏脂质代谢调节基因表达的作用 与HFD喂养的WT小鼠相比,给予FF治疗4周后,小鼠肝脏脂肪酸合成基因Acaca的mRNA表达水平无明显变化,见图6A。而小鼠肝脏Acacb的表达则明显增加(P<0.01);然而在FGF21基因敲除后,Acaca的表达无明显变化,而FF处理引发的Acacb上调幅度在一定程度被减弱,见图6B。
在肝脏脂质转运调控方面,与HFD喂养的WT小鼠相比,FF处理4周后,小鼠肝脏组织中胆固醇转运调控因子ABCG5和ABCG8的mRNA表达水平显著增加(P<0.05);然而在FGF21 KO小鼠中,FF对小鼠肝脏组织ABCG8的表达无明显影响,但FF诱导的ABCG5表达增加现象在FGF21基因敲除后被显著抑制(P<0.01),见图6C、图6D。
在胆固醇合成及分解代谢方面,给予FF处理后,Srebp-2 mRNA表达水平明显下降(P<0.05);而参与胆汁酸代谢和分泌的关键基因Cyp7a1 mRNA表达则明显增加(P<0.05);然而在FGF21基因缺失后,FF引发的肝脏Srebp-2和Cyp7a1的表达变化幅度被明显抑制(P<0.01、P<0.05)。见图6E、图6F。

图6 qRT-PCR检测各组小鼠肝脏组织中Acaca、Acacb、ABCG5、ABCG8、Srebp2、Cyp7a1的mRNA水平
2.6 敲除FGF21显著抑制FF诱导的PPARγ和 Adiponectin表达上调 qRT-PCR结果显示,在HFD喂养条件下,FF给药明显上调WT小鼠皮下脂肪组织的PPARγ及Adiponectin mRNA水平(P<0.05),同时也显著增加小鼠血清的Adiponectin循环水平(P<0.01)。然而FGF21基因敲除后,FF处理引发的肝脏PPARγ和Adiponectin上调幅度均被显著抑制(P<0.05),血清Adiponectin上调幅度也被显著抑制(P<0.05)。见图7。
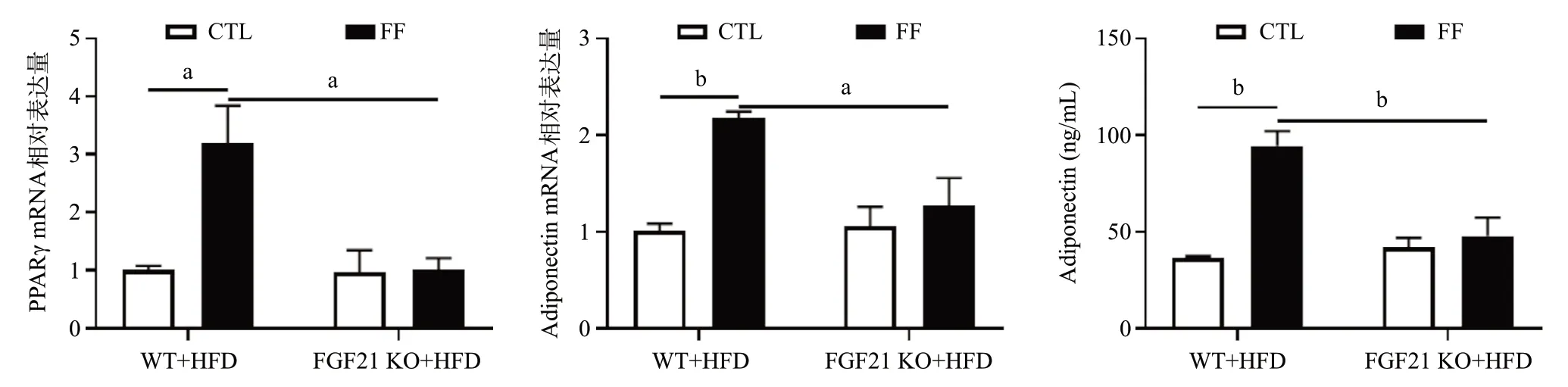
图7 qRT-PCR检测各组小鼠皮下脂肪组织中PPARγ、Adiponectin mRNA水平及ELISA检测各组小鼠血清中Adiponectin的变化
3 讨论
FGF21是一种应激诱导激素,通过FGF受体1(FGFR1)和β-klotho构成的异二聚体受体复合物,在调节能量平衡和糖脂稳态方面发挥重要作用[12-14]。 作为FGFs家族非典型成员,FGF21能够通过自分泌作用对肝脏组织进行脂质代谢调节[15-16]。既往研究表明给啮齿动物或非人灵长类动物服用FGF21可减轻与肥胖有关的代谢并发症,比如减少脂肪量、缓解高血糖、改善胰岛素抵抗[17-18],减轻血脂异常、心血管疾病和非酒精性脂肪性肝炎的病变情 况[17]。
FF是一种纤维酸衍生物,用于治疗对非药物治疗无反应的患者的严重高甘油三酯血症和混合性脂代谢紊乱,改善血脂异常患者的血脂水平(特别是TG和HDL水平)[11,19],FF通过激活PPARα发挥调脂作用[20-21]。有研究发现,FGF21通过改善小鼠白色脂肪组织功能障碍,对FF介导的肥胖小鼠全身葡萄糖代谢的改善起重要作用[22]。然而FF与FGF21在调节脂质代谢方面的相关性研究少有报道,FGF21是否介导FF发挥其改善肝脏脂质代谢的作用有待于进一步探究。
本研究发现,FF刺激FGF21的循环水平增加,提示FGF21在FF改善机体脂质代谢过程中发挥重要作用。FF治疗后可显著改善小鼠脂质代谢,表现为改善小鼠血脂水平,减轻HFD引发的肝脏脂质沉积状况。值得注意的是,FF对FGF21 KO小鼠的保护作用大大减弱。此外,FF处理显著抑制胆固醇调节元件结合蛋白Srebp-2的表达,上调脂肪酸氧化基因Acacb,胆固醇转运基因ABCG5和ABCG8、胆汁酸代谢基因Cyp7a1的表达,这表明在HFD喂养条件下,FF给药可能抑制胆固醇合成,同时可能有助于促进小鼠肝脏脂质氧化代谢,加速脂质利用,进而减轻肝脏脂质沉积;而FGF21基因敲除后,FF对机体脂质代谢的改善作用明显减弱。以上结果提示,FF发挥抗脂肪肝的生物学作用至少部分是通过上调FGF21的表达来实现的。Adiponectin在FGF21调控糖脂代谢过程中扮演重要角色[8],它是PPARγ的下游效应物,并且是PPARγ激动剂噻唑烷二酮发挥胰岛素增敏和保护血管等作用的重要介质[23-25]。那么,FGF21调控肝脏脂质代谢是否与Adiponectin相关有待于进一步探索。本研究检测了各组小鼠机体的PPARγ和Adiponectin的表达水平,结果显示FF刺激WT小鼠体内PPARγ和Adiponectin水平明显上调,推测是由于FF刺激肝组织合成FGF21并将其分泌到循环系统,与脂肪组织中的受体结合从而激活PPARγ信号通路,进而上调Adiponectin的表达和分泌。有研究表明,脂肪组织在介导FGF21发挥降低TG作用方面是必需的[26],Adiponectin缺乏导致FGF21对HFD诱导的高TG血症的抑制作用受损[7]。与文献调研结果一致,本研究结果表明:FGF21基因缺失后,FF刺激PPARγ及Adiponectin表达增加的现象被显著抑制,同时,FF引发的降低血清TG的作用也被明显减弱,提示Adiponectin在FGF21介导FF发挥抗脂肪肝作用中扮演重要角色。
综上所述,在HFD喂养条件下,FF通过激活PPARα通路刺激FGF21表达增加,后者可能通过间接或直接的方式促进肝脏组织中脂肪酸燃烧来发挥其改善机体肝脏脂质代谢的生物学效应。
